为适应大规模核辐射突发事故中人群辐射损伤评估的要求,以灵敏、快速、微创、适用范围广为前提的代谢组学技术近年来开始用于辐射生物标志物的筛选研究,为新型生物剂量计的研发提供了新思路[1-3]。目前,现有的研究主要是针对分布比较均匀的全身照射(TBI),关注的是机体整体受照剂量。然而,在核与辐射事故现场,照射多为不均匀局部照射(PBI)[4-5],引起某一局部组织的严重损伤,寻找PBI辐射损伤标志物显得愈发重要。国内外已有PBI照射后外周血细胞遗传学、血浆蛋白组、基因表达以及miRNA变化等研究报道[4, 6-7],但有关PBI引起的代谢组学变化少见报道。
基于此,本研究利用基于气相色谱-质谱(GC-MS)的代谢组学技术,对大鼠进行X射线单次全胸照射(WTI),通过监测辐射后2~5 d血浆代谢物水平的动态变化,筛选出辐射损伤特征差异代谢物并初步探讨其涉及的代谢通路,为寻找非均匀PBI早期辐射损伤标志物以及揭示WTI辐射损伤机制提供实验依据。
材料与方法1.实验动物:SPF级雄性Wistar大鼠,体重180~200 g,48只,由上海斯莱克实验动物有限责任公司提供(合格证号:2015000555854)。25℃室温下常规饲养,保持12 h倒置的光暗周期,自由进食饮水。
2.主要仪器与试剂:小动物放射治疗模拟定位机(X-RAD, Smart)购于美国Precision X-Ray公司;气相色谱-质谱联用仪(GC-MS,TSQ 8000 Evo)购于美国Thermo公司;衍生化试剂N-甲基-N-三甲基硅烷基三氟乙酰胺(MSTFA)、吡啶、甲氧胺盐,以及内标十三酸购于美国Sigma-Aldrich公司。甲醇、乙腈等色谱级有机溶剂购于美国TEDIA公司。
3.动物分组与处理:常规饲养10 d后,将大鼠按照完全随机分组法随机分为健康对照组10只和WTI照射组30只。照射组经6.74 mg/ml甲苯噻嗪和28.4 mg/ml氯胺酮混合溶液腹腔注射麻醉[8]后接受15 Gy单次X射线WTI照射(剂量率为2 Gy/min,源皮距为30 cm), 照射范围上至两腋窝,下至胸骨及剑突,照射野面积约3.5 cm×4.0 cm。于WTI照射后第2、3、5天,麻醉大鼠后腹腔静脉采血(EDTA抗凝),3 000 r/min,离心半径8.37 cm,离心15 min取血浆。健康对照组大鼠不予照射,采用与WTI照射组相同处理方式获取血浆。
4.肺组织病理观察:取健康对照组和WTI照射组照后5 d肺组织,使用10%中性甲醛固定24 h,常规脱水、石蜡包埋、切片、HE染色,镜下观察肺组织病理结构改变。
5.样本预处理:血浆样本处理方法参照文献[9]。取100 μl血浆样本于1.5 ml EP管中,加入400 μl乙腈、80 μl 2, 4-二氯苯甲酸(0.2 mg/ml)内标,混匀1 min,取500 μl上清放入真空冷冻干燥机中冻干。向冻干后的样品中加入50 μl甲氧胺吡啶溶液(15 mg/ml),于70℃水浴中肟化1 h。加入50 μl MSTFA,于70℃水浴中硅烷化1 h。衍生完成后,于13 000 r/min,离心半径8.37 cm,4℃条件下离心15 min,取上清液进行GC-MS分析。
6.气相色谱与质谱分析:代谢物经毛细管柱DB-5MS(30 m×250 μm×0.25 μm,美国Agilent公司)分离。载气(高纯氦)线性速度为40.0 cm/s,采用恒流模式,流速为1 ml/min,进样量为1 μl,分流比为100:1。程序升温条件:起始温度70℃保持3 min后,以5℃/min的速率升至310℃后,保留10 min。质谱条件:进样口温度和离子源温度设为310℃,采用电子电离(EI)的离子化方式,电离能量为70 eV,质量扫描范围45~500质荷比(m/z)。
从健康对照组和WTI照射组大鼠血浆样本中,每份取等量混合分别组成质量控制(QC)样本,考察仪器运行的稳定性和重现性。QC样本的预处理方法和数据采集条件均与实验样本相同,在实验运行过程中,血浆样本进样顺序完全随机,每8个实验样本后插入一个QC样本,对仪器分析过程进行实时监测,用于评价方法的重复性。
7.统计学处理:将血浆代谢物的原始峰面积归一化至内标,利用SPSS 21.0进行数据分析,检验表明数据符合正态分布及方差齐性。单因素方差分析用于多组间比较,组间比较采用LSD-t检验,错误发现率(FDR)控制其假阳性发现率。P < 0.05及FDR < 0.05为差异有统计学意义。主成分分析(PCA)和代谢通路分析在MetaboAnalyst(http://www.metaboanalyst.ca/)中完成,热图分析在MeV(Multiple ExperimentViewer)上完成。
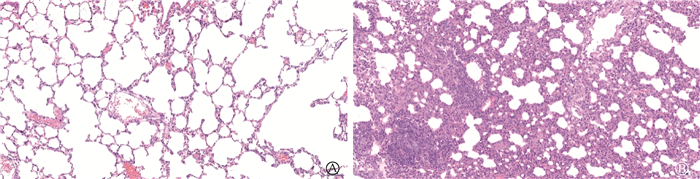
结果1.肺组织病理观察:作为WTI照射涉及的靶器官,肺组织属于辐射敏感组织。大鼠肺组织HE光镜可观察到,健康对照组肺泡壁较薄,肺泡结构清晰,形态自然,未见明显炎性细胞浸润;WTI照射组肺组织照射后3 d肺泡壁渐增厚,至照射后5 d明显可见大量肺泡壁增厚,伴有较多淋巴细胞与中性粒细胞等炎性细胞浸润(图 1)。
|
图 1 大鼠全胸照射后5 d肺组织病理变化 HE染色 ×200 A.健康对照组;B. WTI照射组 Figure 1 The pathological changes of the rat lung tissues at 5 d after whole thorax irradiation HE staining ×200 A. Control group; B. Irradiation group |
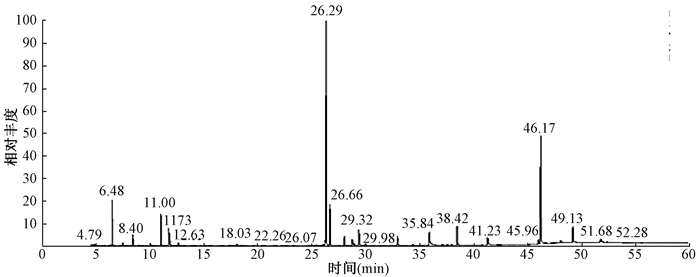
2.血浆代谢轮廓分析性能的评价:从血浆样本的GC-MS总离子流图谱可以看出,血浆样本代谢物分离良好(图 2),样本中代谢物主要包括有机酸、氨基酸、糖和脂肪酸几类物质。用QC样本中代谢物的相对含量RSD的分布考察分析方法和系统的稳定性。结果表明,血浆样本分析过程中,分别有74.6%、90.0%、95.0%的代谢物RSD分别在10%、20%、30%以内,表明该分析系统和分析方法具有高度的稳定性,获得的样本差异信息能反映生物体真实的代谢变化。
|
图 2 大鼠血浆样本的GC-MS总离子流图 Figure 2 Total ion current chromatograms of the rat plasma sample in GC-MS |
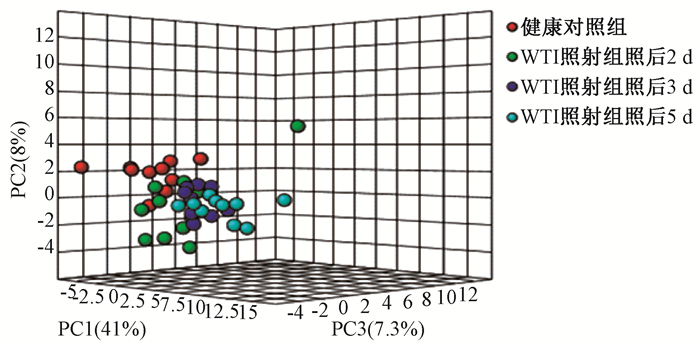
3.血浆代谢轮廓分析:对健康对照组和WTI照射组不同时间点(照后2、3、5 d)的血浆代谢物分析数据进行可视化的多变量分析。主成分分析(PCA)用于揭示WTI照射引起的全局代谢扰动以及代谢差异。如图 3所示,健康对照组与WTI照射组显示出清楚的分离状态,并且随着照后时间延长,WTI照射组与健康对照组的分离趋势越加明显,揭示了WTI照射组严重的代谢扰动,并且其代谢差异随照后时间的增加而愈加明显。
|
图 3 大鼠全胸照射后不同时间血浆样本的PCA得分图 Figure 3 PCA analysis of rat plasma sample at different time after WTI |
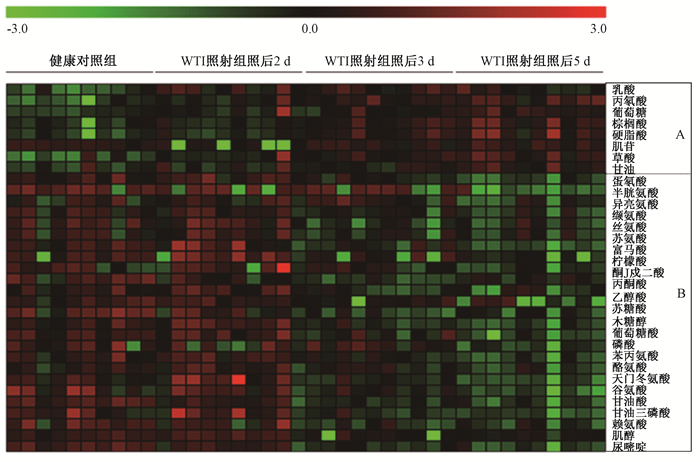
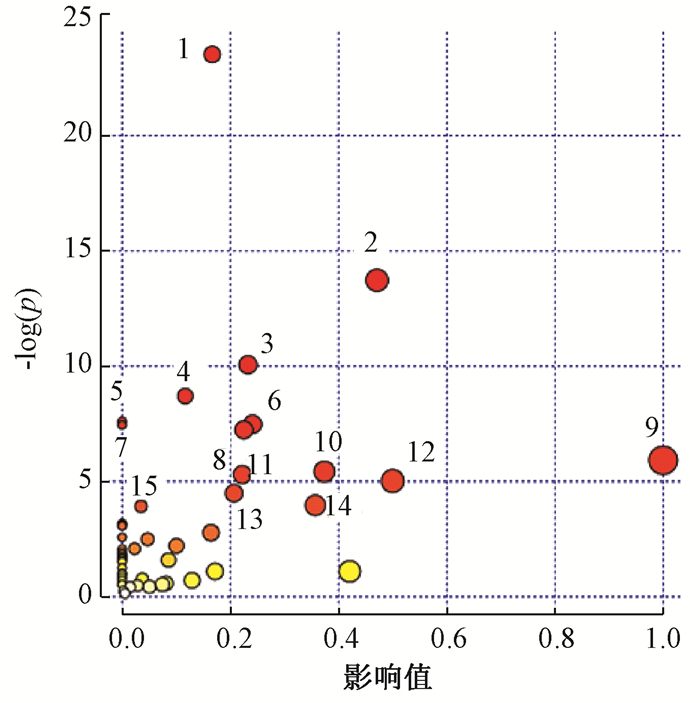
4.辐射损伤相关的特征代谢物分析:根据前期鉴定代谢物的方法[9],通过单因素方差分析方法量化代谢差异,从血浆中鉴定出包括丙酮酸、乳酸、氨基酸(缬氨酸、异亮氨酸、半胱氨酸、谷氨酸、苯丙氨酸、酪氨酸等)、葡萄糖等在内的33个特征差异代谢物(P < 0.05, FDR < 0.05,表 1)。辐射后3~5 d大部分的差异代谢物在血浆中的水平显著下降,少部分明显上升。根据差异代谢物的聚类结果(图 4),区域A中的肌苷、丙氨酸、棕榈酸、硬脂酸、乳酸、葡萄糖等代谢物在血浆中显著性上升,而区域B中的代谢物,包括大部分氨基酸、有机酸、苏糖酸等物质,在血浆中显著性下降。这些差异代谢物涉及的有显著性改变的代谢途径有氨酰转运RNA生物合成、丙氨酸、天冬氨酸和谷氨酸代谢、缬氨酸、亮氨酸和异亮氨酸的生物合成、甘氨酸、丝氨酸和苏氨酸代谢、三羧酸(TCA)循环等(图 5)。
|
|
表 1 全胸照射后血浆特征差异代谢物的相对变化(x±s) Table 1 Changes of the relative levels of differential metabolites in rat plasma samples after WTI(x±s) |
|
图 4 WTI照射引起的大鼠血浆差异代谢物变化 Figure 4 Differential metabolites changes in rat plasma samples after WTI |
|
注:1.氨酰转运RNA生物合成;2.丙氨酸、天冬氨酸和谷氨酸代谢; 3.乙醛酸和二羧酸盐代谢; 4.精氨酸生物合成;5.缬氨酸、亮氨酸和异亮氨酸的生物合成; 6.甘氨酸、丝氨酸和苏氨酸代谢;7.泛酸盐和CoA生物合成;8.三羧酸(TCA)循环;9.苯丙氨酸、酪氨酸和色氨酸生物合成;10.甘油脂质代谢;11.半胱氨酸和蛋氨酸代谢;12. D-谷氨酰胺和D-谷氨酸代谢;13.丙酮酸代谢 图 5 WTI照射大鼠血浆差异代谢物通路分析 Figure 5 Pathways of the differential metabolites of rat plasma samples after WTI |
讨论
PCA分析模型用于揭示WTI照射引起的血浆代谢轮廓改变,健康对照组和WTI照射组的代谢差异随照后时间的延长愈加明显。代谢通路分析显示WTI主要引起了氨基酸代谢、TCA循环和脂类代谢途径的改变。
胸部照射后第3天或者第5天,血浆中蛋氨酸(Met)和半胱氨酸(Cys)水平显著下降。作为一种重要的蛋白氨基酸,Met可以通过蛋氨酸循环形成Cys。在蛋氨酸循环中,Met在蛋氨酸腺苷转移酶作用下生成S-腺苷蛋氨酸(SAM),后者在甲基转移酶作用下,将甲基转移给DNA等生物大分子使其甲基化。近年研究表明,电离辐射可引起包括斑马鱼、啮齿类动物以及放射性职业人员体内DNA甲基化水平的改变[10-12],而甲基化膳食可以改善这个状况[11]。同时,动物实验发现电离辐射可引起小鼠肺组织的低甲基化[13]。据此,推断WTI照射后的第3天或者第5天,血浆中与蛋氨酸循环相关的代谢物蛋氨酸和半胱氨酸含量显著下降可能与辐射引起的体内甲基化异常有关。
WTI照射后5 d,血浆中支链氨基酸(BCAA,异亮氨酸、缬氨酸)、赖氨酸、丝氨酸和苏氨酸水平均下降,这与TBI照射后引起血浆中相应氨基酸上升[14-15]不同。这些氨基酸可遵循一定的分解代谢途径通过中间物(乙酰CoA、丙酮酸)进入TCA循环。BCAA是蛋白代谢的底物和调控因子,TBI照射可使骨骼肌变性进而激活蛋白分解代谢并将其释放到到血液中使其血浆水平升高[15]。考虑到肺组织辐射敏感性较高,WTI照射主要引起了局部组织(肺)损伤[6],而TBI照射则导致了全身组织器官损伤。因此,两种照射方式引起血浆BCAA水平变化趋势不同可能与辐射引起的不同组织蛋白合成与代谢不同有关[14]。Zhang等[16]发现在脂多糖诱导的小鼠急性肺损伤模型中补充赖氨酸可以使TNF-α炎症因子回复到正常水平,并证实了赖氨酸能够有效地保护败血症引起的肺损伤。据此,推断血浆中赖氨酸水平递减式下降可能与放射性肺炎引起的消耗赖氨酸有关。
代谢通路分析(图 4)显示,WTI照射会明显改变三羧酸循环(TCA)代谢途径。TCA循环是糖类、脂肪酸、氨基酸代谢的共同途径。由图可以看出,WTI照射后第2天或第3天,血浆中TCA中间代谢物富马酸、苹果酸和α-酮戊二酸均显著性降低,这与其在TBI照射后血浆中的水平变化趋势相一致[17],提示胸部照射同样减慢了TCA循环周转。同时,甘氨酸、丝氨酸和苏氨酸可以转换成乙酰CoA进入TCA循环,这3种氨基酸水平的同时下降亦可能是TCA循环减慢的原因之一。此外,血浆中丙酮酸、磷酸戊糖途径中间产物,如葡萄糖酸和木糖醇水平在全胸照射后第3天和第5天亦明显下降,而血浆乳酸和葡萄糖则显著上升,提示胸部照射抑制了TCA循环和磷酸戊糖途径,增强了糖酵解途径,干扰了机体能量代谢。Judge等[18]证实电离辐射通过过表达乳酸脱氢酶(LDHA)产生过量的乳酸,进而促进肺组织肌成纤维细胞分化,据此推断,WTI照射引起的血浆乳酸水平显著上升可能与辐射引起的肺损伤有关。
WTI照射后,与血浆中大部分氨基酸水平显著降低不同,作为甘油三酯(TG)合成的主要前体物质如甘油、硬脂酸和棕榈酸在血浆中显著性升高。电离辐射可引起血浆中甘油三酯(TG)显著上升[19-20]。有研究报道电离辐射能够使脂蛋白脂肪酶(LPL)活性升高,脂蛋白脂肪酶活性升高可以促进脂蛋白中TG的释放[20-21],这可能是电离辐射后血浆中甘油、游离饱和脂肪酸(硬脂酸和棕榈酸)显著升高的原因。饱和脂肪酸通过结合和激活脂肪细胞或巨噬细胞中的Toll样受体4刺激炎症信号级联反应进而激活炎症分子核因子κB(NF-κB)和应激活化蛋白激酶(JNK)以及产生细胞因子[22-23]。WTI照射后血浆中游离饱和脂肪酸(硬脂酸和棕榈酸)水平的升高可能与电离辐射诱导的肺组织炎症有关。
如前所示,WTI照射主要引起了血浆氨基酸代谢、TCA循环、脂类代谢紊乱。对比本研究WTI与TBI文献中照射引起的啮齿类血样代谢特征变化,两种照射方式引起的主要共有血浆辐射损伤特征差异代谢物主要包括三羧酸循环中间代谢物(富马酸、苹果酸和α-酮戊二酸),表明这两种照射模式均引起了线粒体损伤。同时,一些代谢特征在两种照射方式下表现出相反的变化趋势,如血样BCAA、丝氨酸、苏氨酸以及赖氨酸在TBI照射后升高而在WTI照射后降低,提示代谢特征具有区分TBI照射和局部照射(PBI)的潜力。本研究利用WTI照射作为局部照射模型,研究了辐射5 d内大鼠血浆代谢特征的变化,为核与辐射事故中辐射损伤早期标志物的发现以及放射性损伤修复机制研究提供了实验依据。同时,本研究仍存在一些不足:由于辐射生物效应调控的复杂性,必须从剂量-效应和时间-效应两个方面考察电离辐射对机体代谢物水平的影响。本研究中,WTI照射只用了一个照射剂量,无法筛选出辐射生物剂量指标。后续研究中,将通过时间序列样本采集,动态考察不同照射剂量中代谢物水平的变化进而寻找评估辐射剂量的代谢指标。肺组织是WTI照射的主要受损器官,要更为稳定、可靠的放射性肺损伤标志物需要联合肺组织代谢特征研究研究。因而,后续研究中拟在进一步扩大照射后时间范围的基础上,动态地研究体液和组织代谢特征变化以便筛选出更为稳健的生物剂量估算标志物。
利益冲突 所有研究者均未因进行该研究而接受任何不正当的职务或财务利益,在此对研究的独立性和科学性予以保证
作者贡献声明 吴涵旭负责实验运行、数据处理和论文撰写;王嘉豪、蒋雅雯和徐超负责实验动物处理及样本收集;王畅负责实验设计论文思路指导及修改
| [1] |
Roh C. Metabolomics in radiation-induced biological dosimetry:a mini-review and a polyamine study[J]. Biomolecules, 2018, 8(2): 24. DOI:10.3390/biom8020034 |
| [2] |
Pannkuk EL, Laiakis EC, Mak TD, et al. A lipidomic and metabolomic serum signature from nonhuman primates exposed to ionizing radiation[J]. Metabolomics, 2016, 12(5): 50. DOI:10.1007/s11306-016-1010-0 |
| [3] |
Pannkuk EL, Fornace AJ, Laiakis EC. Metabolomic applications in radiation biodosimetry:exploring radiation effects through small molecules[J]. Int J Radiat Biol, 2017, 93(10): 1151-1176. DOI:10.1080/09553002.2016.1269218 |
| [4] |
Blakely WF, Sandgren DJ, Nagy V, et al. Further biodosimetry investigations using murine partial-body irradiation model[J]. Radiat Prot Dosim, 2014, 159(1-4): 46-51. DOI:10.1093/rpd/ncu127 |
| [5] |
Prasanna PG, Blakely WF, Bertho JM, et al. Synopsis of partial-body radiation diagnostic biomarkers and medical management of radiation injury workshop[J]. Radiat Res, 2010, 173(2): 245-253. DOI:10.1667/RR1993.1 |
| [6] |
Ghandhi SA, Turner HC, Shuryak I, et al. Whole thorax irradiation of non-human primates induces persistent nuclear damage and gene expression changes in peripheral blood cells[J]. PLoS One, 2018, 13(1): e0191402. DOI:10.1371/journal.pone.0191402 |
| [7] |
刘佳.局部分次照射人外周血浆中miRNA表达水平及其靶基因的分析[D].北京: 中国疾病预防控制中心, 2016. Liu J. Expression of miRNA and target genes levels in human peripheral blood plasma after fractionated partial irradiation.[D]. Beijing: Chinese Center for Disease Control and Prevention, 2016. |
| [8] |
余情, 顾莹, 陈统一. 氯胺酮与甲苯噻嗪用于大鼠脊髓损伤模型的麻醉效果[J]. 上海医学, 2011, 34(8): 594-597. Yu Q, Gu Y, Chen TY. Anesthetic effect analysis of ketamine and xylazine in establishing spinal cord injury model in rats[J]. Shanghai Med J, 2011, 34(8): 594-597. |
| [9] |
赵明晓, 鲍协炳, 陈怀远, 等. 需行全身照射患者辐射损伤血浆代谢谱的研究[J]. 中华放射医学与防护杂志, 2017, 37(1): 7-11. Zhao MX, Bao XB, Chen HY, et al. Preliminary study on plasma metabolites of total body irradiation patients[J]. Chin J Radiol Med Prot, 2017, 37(1): 7-11. DOI:10.3760/cma.j.issn.0254-5098.2017.01.002 |
| [10] |
Kamstra JH, Hurem S, Martin LM, et al. Ionizing radiation induces transgenerational effects of DNA methylation in zebrafish[J]. Sci Rep, 2018, 8(1): 15373. DOI:10.1038/s41598-018-33817-w |
| [11] |
Koturbash I, Miousse IR, Sridharan V, et al. Radiation-induced changes in DNA methylation of repetitive elements in the mouse heart[J]. Mutat Res, 2016, 787: 43-53. DOI:10.1016/j.mrfmmm.2016.02.009 |
| [12] |
Batra V, Sridhar S, Devasagayam TP. Enhanced one-carbon flux towards DNA methylation:Effect of dietary methyl supplements against gamma-radiation-induced epigenetic modifications[J]. Chem Biol Interact, 2010, 183(3): 425-433. DOI:10.1016/j.cbi.2009.11.010 |
| [13] |
Pogribny I, Raiche J, Slovack M, et al. Dose-dependence, sex- and tissue-specificity, and persistence of radiation-induced genomic DNA methylation changes[J]. Biochem Biophys Res Commun, 2004, 320(4): 1253-1261. DOI:10.1016/j.bbrc.2004.06.081 |
| [14] |
Holecek M, Skopec F, Sprongl L, et al. Effect of alanyl-glutamine on leucine and protein metabolism in irradiated rats[J]. Amino Acids, 2002, 22(1): 95-108. DOI:10.1007/s726-002-8203-0 |
| [15] |
Khan AR, Rana P, Devi MM, et al. Nuclear magnetic resonance spectroscopy-based metabonomic investigation of biochemical effects in serum of gamma-irradiated mice[J]. Int J Radiat Biol, 2011, 87(1): 91-97. DOI:10.3109/09553002.2010.518211 |
| [16] |
Zhang Y, Yu W, Han D, et al. L-lysine ameliorates sepsis-induced acute lung injury in a lipopolysaccharide-induced mouse model[J]. Biomed Pharmacother, 2019, 118: 109307. DOI:10.1016/j.biopha.2019.109307 |
| [17] |
Liu H, Wang Z, Zhang X, et al. Selection of candidate radiation biomarkers in the serum of rats exposed to gamma-rays by GC/TOFMS-based metabolomics[J]. Radiat Prot Dosim, 2013, 154(1): 9-17. DOI:10.1093/rpd/ncs138 |
| [18] |
Judge JL, Owens KM, Pollock SJ, et al. Ionizing radiation induces myofibroblast differentiation via lactate dehydrogenase[J]. Am J Physiol Lung Cell Mol Physiol, 2015, 309(8): L879-887. DOI:10.1152/ajplung.00153.2015 |
| [19] |
Feurgard C, Bayle D, Guézingar F, et al. Effects of ionizing radiation (neutrons/gamma rays) on plasma lipids and lipoproteins in rats[J]. Radiat Res, 1998, 150(1): 43-51. DOI:10.2307/3579644 |
| [20] |
Pote MS, Gandhi NM, Mishra KP. Antiatherogenic and radioprotective role of folic acid in whole body gamma-irradiated mice[J]. Mol Cell Biochem, 2006, 292(1-2): 19-25. DOI:10.1007/s11010-006-9135-5 |
| [21] |
Povoa H Jr, Marcondes N, Fernandes L, et al. Folic acid and lipoprotein lipase from aorta and blood plasma of atherosclerotic rats[J]. Biomed Biochim Acta, 1984, 43(2): 241-244. DOI:10.1007/BF02987207 |
| [22] |
Santaren ID, Watkins SM, Liese AD, et al. Individual serum saturated fatty acids and markers of chronic subclinical inflammation:the insulin resistance atherosclerosis study[J]. J Lipid Res, 2017, 58(11): 2171-2179. DOI:10.1194/jlr.P076836 |
| [23] |
Kennedy A, Martinez K, Chuang CC, et al. Saturated fatty acid-mediated inflammation and insulin resistance in adipose tissue:mechanisms of action and implications[J]. J Nutr, 2009, 139(1): 1-4. DOI:10.3945/jn.108.098269 |
 2020, Vol. 40
2020, Vol. 40


