2. 中山大学肿瘤防治中心放疗科, 广州 510060;
3. 北京航空航天大学图像中心 100083
2. Department of Radiation Oncology, Sun Yat-Sen University Cancer Center, Guangzhou 510060, China;
3. Image Processing Center, Beihang University, Beijing 100083, China
术中电子束放疗(intra-operative electron beam radiation therapy,IOERT)是在手术中对可见肿瘤、瘤床区或易复发转移部位,在直视下的一次大剂量电子束放疗[1]。该技术最大的优势之一是可以将部分或全部临近靶区的重要器官推到射野外,保护靶区周围正常组织及器官;优势之二是电子束剂量跌落迅速,通过选择合适的电子束能量能够保护靶区后方的正常组织。IOERT中使用的加速器配有圆形或方形的限光筒,这些限光筒只能产生平面的剂量分布。对于脑转移瘤术后呈半球面分布的瘤床,目前的电子束照射技术无法产生适形的剂量分布。蒙特卡罗(Monte Carlo,MC)方法可以模拟粒子与物质相互作用的全过程,已被用于研究IOERT的剂量学优化问题[2-4]。本研究的目的是使用MC模拟设计适用于Mobetron加速器的脑转移瘤术中放疗施照器,设计的目标是产生半球面剂量分布和提供尽可能高的剂量率确保IOERT治疗时间在临床可接受的范围内。
材料与方法1.施照器设计:电子直线加速器配备的常规限光筒末端均为开放型,能够产生平面的剂量分布。而本研究中将设计的施照器是为了配合电子直线加速器中电子束产生半球面剂量分布,其作用不仅是限制电子束,还具备散射和调制射线束的功能。根据北京协和医学院肿瘤医院脑外科医生和放射治疗科医生建议,适用于脑转移瘤术中放疗的施照器具备下列特征:①具备半球面的外形。②限光筒直径<3 cm。③能够将电子束散射到半球面表面。④能够调制射线束在半球面上产生均匀的剂量分布。根据这些特征设计施照器包括圆柱形限光筒(直径为2.5 cm),散射箔(直径为2.3 cm)和半球囊部(直径为2.5 cm)见图 1。这类施照器称为半球囊状施照器,半球囊部表面称为半球囊状施照器表面。
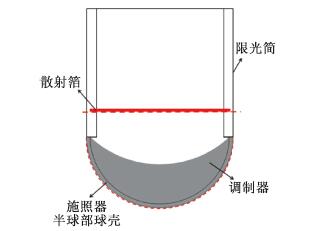
|
图 1 施照器结构示意图 Figure 1 Schematic of semi-spherical applicator |
施照器设计包括:散射箔厚度、散射箔位置和调制器的设计。其中散射箔厚度和调制器设计的方法已发表[2],此处简要介绍。
第1步,散射箔厚度设计。由于高能电子与物质相互作用的散射角与物质原子序数平方成正比,与物质厚度成正比[5],所以散射箔的材料确定为高原子序数的金属钨。通过模拟计算一系列不同厚度圆形钨散射箔(厚度范围0.1 ~1.5 mm,间隔0.1 mm)的散射角和剂量率,在保证散射角尽量大、剂量率尽量高的前提下,确定散射箔厚度。
第2步,散射箔位置设计。电子束经散射箔散射后,电子的分布在0°至90°的范围内,分布差异度决定了调制器的调制难度。随着散射箔位置的提升,散射角大的电子(数量相对少)将被限光筒遮挡,而能够照射到半球囊状施照器表面的电子数量在角分布上差异将缩小。本研究中设置散射箔位于限光筒和半球囊部衔接的位置为参考位置,散射箔向限光筒方向移动,在施照器半球囊部无调制器时建立一系列位置评估模型(范围0 ~0.8 cm,间隔0.1 cm)。通过模拟计算位置评估模型表面平均能量的方差,方差越小表示施照器表面的平均能量越均匀,越易于使用调制器调制。这种方法将降低半球囊状施照器的剂量率,目前临床使用的术中放疗照射的最低剂量率是45 cGy/min[6]。因此,位置升高后散射箔衰减的剂量率要高于70 cGy/min,才能保证经过调制器衰减的剂量率满足临床要求。
第3步,调制器设计。调制器的外表面与球壳的内表面吻合,调制器的设计只需要确定调制器的内表面特征。首先,针对半球囊状施照器几何结构特征,设计一系列不同厚度的调节层,并计算各个方向的径向厚度;随后,通过模拟计算各个调节层存在时施照器表面的剂量,建立径向厚度和该方向上施照器表面的剂量关系曲线;最后,通过插植的方法,确定在施照器表面产生特定剂量时所需要的径向厚度,即调制器的内表面特征。
2.建模与剂量计算:通过模拟一定量粒子(通常是百万、千万数量级)与介质发生相互作用的过程,MC模拟能够保证粒子束与物质相互作用时剂量分布的计算精度,因此被誉为医学物理领域的“金标准”,多个关于术中放疗加速器的研究中使用了MC模拟方法[4, 7-10]。
本研究使用BEAMnrc/EGSnrc模拟Mobetron机头(出射窗、初级散射箔、次级散射箔、初级准直器、电离室、限光筒)、位置评估模型、调节层和施照器。在上述模拟过程中,为保证统计不确定性<0.3%(一个标准差),模拟的粒子数均为5×108。电子和光子的截止能量分别为0.7 MeV和1 keV,没有使用减方差技术。MC EGS4/DOSXYZ程序用于计算施照器放置在边长为9 cm分辨率为0.2 cm×0.2 cm×0.2 cm的均匀立方体中,电子束能量为12 MeV的剂量分布。Mobetron常规限光筒模拟剂量已与EBT3胶片测量结果比较,在2%/1 mm的标准下符合要求。
此外,MC模拟中的相空间文件用于分析两个位置的粒子信息。这两个位置分别为散射箔下方的平面和施照器的外表面见图 1。使用BEAMDP(BEAMData Processor)软件分析前者相空间文件中粒子的角分布;MatLab编程分析后者粒子的平均能量和通量。
结果1.散射箔位置:本研究中半球囊状施照器中散射箔的厚度为0.14 cm。如图 2所示,对于12 MeV的电子束,位置评估模型表面的电子平均能量随角度变化而变化。与电子束入射方向平行的方向角度为0°,与电子束入射方向垂直的方向角度为90°。在角度最大90°时,电子平均能量最低。此外,能量还随着散射箔位置的提高而降低。
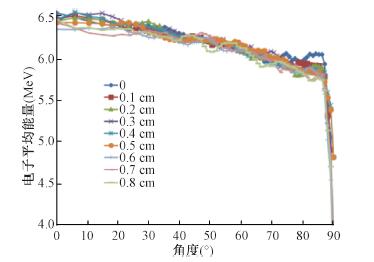
|
图 2 位置评估模型表面平均能量随角度变化图 Figure 2 Angular distributions of mean energy on surface of location evaluation model |
图 3示出随着散射箔位置的提高,电子平均能量的方差在变化,当位于0.5 cm高度时,方差最小。因此,对于12 MeV的电子束,施照器散射箔厚度为0.14 cm时,其位置确定在距离限光筒末端上方0.5 cm处。此时,根据BEAMDP软件分析相空间文件中电子的角分布计算结果,有约10%的电子被限光筒壁遮挡。

|
图 3 施照器表面平均能量的方差 Figure 3 Variance of the mean energy on the surface of the applicator |
2.施照器几何结构和剂量分布:为了将限光筒表面剂量控制在施照器表面剂量的5%以内,限光筒部分设计为0.2 cm的水等效材料内筒和0.3 cm的不锈钢外筒。调制器为月牙形,在电子束入射方向厚度最大。
图 4为半球囊状施照器置于均匀水模体中冠状位(垂直于电子束入射方向距离限光筒与半球囊部衔接处0.8 cm平面)和横断位(平行于电子束入射方向过半球囊部球心平面)的剂量分布。剂量归一至施照器中心轴与施照器表面交点处剂量。经MC模拟计算,半球囊状施照器表面剂量率约为160 cGy/min, 50%剂量深度为0.85 cm。
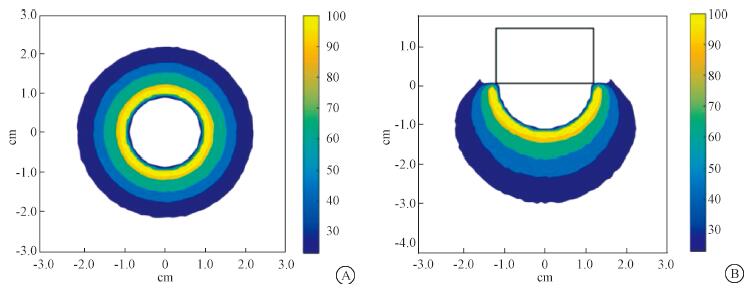
|
图 4 均匀水模体中冠状位(A)和横断位(B)的剂量分布B中方块为限光筒 Figure 4 Dose distributions in the homogeneous phantom in the coronal (A) and axial plane (B) The rectanglular (B) refers to the collimator |
本研究中的施照器具有旋转对称性和轴对称性,因此在冠状位上所有方向的剂量随深度变化曲线旋转对称,而横断位上的剂量随深度变化曲线是左右对称。研究发现,冠状位的剂量分布与施照器表面适形度很好,而横断位的剂量分布在接近施照器半球囊部开口和末端的区域,适形度较差。
3.能谱和角分布:图 5为半球囊状施照器表面粒子的能谱和角分布。角分布从限光筒和半球囊部衔接的位置下方0.06 cm(86°)处开始统计。通量曲线归一至0°时电子数量。如图 5所示,电子平均能量4.7 ~5.1 MeV,光子平均能量1.5 ~1.9 MeV,其中高能光子分布随角度变化不大,这是因为半球囊状施照器表面在电子束的入射方向上。这个结果与已有的高能电子与高原子序数的物质发生相互作用后沿电子方向产生光子的认知是符合的。
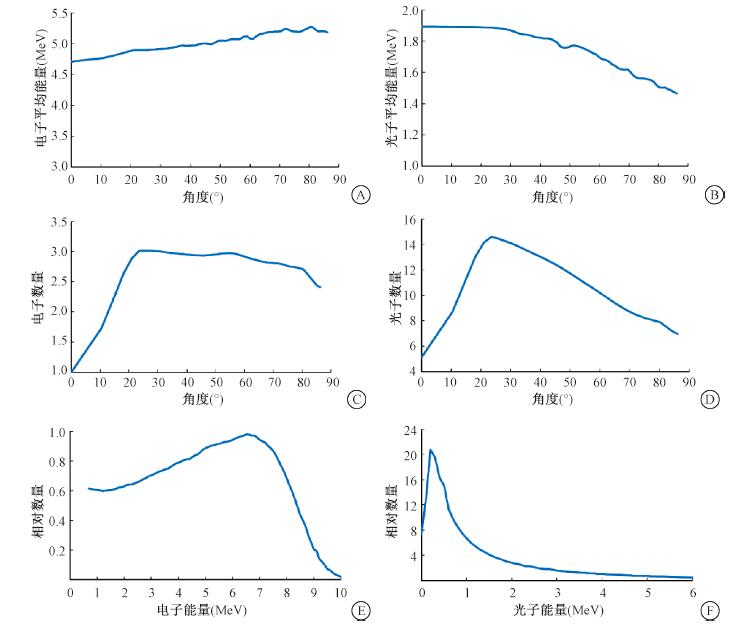
|
图 5 半球囊状施照器表面电子、光子的能谱和角分布A.电子平均能量;B.光子平均能量;C.归一至0°时电子数量;D.归一至0°时光子数量;E.归一至电子数量最大处;F.归一至光子数量最大处 Figure 5 The energy spectra and angular distributions of electrons (A, C, E), photons (B, D, F) at the exit of the outer surface of the semi-spherical applicator |
在图 1中红色曲虚线处的相空间文件中,光子数量是电子数量的4.7倍,约占射线束中粒子总数的83%,而低能光子(<1 MeV)比例为57%。
讨论本研究设计了半球囊部直径为2.5 cm,限光筒直径为2.5 cm的半球囊状施照器。确定限光筒的尺寸时考虑以下因素:①颅内肿瘤手术开口可以容纳最大的限光筒直径为3 cm。②限光筒外的辐射剂量应该<5%。随着限光筒直径变小射线束的输出量将变小,本研究选择使用尽可能大的限光筒得到尽可能高的输出量,限光筒内径为2 cm,壁厚0.5 cm,材料为水等效材料和不锈钢。在临床应用中,不锈钢材料对灭菌方式无特殊要求。
Mobetron 1000限光筒由上端的15 cm长的基座和下端15 cm长的限光筒组成,总长度是30 cm。在腹部肿瘤术中放疗时,靶区位于体内深处,需要使用30 cm长限光筒以便能够插入体内。然而,在脑转移瘤术中放疗中,靶区位置较浅,可缩短限光筒长度。因此,本研究中的限光筒长度定为5 cm。使用本研究方法可将半球囊部直径(与限光筒外直径相同)设计为其他尺寸,临床使用时根据术后瘤床的大小选择合适尺寸的施照器。
与球囊状施照器(剂量率为60 cGy/min,50%剂量深度为0.8 cm)[2]相比,半球囊状施照器的剂量率增加了1.7倍,50%剂量深度增加了0.05 cm。半球囊状和球囊状施照器的散射箔厚度和调制器最大厚度分别为0.14和1 cm和0.12和2.7 cm,这是两者剂量学指标存在差异的原因。电子束经散射箔散射和调制器调制后,平均能量降低,深度剂量减少,在施照器表面产生大量的低能X射线,增加了表面剂量。而术中放疗时由于瘤床暴露在外,增加的表面剂量在此时变为一种优势。同时,沿电子束入射方向产生了高能X射线,需要使用铅皮遮挡以保护后方的正常组织。当设计防护屏蔽时,需要考虑机头漏射和射线的散射。半球囊状施照器的散射箔改变了电子束方向,并引入了额外的X射线,增加了对患者辐射。此外,由于剂量率的降低,治疗时间将延长,这个时间因素也需要在防护设计时考虑。临床应用前,需要在施照器加工完成后进行实际的防护测量。
使用本研究设计的半球囊状施照器时,施照器表面与术后瘤床紧密适形贴合,可以避免术中血液、组织液等渗出后填满瘤腔而引起的剂量分布偏差。Mobetron配备的一系列限光筒只能产生平面的剂量分布。然而,术后的瘤床一般都是呈非平面分布,在一定程度上限制了Mobetron的临床应用范围。配备本研究中的半球囊状施照器有可能扩大Mobetron的应用范围。
综上,本研究以MC模拟设计的适用于高能电子束的半球囊状施照器,能产生半球面剂量分布。
利益冲突 所有研究者未因进行该研究而接受任何不正当的职务或财务利益, 在此对研究的独立性和科学性予以保证
作者贡献声明 马攀负责施照器设计及建立相关分析算法,分析结果, 并撰写论文; 李永宝和刘博负责蒙特卡罗算法设计和优化;李明辉和牛传猛负责在临床应用和工程设计方面指导施照器设计;谢欣和马敏负责数据统计和制图;周付根和戴建荣指导论文设计和修改
| [1] |
Beddar AS, Biggs PJ, Chang S, et al. Intraoperative radiation therapy using mobile electron linear accelerators:report of AAPM Radiation Therapy Committee Task Group No. 72[J]. Med Phys, 2006, 33(5): 1476-1489. DOI:10.1118/1.2194447 |
| [2] |
Ma P, Li Y, Tian Y, et al. Design of a spherical applicator for intraoperative radiotherapy with a linear accelerator-a Monte Carlo simulation[J]. Phys Med Biol, 2018, 64(1): 015014. DOI:10.1088/1361-6560/aaec59 |
| [3] |
Bernard D, Chu JC, Rozenfeld M, et al. Design optimization of intraoperative radiotherapy cones[J]. Int J Radiat Oncol Biol Phys, 2003, 55(5): 1446-1457. DOI:10.1016/s0360-3016(02)04489-9 |
| [4] |
Janssen RW, Faddegon BA, Dries WJ. Prototyping a large field size IORT applicator for a mobile linear accelerator[J]. Phys Med Biol, 2008, 53(8): 2089-2102. DOI:10.1088/0031-9155/53/8/006 |
| [5] |
International Commission on Radiation Units & Measurements. ICRU Report 33:Radiation quantities and units[M]. Oxford: Oxford UniversityPress, 1980.
|
| [6] |
Sethi A, Emami B, Small W Jr, et al. Intraoperative radiotherapy with INTRABEAM:Technical and dosimetric considerations[J]. Front Oncol, 2018, 8: 74. DOI:10.3389/fonc.2018.00074 |
| [7] |
Pimpinella M, Mihailescu D, Guerra AS, et al. Dosimetric characteristics of electron beams produced by a mobile accelerator for IORT[J]. Phys Med Biol, 2007, 52(20): 6197-6214. DOI:10.1088/0031-9155/52/20/008 |
| [8] |
Iaccarino G, Strigari L, D'Andrea M, et al. Monte Carlo simulation of electron beams generated by a 12 MeV dedicated mobile IORT accelerator[J]. Phys Med Biol, 2011, 56(14): 4579-4596. DOI:10.1088/0031-9155/56/14/022 |
| [9] |
Righi S, Karaj E, Felici G, et al. Dosimetric characteristics of electron beams produced by two mobile accelerators, Novac7 and Liac, for intraoperative radiation therapy through Monte Carlo simulation[J]. J Appl Clin Med Phys, 2013, 14(1): 3678. DOI:10.1120/jacmp.v14i1.3678 |
| [10] |
Moradi F, Ung NM, Khandaker MU, et al. Monte Carlo skin dose simulation in intraoperative radiotherapy of breast cancer using spherical applicators[J]. Phys Med Biol, 2017, 62(16): 6550-6566. DOI:10.1088/1361-6560/aa7fe6 |
 2020, Vol. 40
2020, Vol. 40


