放疗剂量验证,是核验计划可执行性、保证放疗安全准确的重要质量控制措施[1-2],对保障多中心放疗临床试验的剂量一致性也具有重要意义[3-4],美国肿瘤放射治疗协作组(RTOG)相当数量的临床试验明确要求临床试验参与机构需通过第三方核准的端对端(end-to-end)剂量验证测试。临床常用的剂量验证工具,如各类点电离室、辐射变色胶片、阵列探测器等,在三维剂量验证中存在测量盲区问题[5-7],而胶体剂量计,具有组织等效和三维测量的固有特点,是对现有剂量验证体系的有效补充[8-9]。Presage剂量计(美国Heuris公司),搭配三维光学CT扫描仪,可实现快速三维剂量验证[10-12],在高场强磁共振引导放疗的三维剂量学研究中扮演了重要角色[13-17]。本研究使用的Presage胶体剂量计是在原有大尺寸剂量计基础上加以改进,开发出了可采用胶片扫描仪做分层读出的新型片状剂量计,目前该剂量计尚处于临床试用阶段。本研究将梳理该剂量计基本特性与使用方法,并重点对该剂量计的剂量响应光谱、线性度、量程、稳定性等关键剂量特性开展研究,旨在为国内胶体计量学相关研究与临床应用提供参考。
材料与方法1.基本特性:新型片状Presage剂量计的基体材料为高分子聚氨酯塑料(polyurethane),机械强度较大,可做切割加工,长宽度均为6 cm、厚度为0.3 cm。辐射敏感试剂为隐性孔雀石绿衍生物,通体透明,呈淡蓝绿色,表面有轻微压制痕迹、内部稀疏可见点状颗粒物,见图 1。本研究使用同批次剂量计样品开展后续照射实验。

|
图 1 照射前后的Presage片状剂量计A.照射前;B.照射后 Figure 1 Photo of Presage sheet dosimeter: pre- irradiation (A) and post-irradiation (B) |
2.吸光度读取方法:片状剂量计是为胶片平板扫描仪读取所专门设计的,可采用与常规胶片读取类似的参数设置,即透射式扫描、无修正48位彩色模式。本研究使用Epson Expression 11000XL扫描仪(日本爱普生公司),每英寸点数(DPI)设为150,读取前开机预热超过24 h,同一图像重复采集8次,舍弃前5次结果,使用后3次并求取均值。
3.吸收光谱读取方法:为研究照射剂量对剂量计吸收光谱的影响,本研究使用分光光度计(CRT UV756,上海佑科仪器公司)对照射前后剂量计在400~700 nm可见光范围内的吸收光谱进行测量,测量前采集空白光场作为吸光度基准,测量时使用3D打印样品架做固定。
4.样品照射:剂量计照射工作均在Edge放疗直线加速器(美国Varian公司)上进行,将样品放置在射野中心处,建成环境与反散射环境均为5 cm厚固体水,源靶距(SSD)设为100 cm,采用6 MV光子束,剂量率设为600 MU/min。照射实验共分为3部分。
(1) 相同样品多次照射:对同一剂量计样品,依次使用100、200、300、400、500、800、1 000、1 200、1 500、2 000、3 000 MU进行照射,射野为10 cm×10 cm,每次照射前后均使用胶片平板扫描仪与分光光度计读取数据。
(2) 同批次样品分别照射:对同批次剂量计样品,分别使用50、100、200、400、600、800、1 000 MU进行照射,射野为10 cm×10 cm,照射前后均使用胶片平板扫描仪与分光光度计读取数据。同时,为评估剂量响应时间稳定性,使用胶片平板扫描仪对照射后样品做连续24 h数据读取。
(3) 单一样品半遮蔽射野照射:对单一样品,使用5 cm × 10 cm的非对称射野,对其进行500 MU照射,照射前后使用胶片平板扫描仪读取数据,为评估剂量梯度稳定性,使用胶片平板扫描仪对照射后样品做连续24 h数据读取。
5.样品保存:Presage剂量计对温度和紫外线敏感,对空气暴露不敏感。照射前样品做多层封装后保存在18℃的冷藏冰箱中,照射结束后,样品置于平板扫描仪扫描台上,避光暗室保存,实验间的中央空调温度设为18℃,温度控制波动为±2℃。
6.数据处理:使用MATLAB R2018b对胶片平板扫描仪生成的tif格式数据做R-G-B通道拆分、5×5中值滤波等预处理,选取样品中心约2 cm×2 cm方形区域作为感兴趣区域(ROI),依据公式(1)计算区域内照射前后的吸光度变化平均值。
| $ {A_{{\rm{bs}}}} = \lg \left( {\frac{{{I_0}}}{I}} \right) $ | (1) |
式中,I0为空白光场像素值;I为样品ROI区域像素值;Abs为吸光度。
使用MATLAB R2018b读取分光光度计输出的文本文件,提取吸收光谱并做特征计算。使用Origin 2019b做数据拟合和绘图。
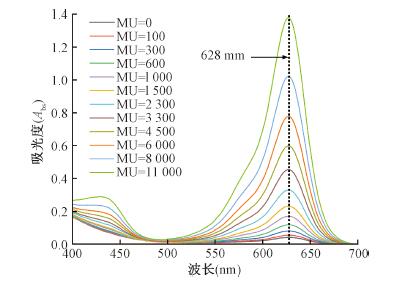
结果1.吸收光谱:同一样品各累积剂量下的剂量计吸收光谱测量结果见图 2,可看出在628 nm处存在明显吸收峰,且峰值吸光度随受照剂量显著变化,而在490 nm附近存在平缓的吸收谷,且吸光度随受照剂量变化不大。需指出,分光光度计对样品测量点位置敏感,为了排除样品多次加载出现的测量点位置偏差,进而造成光谱漂移,将原始测量光谱以700 nm处测量值为本底做扣除处理。
|
图 2 同一剂量计不同受照剂量下的吸收光谱 Figure 2 Spectra comparison for the same dosimeter between different dose deliveries |
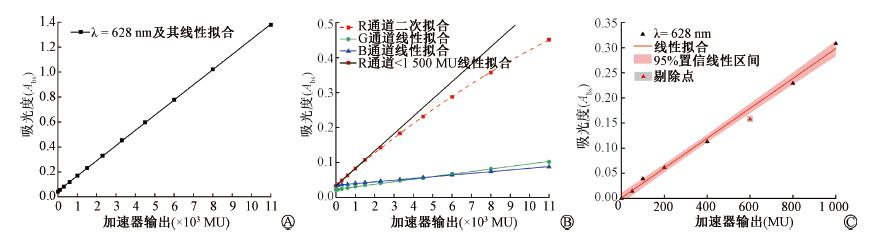
2.剂量响应线性与量程:对于相同样品多次累积照射部分,首先,将图 2中吸收峰的吸光度与累积受照剂量做线性拟合,得到图 3a,其中拟合优度R2=0.999 9,说明吸收峰处吸光度随受照剂量呈显著线性变化趋势。然后,通过胶片平板扫描仪测量得到的剂量计R-G-B 3通道吸光度见图 3b,可看出R通道吸光度测量灵敏度远大于G与B通道,经曲线拟合,其中G-B线性拟合优度R2分别为0.998 0、0.998 8,而R通道在受照剂量 < 1 500 MU范围内线性拟合优度R2为0.999 9,在全测量点范围内的二次拟合优度R2=0.999 9,可看出G与B通道吸光度随受照剂量高度线性,R通道吸光度在小量程范围内具有较好线性度,而在大量程范围内吸光度随受照剂量呈二次变化趋势更显著。
|
注:线性拟合公式y(x)=kx+b, 二次拟合式y(x)=ax2+bx+c 图 3 剂量计吸光度随交付剂量线性度分析 A.同一样品累积照射628 nm吸光度; B.同一样品累积照射R-G-B 3通道吸光度; C.不同样品R通道吸光度 Figure 3 Dose response absorption linearity analysis A. Absorption of the same dosimeter at 628 nm; B.R-G-B absorptions of the same dosimeter; C. R-channel absorptions of different dosimeters |
对于同批次样品分别照射部分,将各样品所受剂量与628 nm吸收峰处的吸光度做如图 3c所示绘制,可看出各数据点明显受不确定度影响,且灰色数据点显著偏离整体变化趋势。将该点做剔除后对其余数据点做线性拟合,可看出其余数据点均在95%的置信区间内,说明整体线性度较好。
关于剂量计量程,本研究中给予剂量计的最大累积剂量为11 000 MU,经百分深度剂量测算后所对应的吸收剂量为94.6 Gy,从图 3可看出,在94.6 Gy处剂量计未出现饱和效应,据此可推断出该剂量计的量程应>94.6 Gy。
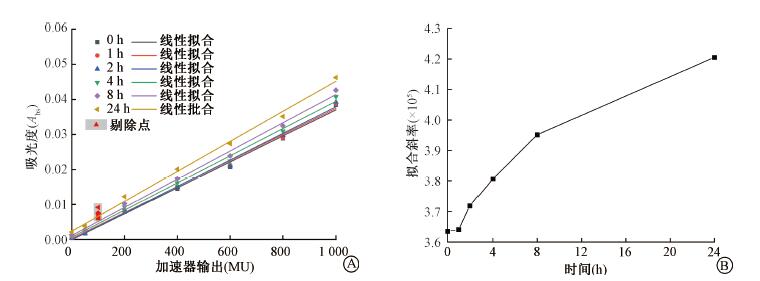
3.剂量响应稳定性:将同批次样品照射后在不同测量时间点经胶片平板扫描仪R通道读出的吸光度按照受照剂量做线性拟合。照射后随保存时间延长,样品吸光度逐渐增加。将各测量时间点下样品吸光度拟合直线的斜率做比较,可看出在照射结束后1 h内,样品吸光度基本不发生变化,随着保存时间延长,样品吸光度增大速度随受照剂量呈正相关,在照射结束24 h时,吸光度拟合直线斜率增加了约16%,见图 4。
|
注:线性拟合公式y(x)=kx+b 图 4 照射后片状剂量计R通道吸光度随时间变化结果A.不同时间加速器输出变化的吸光度;B.随保存时间变化的拟合直线斜率 Figure 4 Temporal changes of post-irradiation R-channel absorptions A.Absorptions and relative linear fittings over linac output at various times; B. Fitting gradients changes over time |
关于半屏蔽射野照射后经胶片平板扫描仪R通道读出的剂量梯度区吸光度值稳定性问题, 由于照射后样品的吸光度会随保存时间发生变化, 为更好地反映这种吸光度变化对于剂量梯度区测量的影响, 选取射野外平坦区域作为测量本底, 对剂量梯度区剖面线上各点的吸光度值进行本底扣除。结果发现,在1 h以后,剂量梯度区的吸光度剖面线未出现模糊现象,各点吸光度值变化可忽略,但随着保存时间增加,梯度区剖面线的陡峭程度呈上升趋势,且在射野内区域吸光度值增加显著,提示照射后剂量计的吸光度随时间变化增加速度与受照剂量正相关。
讨论Presage作为典型的商业化胶体剂量计产品,最早由从事放射化学研究的Adamovics和Maryanski[18]提出并注册专利,在不断优化制备工艺的同时,先后合成了数十种分子结构各异的辐射变色试剂,持续改进了Presage剂量计的各项特性[19]。文献报道传统Presage剂量计的吸收峰位于633 nm[20],而本研究发现该新型片状剂量计的吸收峰位于628 nm,可能与其使用了新型辐射敏感试剂有关。
该新型片状Presage剂量计质地较硬、表面光滑,光通透性较好,未见在大尺寸Presage中据报存在的结构性细纹(Schlieren)[21],但个别样品存在厚度不均、小幅弯曲现象。本研究所使用的分光光度计与胶片平板扫描仪的测量精度,受样品厚度与入射夹角影响明显,经分析,实验数据中的异常点与对应样品表面存在小幅曲度有关,这提示在使用该片状剂量计前需对样品厚度和表面曲度做“选片”。使用中还发现,未经照射的剂量计无法在室温条件下长期保存,在室温25℃避光保存两周后,剂量计蓝绿色加深,明显可见隐性试剂发生显色反应所形成的颗粒状斑点。
综合实验结果,该新型片状Presage剂量计在吸收峰628 nm处的吸光度与剂量呈高度线性变化,在使用胶片平板扫描仪R通道读出时,在 < 10 Gy剂量范围内吸光度随受照剂量呈显著线性变化趋势,而在大量程范围吸光度随吸收剂量呈二次变化,这提示在应用该剂量计时需留意剂量测量范围问题。该剂量计具有超过94.6 Gy的量程,能够满足立体定向放射外科(SRS)、体部立体定向放疗(SBRT)等大分割放疗技术剂量验证对剂量量程的要求。该剂量计照射后在室温避光条件下,未出现剂量梯度模糊现象,在1 h内吸光度未出现显著变化,但随保存时间延长而缓慢增加,且增加速度与受照剂量呈正相关,这提示当使用该剂量计做绝对剂量测量时,需特别注意刻度曲线的时间修正问题。
本研究中对同一样品进行了多次不同剂量照射,在628 nm处吸光度随受照剂量呈高度线性变化趋势,未发现多次照射对剂量计响应线性存在影响,这提示该剂量计对于多靶点放疗(如多发脑转移)所形成的累积剂量分布验证问题具有剂量响应不受剂量交付分割效应的积分测量优势。
本研究未探讨该新型片状Presage剂量计的射线能量与剂量率依赖性问题,这是本研究的局限性之一,文献普遍报道传统Presage的射线能量与剂量率依赖性可忽略,后续可对其开展验证性研究。此外,本研究旨在介绍该新型剂量计的读取方法并探讨其关键剂量响应特性,关于该剂量计的读取手法、测量精度与临床应用方法等方面尚存在诸多技术细节有待进一步研究。
利益冲突 研究所使用片状Presage剂量计样品,为美国Heuris公司提供的试用产品,但本文作者及所述单位与Heuris公司并无商业往来
作者贡献声明 杜乙负责实验设计、数据统计与论文撰写;王若曦与岳海振负责实验方案设计、数据分析与结果讨论;周舜与胡俏俏负责实验实施与数据整理;冯仲苏与吴昊负责结果讨论并指导修改论文
| [1] |
Miften M, Olch A J, Mihailidis D, et al. Tolerance limits and methodologies for IMRT measurement-based verification QA:Recommendations of AAPM Task Group No. 218[J]. Med Phys, 2018, 45(4): E53-E83. DOI:10.1002/mp.12810 |
| [2] |
张喜乐, 杨瑞杰, 李君, 等. 立体定向调强放射治疗剂量验证结果分析[J]. 中华放射医学与防护杂志, 2019, 39(9): 680-685. Zhang XL, Yang RJ, Li J, et al. Analysis of dosimetric verification results of stereotactic body radiotherapy[J]. Chin J Radiol Med Prot, 2019, 39(9): 680-685. DOI:10.3760/cma.j.issn.0254-5098.2019.09.008 |
| [3] |
Moran JM, Molineu A, Kruse JJ, et al. Executive summary of AAPM Report Task Group 113:Guidance for the physics aspects of clinical trials[J]. J Appl Clin Med Phys, 2018, 19(5): 335-346. DOI:10.1002/acm2.12384 |
| [4] |
Weber DC, Tomsej M, Melidis C, et al. QA makes a clinical trial stronger:evidence-based medicine in radiation therapy[J]. Radiother Oncol, 2012, 105(1): 4-8. DOI:10.1016/j.radonc.2012.08.008 |
| [5] |
Low DA, Moran JM, Dempsey JF, et al. Dosimetry tools and techniques for IMRT[J]. Med Phys, 2011, 38(3): 1313-1338. DOI:10.1118/1.3514120 |
| [6] |
Nelms BE, Chan MF, Jarry G, et al. Evaluating IMRT and VMAT dose accuracy:practical examples of failure to detect systematic errors when applying a commonly used metric and action levels[J]. Med Phys, 2013, 40(11): 111722. DOI:10.1118/1.4826166 |
| [7] |
杨瑞杰, 张喜乐, 刘路, 等. 2010例调强放疗患者计划剂量验证结果分析[J]. 中华放射医学与防护杂志, 2016, 36(12): 917-921. Yang RJ, Zhang XL, Liu L, et al. Analysis of 2010 patient-specific intensity-modulated radiation therapy dosimetric verification results[J]. Chin J Radiol Med Prot, 2016, 36(12): 917-921. DOI:10.3760/cma.j.issn.0254-5098.2016.12.008 |
| [8] |
Baldock C, De Deene Y, Doran SJ, et al. Polymer gel dosimetry[J]. Phys Med Biol, 2010, 55(5): R1-63. DOI:10.1088/0031-9155/55/5/R01 |
| [9] |
杜乙, 王若曦, 岳海振, 等. 用于精确放疗三维剂量验证的胶体剂量计研究进展[J]. 中华放射医学与防护杂志, 2019, 39(7): 544-548. Du Y, Wang RX, Yue HZ, et al. State of the art of gel dosimeters for three-dimensional radiotherapy dose verification[J]. Chin J Radiol Med Prot, 2019, 39(7): 544-548. DOI:10.3760/cma.j.issn.0254-5098.2019.07.012 |
| [10] |
Oldham M, Thomas A, O'Daniel J, et al. A quality assurance method that utilizes 3D dosimetry and facilitates clinical interpretation[J]. Int J Radiat Oncol Biol Phys, 2012, 84(2): 540-546. DOI:10.1016/j.ijrobp.2011.12.015 |
| [11] |
Juang T, Grant R, Adamovics J, et al. On the feasibility of comprehensive high-resolution 3D remote dosimetry[J]. Med Phys, 2014, 41(7): 071706. DOI:10.1118/1.4884018 |
| [12] |
Doran S, Gorjiara T, Kacperek A, et al. Issues involved in the quantitative 3D imaging of proton doses using optical CT and chemical dosimeters[J]. Phys Med Biol, 2015, 60(2): 709-726. DOI:10.1088/0031-9155/60/2/709 |
| [13] |
Na YH, Wang YF, Black P J, et al. Dosimetric and geometric characteristics of a small animal image-guided irradiator using 3D dosimetry/optical CT scanner[J]. Med Phys, 2018, 45(7): 3330-3339. DOI:10.1002/mp.12955 |
| [14] |
Roed Y, Lee H J, Kadbi M, et al. 3D gel dosimeters offer the potential for real-time quality assurance in MR-IGRT[J]. Int J Radiat Oncol Biol Phys, 2017, 99(2): E716. DOI:10.1016/j.ijrobp.2017.06.2326 |
| [15] |
Lee H J, Kadbi M, Bosco G, et al. Real-time volumetric relative dosimetry for magnetic resonance-image-guided radiation therapy (MR-IGRT)[J]. Phys Med Biol, 2018, 63(4): 045021. DOI:10.1088/1361-6560/aaac22 |
| [16] |
Ibbott GS, Le H J, Roe Y. The MD Anderson experience with 3D dosimetry and an MR-linac[J]. J Phys Conf Ser, 2019, 1305: 012011. DOI:10.1088/1742-6596/1305/1/012011 |
| [17] |
Costa F, Doran S J, Hanson I M, et al. Investigating the effect of a magnetic field on dose distributions at phantom-air interfaces using PRESAGE® 3D dosimeter and Monte Carlo simulations[J]. Phys Med Biol, 2018, 63(5): 05N01. DOI:10.1088/1361-6560/aaaca2 |
| [18] |
Adamovics J, Maryanski MJ. Characterisation of PRESAGE:a new 3-D radiochromic solid polymer dosemeter for ionising radiation[J]. Radiat Prot Dosim, 2006, 120(1-4): 107-112. DOI:10.1093/rpd/nci555 |
| [19] |
Adamovics J. Chemical dosimeters[J]. J Phys Conf Ser, 2019, 1305: 012028. DOI:10.1088/1742-6596/1305/1/012028 |
| [20] |
Khezerloo D, Nedaie HA, Takavar A, et al. PRESAGE as a solid 3-D radiation dosimeter:a review article[J]. Rad Phys Chem, 2017, 141: 88-97. DOI:10.1016/j.radphyschem.2017.06.002 |
| [21] |
Juang T, Newton J, Niebanck M, et al. Customising PRESAGE® for diverse applications[J]. J Phys Conf Ser, 2013, 444: 012029. DOI:10.1088/1742-6596/444/1/012029 |
 2020, Vol. 40
2020, Vol. 40


