2. 石家庄市第三医院肾内科 050011;
3. 河北省人民医院肿瘤科, 石家庄 050011
2. Department of Nephrology, Third Hospital of Shijiazhuang, Shijiazhuang 050011, China;
3. Department of Oncology, Hebei Pepople's Hospital, Shijiazhuang 050011, China
食管癌是常见的消化系统恶性肿瘤,在亚洲国家以食管鳞癌为主[1]。手术治疗为可切除食管癌患者的主要治疗手段,但即使根治性切除术后的食管癌患者仍有多数死于肿瘤局部复发和(或)远处转移[2-6]。食管癌根治术后复发患者常采用的挽救性治疗包括放疗、化疗、放化疗和对症治疗,但仍面临着较差的生存预后[7-10]。本研究拟评估食管鳞癌患者根治术后的复发模式并进行复发后生存时间的预后分析,寻找复发后挽救性治疗的最佳方案。
资料与方法1.一般临床资料:回顾性收集河北医科大学第四医院2008年1月至2011年12月食管癌患者病历资料,入组标准为术前未进行新辅助治疗,KPS评分>70;根治性手术切除(R0),病理明确为食管鳞癌,术后病理资料完整;术后定期复查随访明确为局部区域复发同时不伴有远处转移;确诊复发时间距离手术时间≥1个月;接受两次放疗间隔时间≥1年;合并其他恶性肿瘤、围手术期死亡及非R0手术者均排除在外。经本院伦理委员会批准同意,最终共382例患者符合入组标准。患者中位年龄59岁(37~80岁),临床资料见表 1。入组患者共摘除淋巴结3 797枚,其中阳性443枚,转移度为11.7%,有淋巴结转移者344例,转移率为49.7%。术后复发前接受治疗:术后预防性放疗37例(Ⅰ期2例、Ⅱ期12例、Ⅲ期23例),术后预防性化疗175例(Ⅰ期35例、Ⅱ期59例、Ⅲ期81例),术后预防性放化疗20例(Ⅰ期0例、Ⅱ期5例、Ⅲ期15例),未接受治疗150例(Ⅰ期36例、Ⅱ期58例、Ⅲ期56例)。其中预防性放疗中位剂量50 Gy(45~54 Gy),化疗方案为以铂类为基础的两药联合方案,化疗周期中位数为4个周期(2~6个周期)。
|
|
表 1 382例食管癌术后复发患者临床资料及复发后生存时间的单因素分析 Table 1 The clincal characteristics and univariate analysis of post-recurrence survival in 382 patients with esophageal carcinoma |
2.复发诊断及复发模式:根据手术记录及术后定期复查影像、病理资料进行复发诊断。具体标准如下:穿刺病理明确淋巴结转移;CT示淋巴结短径≥10 mm或食管旁、气管食管旁沟、心膈角、腹腔淋巴结长径≥5 mm或淋巴结中央区坏死;CT示3个或以上淋巴结聚集或融合或淋巴结和结外组织边界不清;PET-CT示病变部位SUV值>2.5。根据美国癌症联合会/国际抗癌联盟(AJCC/UICC)第8版食管癌分期标准[11]中淋巴结区域划分定义复发模式:锁骨上淋巴结区(1区)转移;纵隔淋巴结区(2、4~10、15区)转移;上腹淋巴结区(16~20区)转移;吻合口复发。
3.复发后挽救性治疗:挽救性治疗包括挽救性放疗、挽救性化疗、挽救性放化疗及支持治疗。放疗方案:均采取累积野放疗,肿瘤靶区(GTV)包括吻合口复发病变或转移淋巴结,临床靶区(CTV)为GTV上下及轴向外扩0.6~1.0 cm,计划靶区(PTV)为CTV外扩0.5~0.8 cm。PTV接受处方剂量中位值60 Gy(40~73 Gy),1.8~2.0 Gy/次,1次/d,5次/周。双肺V5≤55%、V20≤30%、V30≤20%,脊髓最大剂量(Dmax)<45 Gy,心脏平均剂量(Dmean)<30 Gy、V30<40%、V40<30%,胸腔胃V35<40%。若患者先后接受预防性放疗及挽救性放疗,则正常组织受量限量为:双肺V20<25%、V30<15%;心脏受量V30<25%、V40<15%。根据首程放疗时脊髓接受最大剂量来决定挽救性放疗时脊髓受量,首程放疗后1年复发:脊髓最大剂量(Dmax)<15 Gy;首程放疗后2~3年复发:脊髓最大剂量(Dmax)<25 Gy;首程放疗后4~5年复发:脊髓最大剂量(Dmax)<35 Gy;首程放疗后5年以上复发:脊髓最大剂量(Dmax)<40 Gy。化疗方案:以铂类为基础的两药联合方案,化疗周期中位数为4周期(2~6周期)。复发后支持治疗包括营养支持、止疼和抗感染治疗,主要目的为改善生活质量。
4.随访:患者术后或者末次辅助治疗后,每3个月复查1次,2年后每6个月复查1次。复查项目主要包括颈部超声、胸腹部强化CT及食管造影,必要时行全身骨扫描和PET-CT检查。随访以电话随访及门诊复查为主。本研究共失访8例,失访率为2.1%。
5.统计学处理:运用统计软件SPSS 13.0进行统计分析。Kaplan-Meier法对复发后生存时间行单因素分析,采用Log-rank检验,多因素生存分析采用Cox回归模型。P<0.05为差异有统计学意义。
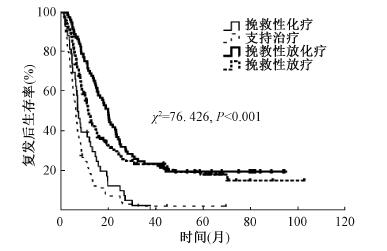
结果1.生存状况:随访日期截止至2017年1月,全组382例患者1、3、5年生存率为80.9%、35.6%、20.4%,中位生存时间29.2个月。患者从接受手术治疗至诊断复发的中位复发时间15.0个月(1.0~85.2个月)。患者1、3、5年复发后生存率为37.7%、14.6%、11.9%,从诊断复发到死亡的中位复发后生存时间10.2个月。依据挽救性治疗方式将入组患者分为挽救性放疗组(156例)、挽救性化疗组(43例)、挽救性放化疗组(82例)及支持治疗组(101例),各组患者的1、3、5年复发后生存率依次为42.3%、23.2%、18.1%;29.8%、0、0;64.3%、23.5%、19.7%;12.3%、2.1%、2.1%,对4组患者行生存分析,差异有统计学意义(χ2=76.426,P<0.001),组间两两比较,可见挽救性放疗组与挽救性化疗组、支持治疗组患者间生存分析可见差异有统计学意义(χ2=12.073、41.427,P<0.001);挽救性放化疗组与挽救性化疗组、支持治疗组患者间生存时间差异有统计学意义(χ2=27.767、58.464,P<0.001);余各组间两两比较差异均无统计学意义(P>0.05),见图 1。
|
图 1 382例食管癌术后复发患者不同挽救性治疗方式的生存时间曲线 Figure 1 The overall SurVlval rate after recurrence of 382. patients with esophageal carcinoma according to salvage therapy |
2.复发类型:全组382例患者锁骨上淋巴结区转移者46例,吻合口复发者26例,纵隔淋巴结区转移者193例,上腹部淋巴结区转移者43例,锁骨上淋巴结区转移合并吻合口复发者5例,锁骨上合并纵隔淋巴结区转移者36例,锁骨上合并上腹部淋巴结区转移者3例,吻合口复发合并纵隔淋巴结区转移者13例,纵隔合并上腹部淋巴结区转移者12例,锁骨上同时合并吻合口复发和纵隔淋巴结区转移者2例,锁骨上同时合并纵隔及上腹部淋巴结区转移者3例。只有1个区域复发者307例,2个区域复发者70例,3个区域复发者5例。单纯横膈以上区域复发者320例,伴有上腹部淋巴结区域复发者62例。全组382例患者共观察到复发部位462个,其中锁骨上淋巴结区转移95个(20.5%),吻合口复发46个(10.0%),纵隔淋巴结区转移259个(56.1%),上腹部淋巴结区转移62个(13.4%)。
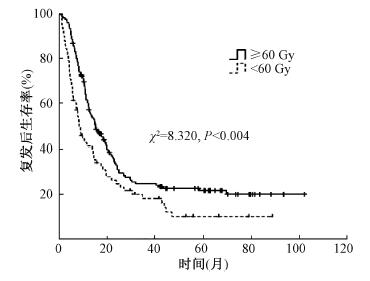
3.复发后生存时间预后分析:单因素预后分析显示,T分期、N分期、TNM分期、复发区域个数、复发部位、挽救性治疗方式均与复发后生存时间显著相关(χ2=5.336、4.292、8.067、7.482、4.093、76.426,P<0.05),见表 1。复发后接受挽救性放疗及放化疗的患者共238例,按照放疗方式分为三维适形组158例和调强组80例,两组患者的中位复发后生存时间分别为13.1和15.9个月,两组间复发后生存时间差异无统计学意义(P>0.05)。按挽救性放疗中位剂量60 Gy, 将患者分为<60 Gy组(73例)和≥60 Gy组(165例),两组患者的中位复发后生存时间分别为8.9和15.5个月,差异有统计学意义(χ2=8.320,P < 0.05),且放疗剂量≥60 Gy组患者的复发后生存预后较优,见图 2。
|
图 2 食管癌术后复发患者不同挽救性放疗剂量的生存时间曲线 Figure 2 The overall survival of recurrent ESCC patients according to the dose of radiation |
将单因素分析有统计学意义的因素纳入Cox回归模型行多因素预后分析显示复发区域个数、挽救性治疗方式为复发后生存时间的独立相关因素,见表 2。
|
|
表 2 382例食管癌术后复发患者复发后生存时间的多因素分析 Table 2 Multivariate analysis of post-recurrence survival in 382 ESCC patients |
讨论
根治性切除是食管癌患者的主要治疗手段,但根治术后的复发率仍然较高。研究显示对于可切除的食管癌患者,其根治术后的复发率可达30.3%~58.0%[2-5, 12],而对于根治术后复发的患者也缺乏统一的治疗方案。因此,研究食管癌患者根治术后的复发模式及复发后挽救性治疗的有效性对临床治疗意义重大。
既往研究发现,食管癌根治术后纵隔及锁骨上淋巴结转移为常见的复发模式。Ni等[10]入组193例接受根治性手术且术后局部复发的食管癌患者,统计发现单纯锁骨上及纵隔淋巴结转移发生率分别为16.6%和46.6%,而上腹部淋巴结转移发生率仅为8.8%。沈文斌等[12]分析了1 191例接受根治性切除术后的胸段食管鳞癌患者的失败模式,在复发患者中单纯出现锁骨上及纵隔淋巴结转移的发生率最高。Chen等[13]通过观察83例接受根治手术且术后局部复发的食管鳞癌患者,同样发现纵隔及锁骨上淋巴结转移最为常见。本研究得到相似的结果,单纯锁骨上淋巴结、纵隔淋巴结、上腹部淋巴结转移及吻合口复发患者的发生率分别为12.0%(46/382)、50.5%(193/382)、11.3%(43/382)和6.8%(26/382)。考虑其原因可能为既往经典食管癌切除手术Sweet术式为左胸后外侧入路,这种术式上纵隔暴露不佳,导致血管丰富、淋巴结清扫难度较大的上纵隔更加不易彻底清扫,故纵隔淋巴结复发率较高。而上纵隔淋巴结清扫不彻底也会导致其下一站引流区锁骨上区的淋巴结转移率增加。临床对于食管癌根治性切除术后行预防性放疗的临床靶区(CTV)勾画建议也是基于以上复发模式及其原因提出的。
接受根治性切除术的食管癌患者复发后的生存预后较差,而复发后治疗方式的推荐尚无高级别临床数据的支持。临床上也无统一的治疗方案,目前常用的复发后挽救性治疗包括挽救性放疗、化疗、放化疗及支持治疗。本研究结果显示382例入组患者的1、3、5年复发后生存率分别为37.7%、14.6%、11.9%,中位复发后生存时间10.2个月。其复发后生存率较低,考虑可能存在以下两方面原因:首先在入组患者分期构成比方面,本研究中的早期患者所占比例较小;其次在复发后挽救性治疗方面,本研究中接受挽救性放疗+放化疗占总人数的比例较小。食管癌根治术后复发后最佳的挽救性治疗方案仍存在争议。既往有研究认为,对于食管癌术后复发患者,接受挽救性放化疗较单纯挽救性放疗患者拥有更好的生存预后,中位生存时间分别为17.0和9.0个月[14]。而李博等[15]报道显示挽救性放疗生存预后优于挽救性放化疗,有放疗参与治疗的患者生存预后明显优于单纯化疗的患者(14.6 vs. 11.4个月,P=0.017)。本研究显示挽救性治疗为影响患者复发后生存预后的独立影响因素。接受挽救性放疗和挽救性放化疗患者间的生存预后差异无统计学意义,但均优于接受挽救性化疗和支持治疗的患者。分析其原因可能与各研究入组患者的分期组成不同相关,早期患者一般可以更好地耐受放疗同期化疗。化疗可以杀死机体内的亚临床病灶,同时起到放疗增敏作用,但也不可避免地带来了相应的不良反应。如果放化疗前不加以仔细评估,可能化疗带来的增益低于其伴随的不良反应,进而转化为生存获益降低,甚至生存反而变差。因此,对于不能接受挽救性放化疗的术后复发患者,单纯挽救性放疗仍然为很好的治疗选择。
对于食管癌术后复发后再治疗的放疗剂量,李博等[15]对放疗剂量为50和60 Gy分别进行分组研究,分析发现两种分组的生存情况均未见统计学差异。而Ni等[10]的研究结果显示,放疗剂量≥60 Gy组患者的复发后生存时间明显优于<60 Gy组的患者(P=0.026)。本研究得到了相似的结果,因此,认为对于食管癌术后复发的患者接受挽救性放疗剂量≥60 Gy为合理有效的剂量。
本研究显示除了临床常见的T分期、N分期及TNM分期为预后影响因素外,复发区域个数、复发部位均可影响预后,且复发区域数为独立影响因素。研究显示复发部位中伴有上腹部淋巴结转移患者生存预后差(P=0.043)。考虑其原因为伴有上腹部淋巴结转移的62例患者中包含了19例上腹同时合并其他部位淋巴结转移的患者,肿瘤负荷较大;另外上腹部因危及器官较多(小肠、残胃)而导致放疗剂量不足,同时上腹部淋巴结转移常伴发更多的血行转移。复发区域多的患者拥有更差的生存预后,本研究同样显示复发区域较多的患者生存预后更差,复发区域为1个和≥2个的患者复发后中位生存时间分别为10.9和6.9个月(P=0.006)。考虑其原因可能为复发区域多常常意味着肿瘤负荷大、病变区域广及患者一般状况差,影响患者挽救性治疗的选择及实施,进而影响生存预后。
综上,纵隔及锁骨上淋巴结转移是食管癌根治术后最常见的区域复发类型,挽救性放疗或放化疗且放疗剂量≥60 Gy可以更好地改善复发患者的生存预后。
利益冲突 无
作者贡献声明 宋春洋负责整理数据、统计分析及论文撰写;祝淑钗负责研究设计和论文修改;苏景伟、李娟、沈文斌协助修改论文;高丝娜、赵彦负责统计分析;许金蕊、李曙光、李巧芳负责收集整理病例资料
| [1] |
Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015, 65(2): 87-108. DOI:10.3322/caac.21262 |
| [2] |
Lu J, Tao H, Song D, et al. Recurrence risk model for esophageal cancer after radical surgery[J]. Chin J Cancer Res, 2013, 25(5): 549-555. DOI:10.3978/j.issn.1000-9604.2013.10.05 |
| [3] |
Oppedijk V, van der Gaast A, van Lanschot JJ, et al. Patterns of recurrence after surgery alone versus preoperative chemoradiotherapy and surgery in the CROSS trials[J]. J Clin Oncol, 2014, 32(5): 385-391. DOI:10.1200/JCO.2013.51.2186 |
| [4] |
Liu Q, Cai XW, Wu B, et al. Patterns of failure after radical surgery among patients with thoracic esophageal squamous cell carcinoma:implications for the clinical target volume design of postoperative radiotherapy[J]. PLoS One, 2014, 9(5): e97225. DOI:10.1371/journal.pone.0097225 |
| [5] |
Guo XF, Mao T, Gu ZT, et al. Clinical study on postoperative recurrence in patients with pN0 esophageal squamous cell carcinoma[J]. J Cardiothorac Surg, 2014, 9(1): 150-164. DOI:10.1186/s13019-014-0150-4 |
| [6] |
Shen WB, Gao HM, Zhu SC, et al. Analysis of the causes of failure after radical surgery in patients with PT3N0M0 thoracic esophageal squamous cell carcinoma and consideration of postoperative radiotherapy[J]. World J Surg Oncol, 2017, 15(1): 192-198. DOI:10.1186/s12957-017-1259-4 |
| [7] |
Su XD, Zhang DK, Zhang X, et al. Prognostic factors in patents with recurrence after complete resection of esophageal squamous cell carcinoma[J]. J Thorac Dis, 2014, 6(7): 949-957. DOI:10.3978/j.issn.2072-1439.2014.07.14 |
| [8] |
Yamashita K, Watanabe M, Mine S, et al. Patterns and outcomes of recurrent esophageal cancer after curative esophagectomy[J]. World J Surg, 2017, 41(9): 2337-2344. DOI:10.1007/s00268-017-4024-5 |
| [9] |
Ghaly G, Harrison S, Kamel MK, et al. Predictors of survival after treatment of oligometastases after esophagectomy[J]. Ann Thorac Surg, 2018, 105(2): 357-362. DOI:10.1016/j.athoracsur.2017.10.039 |
| [10] |
Ni WJ, Yang JS, Deng W, et al. Patterns of recurrence after surgery and efficacy of salvage therapy after recurrence in patients with thoracic esophageal squamous cell carcinoma[J]. BMC Cancer, 2020, 20(1): 144-152. DOI:10.1186/s12885-020-6622-0 |
| [11] |
Rice TW, Ishwaran H, Ferguson MK, et al. Cancer of the esophagus and esophagogastric junction:an eighth edition staging primer[J]. J Thorac Oncol, 2017, 12(1): 36-42. DOI:10.1016/j.jtho.2016.10.016 |
| [12] |
沈文斌, 高红梅, 祝淑钗, 等. T1~4N0~1M0期胸段食管鳞癌根治性切除术后失败模式对术后辅助治疗的意义[J]. 中华放射医学与防护杂志, 2018, 38(4): 265-272. Shen WB, Gao HM, Zhu SC, et al. Failure patterns of radical surgery in patients with T1~4 N0~1 M0 thoracic esophageal squamous cell carcinoma:implications for the target area design of postoperative therapy[J]. Chin J Radiol Med Prot, 2018, 38(4): 265-272. DOI:10.3760/cma.j.issn.0254-5098.2018.04.005 |
| [13] |
Chen J, Yin WM, Yao H, et al. Salvage treatment for lymph node recurrence after radical resection of esophageal squamous cell carcinoma[J]. Radiat Oncol, 2019, 14(1): 169-176. DOI:10.1186/s13014-019-1377-y |
| [14] |
Lu JC, Kong C, Tao H, et al. Radiotherapy with or without concurrent chemotherapy for lymph node recurrence after radical surgery of thoracic esophageal squamous cell carcinoma[J]. Int J Radiat Oncol Biol Phys, 2010, 78(3): 710-714. DOI:10.1016/j.ijrobp.2009.08.065 |
| [15] |
李博, 章文成, 赵路军, 等. 食管癌根治术后复发的治疗策略[J]. 中国肿瘤临床, 2013, 40(24): 1553-1557. Li B, Zhang WC, Zhao LJ, et al. Therapeutic strategy to prevent the recurrence of esophageal carcinoma after radical resection[J]. Chin J Clin Oncol, 2013, 40(24): 1553-1557. DOI:10.3969/j.issn.1000-9179.issn.1000-9179 |
 2020, Vol. 40
2020, Vol. 40


