2. 山东省肿瘤防治研究院 山东省肿瘤医院 山东第一医科大学 山东省医学科学院放疗科, 济南 250117
2. Department of Radiation Oncology, Shandong Cancer Hospital and Institute, Shandong First Medical University and Shandong Academy of Medical Sciences, Jinan 250117, China
食管癌是我国常见的恶性肿瘤之一,目前放疗仍是局部晚期食管癌的主要治疗手段,无论是可手术局部晚期术前新辅助放化疗,还是不可手术局部晚期的根治性放化疗,放疗都是重要的组成部分[1-2]。放射性肺炎(radiation pneumonitis, RP)是食管癌放疗的主要不良反应[3],文献报道≥2级RP的发生率为6%~25%[4-5], 尽管临床特征类似、放射剂量相同者发生RP的风险也不相同[6],但剂量学参数及临床特征仍是RP预测时常用到的[7]。此外,提升放疗技术不仅可以提高肿瘤控制率,而且能够降低肺等正常组织的受照剂量[8-9],肺受照剂量的降低会为RP的降低奠定基础。目前用于胸部肿瘤放疗的照射技术主要有三维适形放疗(three dimensional conformal radiother\|apy, 3D-CRT)、调强放疗(intensity-modulated radiotherapy, IMRT)和螺旋调强放疗(tomother\|apy, TOMO),既往报道多数关于不同放疗技术条件下肺癌RP发生率差异分析,然而食管癌放疗后RP的研究相对较少。因此,本研究回顾性综合分析临床特征、不同照射技术及剂量体积参数等因素对胸段食管癌放疗后RP的影响,为食管癌放疗方案的制定提供参考。
资料与方法1.病例资料:回顾性选取山东省肿瘤防治研究院山东省肿瘤医院山东第一医科大学山东省医学科学院2014年6月至2019年6月经内镜病理确诊的放化疗联合治疗或单纯放疗胸段食管癌患者共247例。入组标准包括:既往无胸部放疗史;KPS≥70;完成计划的照射剂量(处方剂量≥50 Gy);有完整的物理学参数;有完整的随访资料,连续随访时间≥6个月。排除标准包括:放疗中合并普通的肺部感染;放疗期间,放射治疗中断>7 d;中途失访。入组患者中,男195例(78.9%),女52例(21.1%),中位年龄64岁(41~87岁);病理特征:鳞癌237例(96.0%),腺癌6例(2.4%),小细胞癌4例(1.6%);临床分期:Ⅱ期34例(13.8%),Ⅲ期130例(52.6%),Ⅳ期83例(33.6%);放疗技术:3D-CRT 21例(8.5%)IMRT 161例(65.2%)TOMO 65例(26.3%)。本研究得到了山东省肿瘤医院伦理委员会的认可。入组患者基线特征见表 1。
|
|
表 1 不同等级放射性肺炎一般变量的单因素分析 Table 1 Univariate analysis of general variables in different grades of RP |
2.放射治疗:靶区勾画基于模拟定位增强CT扫描图像,并参照诊断性检查结果,如超声内镜及PET-CT。肉眼靶区(GTV)为影像学可见的食管原发肿瘤及转移淋巴结,临床靶区(CTV)为食管原发肿瘤上下外扩3 cm、左右前后外扩0.6~0.8 cm及相关淋巴引流区,计划靶区(PTV)为CTV外扩5~8 mm。对于临床T分期较早、预估食管出血、穿孔风险较低患者,则采用GTV同步加量技术,即GTV外扩5 mm形成PGTV。对于年龄偏大、临床T分期较晚,出血、穿孔高风险患者,采用常规分割照射后,GTV序贯加量的照射方式。勾画双肺、心脏、脊髓等周围重要危及器官。采用6 MV X射线,95%的PTV处方剂量50~66 Gy (中位剂量60 Gy),1.8~2.0 Gy/d,5次/周。正常组织限量:双肺V20≤28%,平均肺剂量(MLD)≤18 Gy;脊髓最大受照剂量≤45 Gy;心脏V30≤40%,V40≤30%。
3.化疗方案:包括TP(紫杉类+铂类)、PF(氟尿嘧啶类+铂类)、EP(依托泊苷+铂类)及其他方案,其中,无化疗42例(17.0%),单纯诱导化疗97例(39.3%),诱导加同步放化疗21例(8.5%),单纯同步放化疗62例(25.1%),放疗后巩固化疗25例(10.1%)。
4. RP的诊断与分级标准:采用美国国家癌症研究所不良反应标准CTCAE 4.0版,0级:无明显变化;1级:无明显呼吸道症状,有影像学表现;2级:持续咳嗽、胸闷、喘憋,需用麻醉性镇咳药止咳,但未影响日常生活;3级:严重咳嗽,麻醉性镇咳药止咳无效,严重影响正常生活;4级:呼吸功能不全,需辅助通气维持生命体征,危及生命;5级:严重放射性肺炎,导致患者死亡。
5.随访:采用返院复查的方式,随访项目为胸部CT、患者一般情况、临床症状、体征,复查时间为放疗结束后1月内复查,以后每3个月随访1次,至少随访至放疗结束后半年。RP诊断和分级经2名高年资(专业年限≥5年)肿瘤放射治疗医师及1名影像科医师确认。
6.统计学处理:统计分析采用SPSS 17.0软件,计量资料经正态性检验以x±s形式表示,组间比较经方差齐性检验采用方差分析或非参数检验。计数资料组间比较采用χ2检验。logistic回归分析用于独立危险因素分析,受试者工作特征曲线(ROC)评价相应级别RP危险因素的诊断价值。P < 0.05为差异有统计学意义。
结果1.全组及不同照射技术组RP发生率:全组患者中位随访时间11个月,共观察到118例(47.8%)RP病例,其中1级RP 64例(25.9%)、2级RP 37例(15.0%)、3级RP 12例(4.9%)、4级RP 5例(0.2%)、5级0例(0.0%)。3D-CRT、IMRT和TOMO 3种照射技术之间≥1级(47.6% vs. 50.3% vs. 41.5%)、≥2级(33.3% vs. 22.4% vs. 16.9%)、≥3级(9.5% vs.7.5% vs.4.6%),RP发生率差异无统计学意义(P>0.05),见表 1。
2.全组肺剂量体积参数与RP的关联:双肺V5~V40、MLD均与≥1级RP(Z=-5.802~-4.306,P<0.05)和≥2级、≥3级RP(F=0.057~11.616、0.087~3.392,P<0.05)发生有关;GTV体积、PTV体积、GTV/肺体积(%)、PTV/肺体积(%)均与≥1级RP(Z=-3.377~-2.041,P<0.05)和≥2级RP(F=3.600~9.801,P<0.05)发生有关,而肺体积大小与≥1级RP、≥2级RP、≥3级RP发生无关,见表 2。多因素分析显示,双肺V5、V40为≥1级RP的独立危险因素(Wald=3.427、4.250,P<0.05);双肺MLD、双肺V5分别为≥2级和≥3级RP的独立危险因素(Wald=2.832、6.013,P<0.05),见表 3。
|
|
表 2 247例不同等级放射性肺炎患者的剂量体积参数分析(x±s) Table 2 Analysis of dose-volume parameters of RP patients with different grades(x±s) |
|
|
表 3 247例不同等级放射性肺炎的多因素分析 Table 3 Multivariate analysis of different grades of radiation pneumonitis |
3.临床特征及化疗方式与RP的关联:单因素分析显示,非吸烟者与吸烟者比较,≥1级、≥2级RP发生率差异无统计学意义(P>0.05),但吸烟指数>400者,其≥3级RP明显增加(χ2=13.295,P<0.05)。COPD与≥1级RP者明显相关(χ2=9.146,P<0.05)。化疗有无、化疗方案、放化疗结合方式及放疗剂量均与RP无显著相关;患者的性别、年龄、食管癌分期、位置与RP也无显著相关,见表 1。多因素分析显示,吸烟指数>400为≥3级RP的独立危险因素(Wald=5.964,P<0.05),COPD为≥1级RP的独立危险因素(Wald=6.110,P<0.05),见表 3。
4.预测RP的肺剂量学参数临界值及其预测效能:受试者工作特征曲线(ROC)显示,V5、V40是≥1级RP的最佳预测指标,曲线下面积(AUC)分别为0.714和0.688(95% CI 0.649~0.788、0.622~0.754,P<0.05),最佳临界值分别为55.74%和4.13%;MLD是≥2级RP的最佳预测指标AUC为0.773(95% CI 0.703~0.844,P<0.05),最佳临界值为11.91 Gy,V5是≥3级RP的最佳预测指标AUC为0.749(95% CI 0.648~0.850,P<0.05),最佳临界值为57.60%。见图 1。
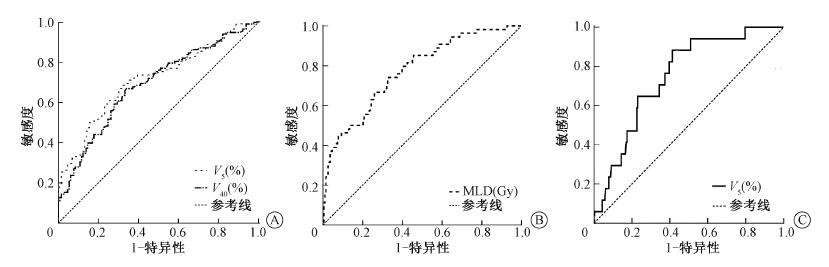
|
注:Vx.剂量x Gy的体积比率;MLD.平均肺剂量 图 1 预测相应等级的放射性肺炎(RP)的受试者工作特征曲线(ROC)曲线A.RP≥1级; B.RP≥2级; C.RP≥3级 Figure 1 Prediction of ROC curve of the corresponding grade of RP A.RP≥grade 1; B. RP≥grade 2; C. RP≥grade 3 |
讨论
RP的发生不是单一因素作用的结果,而是受多种因素的影响,在众多因素中肺剂量体积参数仍是RP预测的重要指标。放疗技术的提高带来了肺剂量体积参数的变化,而这种变化与RP发生相关。目前研究认为低剂量参数如V5、V10是RP最重要的相关因素[10-11],而Jin等[12]研究认为低剂量参数V13同样可作为RP的预测因子,V13<40%可降低RP发生率。此外,MLD也是胸部放疗时关注的参数之一,多项研究显示MLD是≥2级RP的重要预测指标[13-15]。而Cunliffe等[16]分析了食管癌患者接受IMRT和质子放疗后发现高剂量参数V20与RP的发生显著相关。本研究中,单因素分析发现V5~V40、MLD均与各级RP的发生相关,多因素结果表明V5分别为≥1级RP和≥3级RP独立危险因素,而MLD为≥2级RP独立危险因素。然而传统的预测参数V20并没有体现出实际的预测效能,考虑原因为入组患者中1/4患者采用了TOMO技术,有效降低高剂量区肺体积;此外,可能是在制定实际物理计划时,对V20限制较为严格。
目前食管癌主流的放疗技术为影像引导的精确放疗,实现方式包括3D-CRT和IMRT。技术的进步提高了肿瘤局部控制率,并未增加放疗的不良反应[17]。美国MD Anderson肿瘤中心分析显示,IMRT可显著减少V20,同时伴随V5的增加,但随着V20的下降,RP发生概率并未发生改变[18]。TOMO作为先进的IMRT技术,目前已应用于肺癌、食管癌、乳腺癌等胸部肿瘤的放疗,特别是肺癌的TOMO治疗已有较多的报道,部分研究认为TOMO用于肺癌的治疗是安全的[19-20], 而关于食管癌TOMO放疗后RP发生情况的报道甚少。本研究发现,食管癌接受IMRT和TOMO放疗后≥2级PR发生率分别为22.4%和16.9%。然而,无论≥1级RP,还是≥2级、≥3级RP的发生率均与3种照射技术无关。
食管癌放疗患者RP的发生并不仅仅与剂量体积参数相关联,应结合患者临床特征及治疗因素综合评估。既往研究证实了RP与多种因素有关,如吸烟状况、慢性肺部疾病、化疗等[21],关于吸烟和RP之间的关系也是存在争议的,Laucis等[22]认为吸烟不会增加放疗相关的肺毒性反应。Jin等[23]和一项Meta分析[24]发现吸烟对于RP具有保护的作用。本研究引入吸烟指数的概念, 对吸烟程度分层研究, 发现非吸烟患者与不同程度吸烟患者在1级和2级RP发生率方面无明显相关性, 但吸烟指数>400的患者,其≥3级RP明显增加,分析原因可能与重度吸烟导致肺功能明显下降后并发COPD有关,正如Zhang等[25]的研究,对于吸烟患者合并严重慢性肺病,吸烟成为了RP的不利因素,可见吸烟的严重程度是重度RP的重要影响因素。以往少数基于胸部立体定向放疗(SBRT)报道表明,COPD和非COPD患者发生RP的风险相当[26-27],而Rancati等[28]认为放疗前合并COPD可导致肺功能下降,使肺部易受射线损伤,致使RP发生率升高。目前合并COPD的食管癌患者RP的报道几乎没有,本研究发现, 虽然合并COPD食管癌患者放疗后发生≥1级RP的概率增加,但在≥2级和≥3级RP患者中,COPD与RP发生无相关性。
放化疗综合治疗是食管癌非手术治疗的主导模式,因此,化疗的加入对食管癌患者RP发生的影响也备受关注,但目前这方面的报道却并不多,从肺癌相关报道中可以看出,化疗对RP影响的研究结果并不一致,如Kishida等[29]报道放疗同步紫杉类化疗药物化疗提高了肺癌患者RP的发生率,但Shaikh等[4]的研究结果则认为放疗同步紫杉类药物化疗对肺癌患者的RP发生率并无影响。本研究中共205例(82.9%)接受了化疗,包括诱导化疗、同步化疗、巩固化疗,研究结果未发现RP与化疗之间的相关性,然而,因不是大样本的研究,这个结果不足以印证化疗不会诱发或加重食管癌放疗患者RP的发生。
本研究作为一项回顾性研究仍存在一定的局限性。入组患者样本数量相对较少,而文中分析影响RP的因素相对较多,可能会对结果造成偏差;随访观察时间相对偏短,对于远期的可能并发放射性肺纤维化患者缺乏相关性分析;放疗技术的选择并不是随机化,而是考虑了患者的靶区体积大小或患者经济等因素,对于结果可能造成影响。
综上所述,在食管癌放射治疗过程中,不同的肺体积剂量参数会对RP的发生产生重要的影响。在实施食管癌放疗时,无论采用哪种放疗技术,双肺V5、V40、MLD等剂量学参数均应重点关注。此外,患者吸烟程度、基础肺功能状态等临床特征也不应忽视。
利益冲突 无
作者贡献声明 杜峰、王强负责分析数据和论文撰写;王玮指导论文的撰写和修改;张英杰、李振祥负责影像诊断及数据处理;李建彬设计实验, 指导论文的撰写和修改
| [1] |
Ajani JA, D'Amico TA, Bentrem DJ, et al. Esophageal and esophagogastric junction cancers, version 2.2019, NCCN clinical practice guidelines in oncology[J]. J Natl Compr Canc Netw, 2019, 17(7): 855-883. DOI:10.6004/jnccn.2019.0033 |
| [2] |
Deng W, Lin SH. Advances in radiotherapy for esophageal cancer[J]. Ann Transl Med, 2018, 6(4): 79. DOI:10.21037/atm.2017.11.28 |
| [3] |
Suh YG, Lee IJ, Koom WS, et al. High-dose versus standard-dose radiotherapy with concurrent chemotherapy in stages II-III esophageal cancer[J]. Jpn J Clin Oncol, 2014, 44(6): 534-540. DOI:10.1093/jjco/hyu047 |
| [4] |
Shaikh T, Churilla TM, Monpara P, et al. Risk of radiation pneumonitis in patients receiving taxane-based trimodality therapy for locally advanced esophageal cancer[J]. Pract Radiat Oncol, 2016, 6(6): 388-394. DOI:10.1016/j.prro.2016.02.004 |
| [5] |
Nomura M, Kodaira T, Furutani K, et al. Predictive factors for radiation pneumonitis in oesophageal cancer patients treated with chemoradiotherapy without prophylactic nodal irradiation[J]. Br J Radiol, 2012, 85(1014): 813-818. DOI:10.1259/bjr/13604628 |
| [6] |
Senan S, Rusthoven CG, Slotman BJ, et al. Progress in radiotherapy for regional and oligometastatic disease in 2017[J]. J Thorac Oncol, 2018, 13(4): 488-496. DOI:10.1016/j.jtho.2018.02.001 |
| [7] |
Wang DQ, Shi J, Liang SH, et al. Dose-volume histogram parameters for predicting radiation pneumonitis using receiver operating characteristic curve[J]. Clin Transl Oncol, 2013, 15(5): 364-369. DOI:10.1007/s12094-012-0931-y |
| [8] |
Tonison JJ, Fischer SG, Viehrig M, et al. Radiation pneumonitis after intensity-modulated radiotherapy for esophageal cancer:institutional data and a systematic review[J]. Sci Rep, 2019, 9(1): 2255. DOI:10.1038/s41598-018-38414-5 |
| [9] |
孔月, 徐裕金, 陈梦圆, 等. 胸段食管癌患者三种放疗计划心脏和肺的剂量学比较[J]. 中华放射医学与防护杂志, 2017, 37(11): 832-837. Kong Y, Xu YJ, Chen MY, et al. Dosimetric comparison of three radiotherapy plans for heart and lung in patients with thoracic esophageal cancer[J]. Chin J Radiol Med Prot, 2017, 37(11): 832-837. DOI:10.3760/cma.j.issn.0254-5098.2017.11.006 |
| [10] |
Chargari C, Riet F, Mazevet M, et al. Complications of thoracic radiotherapy[J]. Presse Med, 2013, 42(9Pt2): e342-351. DOI:10.1016/j.lpm.2013.06.012 |
| [11] |
Luna JM, Chao HH, Diffenderfer ES, et al. Predicting radiation pneumonitis in locally advanced stage II-III non-small cell lung cancer using machine learning[J]. Radiother Oncol, 2019, 133: 106-112. DOI:10.1016/j.radonc.2019.01.003 |
| [12] |
Jin X, Lin B, Chen D, et al. Safety and outcomes of volumetric modulated arc therapy in the treatment of patients with inoperable lung cancer[J]. J Cancer, 2019, 10(13): 2868-2873. DOI:10.7150/jca.31260 |
| [13] |
Dang J, Li G, Zhang S, et al. Risk and predictors for early radiation pneumonitis in patients with stage III non-small cell lung cancer treated with concurrent or sequential chemoradiotherapy[J]. Radiat Oncol, 2014, 9: 172. DOI:10.1186/1748-717X-9-172 |
| [14] |
Katsui K, Ogata T, Watanabe K, et al. Dose-volume parameters predict radiation pneumonitis after induction chemoradiotherapy followed by surgery for non-small cell lung cancer:a retrospective analysis[J]. BMC Cancer, 2019, 19(1): 1144. DOI:10.1186/s12885-019-6359-9 |
| [15] |
Pan WY, Bian C, Zou GL, et al. Combing NLR, V20 and mean lung dose to predict radiation induced lung injury in patients with lung cancer treated with intensity modulated radiation therapy and chemotherapy[J]. Oncotarget, 2017, 8(46): 81387-81393. DOI:10.18632/oncotarget.19032 |
| [16] |
Cunliffe A, Armato SG 3rd, Castillo R, et al. Lung texture in serial thoracic computed tomography scans:correlation of radiomics-based features with radiation therapy dose and radiation pneumonitis development[J]. Int J Radiat Oncol Biol Phys, 2015, 91(5): 1048-1056. DOI:10.1016/j.ijrobp.2014.11.030 |
| [17] |
Haefner MF, Lang K, Verma V, et al. Intensity-modulated versus 3-dimensional conformal radiotherapy in the definitive treatment of esophageal cancer:comparison of outcomes and acute toxicity[J]. Radiat Oncol, 2017, 12(1): 131. DOI:10.1186/s13014-017-0863-3 |
| [18] |
Asakura H, Hashimoto T, Zenda S, et al. Analysis of dose-volume histogram parameters for radiation pneumonitis after definitive concurrent chemoradiotherapy for esophageal cancer[J]. Radiother Oncol, 2010, 95(2): 240-244. DOI:10.1016/j.radonc.2010.02.006 |
| [19] |
Arcangeli S, Agolli L, Portalone L, et al. Patterns of CT lung injury and toxicity after stereotactic radiotherapy delivered with helical tomotherapy in early stage medically inoperable NSCLC[J]. Br J Radiol, 2015, 88(1048): 20140728. DOI:10.1259/bjr.20140728 |
| [20] |
Kim Y, Hong SE, Kong M, et al. Predictive factors for radiation pneumonitis in lung cancer treated with helical tomotherapy[J]. Cancer Res Treat, 2013, 45(4): 295-302. DOI:10.4143/crt.2013.45.4.295 |
| [21] |
Giuliani ME, Lindsay PE, Kwan JY, et al. Correlation of dosimetric and clinical factors with the development of esophagitis and radiation pneumonitis in patients with limited stage small-cell lung carcinoma[J]. Clin Lung Cancer, 2015, 16(3): 216-220. DOI:10.1016/j.cllc.2014.11.008 |
| [22] |
Laucis AM, Sun Y, Schipper M, et al. Active smoking is not associated with increased radiation-induced toxicity in locally advanced lung cancer patients[J]. Int J Radiat Oncol Biol Phys, 2018, 102(3): S231. DOI:10.1016/j.ijrobp.2018.07.166 |
| [23] |
Jin H, Tucker SL, Liu HH, et al. Dose-volume thresholds and smoking status for the risk of treatment-related pneumonitis in inoperable non-small cell lung cancer treated with definitive radiotherapy[J]. Radiother Oncol, 2009, 91(3): 427-432. DOI:10.1016/j.radonc.2008.09.009 |
| [24] |
Vogelius IR, Bentzen SM. A literature-based meta-analysis of clinical risk factors for development of radiation induced pneumonitis[J]. Acta Oncol, 2012, 51(8): 975-983. DOI:10.3109/0284186X.2012.718093 |
| [25] |
Zhang XJ, Sun JG, Sun J, et al. Prediction of radiation pneumonitis in lung cancer patients:a systematic review[J]. J Cancer Res Clin Oncol, 2012, 138(12): 2103-2116. DOI:10.1007/s00432-012-1284-1 |
| [26] |
Takeda A, Kunieda E, Ohashi T, et al. Severe COPD is correlated with mild radiation pneumonitis following stereotactic body radiotherapy[J]. Chest, 2012, 141(4): 858-866. DOI:10.1378/chest.11-1193 |
| [27] |
Yamamoto T, Kadoya N, Sato Y, et al. Prognostic value of radiation pneumonitis after stereotactic body radiotherapy:effect of pulmonary emphysema quantitated using CT images[J]. Clin Lung Cancer, 2018, 19(1): e85-90. DOI:10.1016/j.cllc.2017.05.022 |
| [28] |
Rancati T, Ceresoli GL, Gagliardi G, et al. Factors predicting radiation pneumonitis in lung cancer patients:a retrospective study[J]. Radiother Oncol, 2003, 67(3): 275-283. DOI:10.1016/s0167-8140(03)00119-1 |
| [29] |
Kishida Y, Tsushima T, Endo M, et al. Risk analysis of pneumonitis in taxane therapy after chemoradiotherapy for patients with metastatic or recurrent esophageal cancer[J]. Am J Clin Oncol, 2018, 41(1): 41-45. DOI:10.1097/COC.0000000000000232 |
 2020, Vol. 40
2020, Vol. 40


