放射治疗是食管癌治疗的手段之一,但食管癌放疗5年生存率仅为15%~30%[1],食管癌细胞对辐射的抵抗是影响食管癌放疗疗效的关键因素[2]。已有研究证实,血管内皮生长因子(vascular endothelial growth factor,VEGF)高表达的食管癌患者的死亡风险升高1.82倍[3],目前认为放疗可诱导肿瘤细胞VEGF表达的升高,这是肿瘤细胞为减少辐射所致的血管毒性损伤、增强生存能力的自我保护手段,是导致肿瘤辐射抵抗的原因之一[4-5]。而VEGFA是VEGF家族的成员,主要通过与细胞膜上的VEGFR1和VEGFR2受体的相互作用,具有诱导血管生成、血管生成和内皮细胞生长、促进细胞迁移以及抑制细胞凋亡的功能[6-7]。本研究下调了食管癌ECA-109细胞的VEGFA表达,旨在观察其辐射敏感性的改变并初步探讨其发生机制。
材料与方法1.仪器与试剂:RPMI 1640培养基、青霉素链霉素双抗(美国GIBCO公司);含乙二胺四乙酸(EDTA)的胰酶、胎牛血清(杭州四季青公司),VEGFA、γ-H2AX抗体(美国CST公司)。细胞增殖实验(CCK-8)试剂盒、结晶紫染色液(江苏碧云天公司)、细胞凋亡检测试剂盒Annexin V-FITC细胞凋亡检测试剂盒(美国BD公司);X射线辐照装置(德国西门子Primus-H型医用直线加速器), 吸收剂量率1 Gy/min,源靶距100 cm。
2.细胞系与细胞培养:中国科学院细胞库采购的人食管鳞癌细胞系ECA-109,配制含有10%胎牛血清、1%青霉素、链霉素双抗的RPMI 1640培养基,于5%CO2、37℃的培养箱中培养。细胞贴壁,2 d传代1次,选取指数生长期细胞实验。
3.慢病毒转染将目的基因导入细胞:处于对数生长期的细胞胰酶消化,完全培养基制成(3~5)×104个/ml细胞悬液,接种到12孔板中,继续培养使ECA-109细胞达到培养皿的15%~30%。加入1.25 μ滴度为8×108 TU/ml的病毒进行感染,12 h后更换为常规培养基继续培养。于感染48 h后换用含嘌呤霉素的培养基筛选细胞,细胞存活率即为阳性感染率。
4.荧光定量PCR检测目的基因表达情况:慢病毒转染后收集细胞,采用TRIzol提取细胞RNA。RNA的浓度和纯度使用酶标仪检测,将其反转录为cDNA。随后在实时荧光定量PCR仪上进行目的片段扩增,参照说明书操作。内参基因正向引物:TGACTTCAACAGCGACACCCA,反向引物:CACCCTGTTGCTGTAGCCAAA;目的基因正向引物:CTACTGCCATCCAATCGAGAC, 反向引物:GTGAGGTTTGATCCGCATAAT。
5.CCK-8法检测下调VEGFA对ECA-109增殖能力的影响:将ECA-109细胞分为空载组和VEGFA转染组。取对数生长期的细胞制成细胞悬液,以每孔2 000个接种于96孔细胞培养板中,各组各设6个平行孔,分别于培养箱中孵育0、24、48、72、96和120 h后,每孔加入10 μl CCK-8溶液,继续培养2 h,用酶标仪测定450 nm处的吸光度(A)值。
6.克隆形成实验测定增殖及放射敏感性情况:将ECA-109细胞分为空载组、X射线组(2、4、6和8 Gy)、VEGFA转染组、VEGFA转染组联合X射线组。用胰蛋白酶消化细胞并制成单细胞悬液,分别以每孔400、600、1 000、2 000、4 000个细胞接种于培养皿中,24 h后待细胞贴壁进行X射线照射。照射后更换培养液,继续培养10 d后磷酸盐缓冲液(PBS)漂洗,4%多聚甲醛固定,结晶紫染色,以显微镜下计数50个以上的细胞计算集落形数。独立实验重复3次。
7. Annexin V-FITC和PI双染检测细胞凋亡率:将ECA-109细胞分为空载组、X射线组(4 Gy)、VEGFA转染组,VEGFA转染组联合X射线组。X射线照射后更换培养基继续培养24 h,用胰酶消化细胞,制成细胞密度1×106个/L的悬液,按凋亡检测试剂盒说明书添加试剂,用流式细胞仪检测,Flowjo软件对样品的细胞凋亡率进行计算。独立实验重复3次。
8. Western blot法检测食管癌细胞的VEGFA蛋白表达:提取处理后的各组细胞的蛋白,上样后,转移至聚偏二氟乙烯(PVDF)膜上,使用5%脱脂奶粉,于37℃温箱中封闭1 h,加入一抗,4℃孵育过夜,杂交膜清洗液(TBST)洗膜3次。加入稀释的二抗,室温孵育1 h,TBST洗3遍,在暗室中曝光显影。独立实验重复3次。
9.免疫荧光染色检测食管癌细胞DNA损伤修复情况:将ECA-109细胞分为空载组和VEGFA转染组,取处于对数生长期的2×105个细胞接种于培养皿中,24 h后以X射线(4 Gy)照射。弃去旧培养液后,用4%多聚甲醛4℃固定30 min。然后磷酸盐缓冲液(PBS)洗涤3次,再以体积分数为0.2%Triton-X 100 4℃破膜处理15 min后用PBS洗涤3次。羊血清工作液室温封闭2 h,再用PBS洗涤3次。加入一抗于4℃孵育细胞过夜。然后用PBS洗涤3次,后避光加入二抗,37℃避光孵育细胞1 h。PBS洗涤3次。4, 6-二脒基-2-苯基吲哚(DAPI)染色15 min,于共聚焦显微镜下观察、拍照。
10.统计学处理:用SPSS 22.0软件进行数据分析。经正态性检验数据均符合正态分布,以x±s表示。两组间比较采用独立样本t检验,多个样本均数间比较,采用方差分析。P < 0.05为差异有统计学意义。
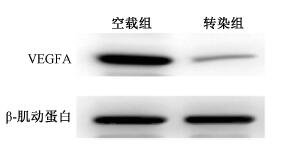
结果1.食管癌ECA-109细胞空载组及VEGFA转染组VEGFA表达情况:qPCR实验结果显示,与空载组相比,转染组的VEGFA基因的表达明显受到抑制,其中空载组VEGFA的2-ΔΔCt的均值为1.007,而转染组的2-ΔΔCt的均值为0.241,两者比值为0.24,提示转染组VEGFA抑制效率为76%(t=11.98, P < 0.05);Western blot实验结果显示,VEGFA蛋白表达显著降低(t=12.38, P < 0.05),见图 1。
|
图 1 Western blot检测VEGFA蛋白表达水平 Figure 1 VEGFA protein expression detected by Western blot |
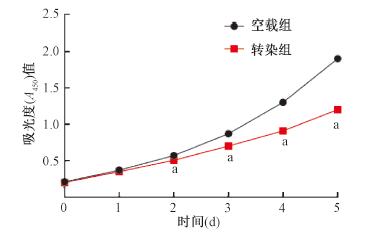
2.下调食管癌ECA-109细胞VEGFA对其增殖的抑制作用:CCK-8检测结果表明,在下调VEGFA表达24、48、72、96和120 h后,与空载组食管癌ECA-109细胞相比,其增殖均受到了抑制,除24 h外,48、72、96和120 h,差异均有统计学意义(t=2.78、7.25、21.93、13.21,P < 0.05)。空载组与VEGFA转染组的增殖曲线见图 2。
|
注:a与相同时间空载组比较,t=2.78、7.25、21.93、13.21,P < 0.05 图 2 两组ECA-109细胞不同时间的吸光度(A)值 Figure 2 Absorbance value of ECA-109 cells in two groups at different time based on CCK-8 assay |
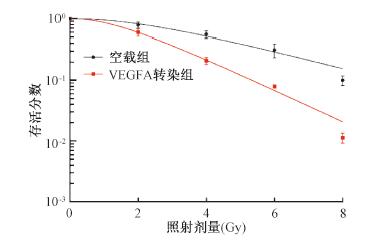
3.下调食管癌ECA-109细胞VEGFA联合X射线对其克隆形成能力及存活分数的影响:随着辐射剂量的增加,ECA-109细胞的克隆形成能力逐渐减弱,且ECA-109细胞VEGFA转染组的克隆形成能力弱于空载组。按照单击多靶模型拟合细胞存活分数曲线图,获得平均致死量(D0)、准阈剂量(Dq)及经2 Gy照射后的细胞存活分数(SF2)值,放射增敏比SERD0=空载组D0/转染组D0。与空载组相比,转染组D0、Dq、SF2的值均减小差异具有统计学意义(t=5.83、8.56、7.68,P < 0.05),SERD0、SERDq分别为1.41、2.09。空载组与VEGFA转染组ECA-109细胞在不同辐射剂量(0、2、4、6、8 Gy)的存活分数曲线和放射增敏参数分别见图 3和表 1。
|
图 3 ECA-109细胞存活分数曲线 Figure 3 The survivalcurves of ECA-109 cells |
|
|
表 1 两组ECA-109细胞的放射增敏参数及增敏比(x±s) Table 1 The radiosensitization parameters and sensitization ratio of ECA-109 (x±s) |
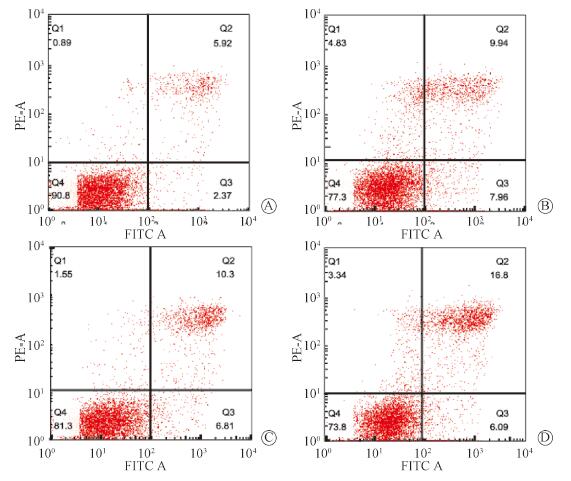
4.下调食管癌ECA-109细胞VEGFA对其凋亡的影响:流式细胞仪分析结果显示,与空载组比较,转染组及照射组ECA-109细胞的凋亡均增加,且VEGFA转染联合X射线组ECA-109细胞的凋亡率进一步增加,差异具有统计学意义(t=17.63、22.48、33.87,P < 0.05),见图 4。
|
图 4 各实验组细胞凋亡流式图A.空载组;B.VEGFA转染组;C.X射线组;D.VEGFA转染组联合X射线组 Figure 4 Apoptosis induction detected by flow cytometry in different groups A.Vectorgroup; B. sh-VEGFAgroup; C.Radiation group; D. sh-VEGFA+radiation group |
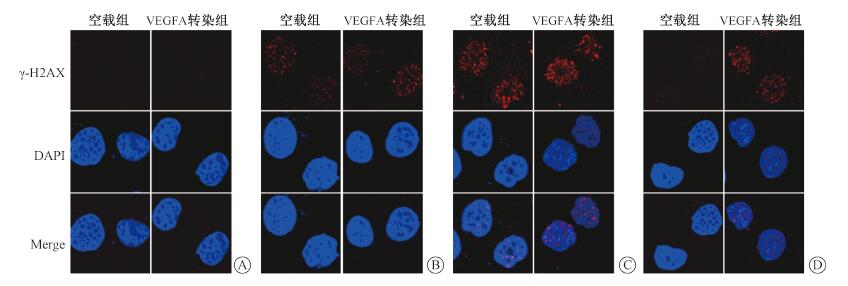
5.下调食管癌ECA-109细胞VEGFA对其DNA损伤修复的影响:食管癌ECA-109细胞接受4 Gy X射线照射后免疫荧光实验结果显示,空载组与VEGFA转染组细胞核中γ-H2AX焦点形成数量在0.5和2 h较照射前均有增加,差异无统计学意义(P>0.05)。照射24 h后空载组细胞核γ-H2AX焦点形成的数量恢复至照射前水平,而VEGFA转染组仍高于照射前水平,两组比较差异具有统计学意义(t=7.00,P < 0.05),见图 5。
|
注:DAPI.4, 6-二脒基-2-苯基吲哚荧光图;γ-H2AX.抗兔Alexa Fluor 555荧光图;Merge.两者融合图 图 5 不同时间各组ECA-109细胞Foci形成图×400 A.0 h;B. 0.5 h;C.2 h;D.24 h Figure 5 Foci formation in ECA-109 cellsatdifferenttimes after irradiation ×400 A.0 h; B.0.5 h; C.2 h; D.24 h |
讨论
食管癌多发于我国,每年新发病例占全球食管肿瘤半数以上,且发现时多已失去手术机会,需行放射治疗。而单纯放射治疗容易引起放疗抵抗,从而影响疗效,而临床上大量使用抗血管生成药物联合放疗后可以显著提升食管癌的治疗疗效[8]。
有文献报道,VEGF通过诱导血管和淋巴管的异常增生,促进肿瘤生长、增殖及迁移,并加重肿瘤细胞的乏氧状态[9],从而导致辐射抵抗。而Bhattacharya等[10]发现VEGF在结肠癌细胞中的功能是通过一种不同于其在血管生成中已确立的旁分泌或自分泌作用的新的内源性机制实现的。本组前期的体外细胞实验也显示出靶向阻断食管癌细胞VEGF表达之后可以明显提高细胞的辐射敏感性,这表明VEGF存在不依赖血管微环境的内源性辐射增敏机制[11-13],而具体调控机制尚不明确。血管内皮生长因子A(VEGFA)为VEGF家族成员之一,在许多已知的肿瘤中表达升高与肿瘤的病程密切相关。其主要通过与VEGFR1以及VEGFR2结合,进而引起下游信号通路激活引起一系列生物学效应[14]。
本研究通过慢病毒转染技术下调了食管癌细胞ECA-109的VEGFA表达,实验结果表明下调VEGFA对ECA-109细胞的增殖具有明显的抑制作用;细胞的凋亡比例增加,联合X射线后,凋亡比例进一步增加;随着X射线照射剂量的增加,细胞的存活分数相应下降,且D0、Dq、SF2的值均逐渐减小,放射增敏比SERD0、SERDq值逐渐增大。由此可见,下调VEGFA可以增强X射线对食管癌细胞的损伤,进一步增加了食管癌细胞的辐射敏感性。
引起一系列放射生物学效应(包括细胞死亡、突变和致癌作用)的关键靶点是DNA的损伤,完整的DNA出现单链断裂后很容易以对侧的互补链为模板进行损伤修复;而DNA双链断裂即可使染色体折成两段,无法继续复制,因此,双链断裂被认为是电离辐射在染色体上的最关键损伤[15]。为对DNA损伤进行应答,细胞将启动一系列DNA修复机制,通过阻滞细胞周期、修复损伤的DNA、影响细胞自噬、改善组织细胞乏氧状态等途径延缓细胞死亡进程[16]。DNA损伤修复能力的增强是导致细胞辐射抵抗的最主要原因之一[17-18]。而H2AX在DNA修复蛋白向DNA双链断裂(DSB)损伤位点的募集和积累中起着至关重要的作用,包括复制叉塌陷的位点。其活化后的γ- H2AX焦点的形成还导致泛素连接酶级联蛋白(RNF8-RNF168-UBC13)的募集,从而使BRCA1-A复合物和53BP1积累到DNA损伤位点引起DNA的损伤修复[19-21]。而随着损伤DNA的修复,已经形成的γ-H2AX焦点会逐渐减少[22]。本研究结果显示,下调VEGFA组与空载组ECA-109细胞核中的γ-H2AX焦点数量在2 h大量形成,这可能与DNA大量损伤未能及时修复所致;在24 h空载组细胞核中的γ-H2AX焦点基本消失,其数量恢复到照射前水平,而转染组细胞核中的焦点数量仍高于照射前水平,由此可见,转染组细胞核中的损伤DNA还有大量未进行修复[23-24]。
结合免疫荧光实验,VEGFA可影响γ-H2AX演变,而当前研究发现阻断VEGFR2通路后,经下游由磷酸肌醇3-激酶(phosphoinositide 3-kinases,PI3K)-蛋白激酶B(protein B/AKT)信号通路可影响γ-H2AX的激活,减少放化疗引起的DNA损伤修复,促进肿瘤细胞的凋亡。因而推测,VEGFA或许是通过与VEGFR2结合经AKT通路,调控H2AX演变,进而促进DNA损伤修复,减少放化疗引起的细胞凋亡,抑制细胞的辐射敏感性[25-29]。表明下调VEGFA表达可以增加食管癌ECA-109细胞的辐射敏感性,其机制可能是通过抑制DNA损伤修复而实现的,而其确切机制仍需进一步研究。
综上所述,本研究结果为临床制定精准的食管癌个体化放疗增敏方案提供新的理论依据,对提高食管癌放疗疗效具有重要的研究价值。
利益冲突 全体作者无利益冲突,排名无争议,未因进行该研究而接受任何不正当的职务和财务利益
志谢 本研究还接受常州市高层次卫生人才项目(2016C2BJ007)的资助
作者贡献声明 翁小坤为实验和论文撰写主要完成者;胡莉钧、孙菲负责研究过程指导;汪建林提出修改意见;谢凯、孔泽负责数据统计指导;周梦耘、高留刚协助实验完成;于静萍参与研究的酝酿和设计实验,提出修改意见
| [1] |
郭晓彤, 赫捷. 食管癌治疗现状及精准医学时代展望[J]. 中华肿瘤杂志, 2016, 38(9): 641-645. Guo XT, He J. Current status and prospect of treatment for esophage alcancer in the era of precision medicine[J]. Chin J Oncol, 2016, 38(9): 641-645. DOI:10.3760/cma.j.issn.0253-3766.2016.09.001 |
| [2] |
Zhou H, Zhang G, Xue X, et al. Identification of novel NRAGE involved in the radioresistance of esophageal cancer cells[J]. Tumour Biol, 2016, 37(7): 8741-8752. DOI:10.1007/s13277-015-4747-6 |
| [3] |
Chen M, Cai E, Huang J, et al. Prognostic value of vascular endothelial growth factor expression in patients with esophageal cancer:a systematic review and meta-analysis[J]. Cancer Epidemiol Biomarkers Prev, 2012, 21(7): 1126-1134. DOI:10.1158/1055-9965.EPI-12-0020 |
| [4] |
Qu W, Fu JD, Yang F, et al. Clinical implications of PTEN and VEGF expression status, as well as microvessel density in esophageal squamous cell carcinoma[J]. Oncol Lett, 2015, 10(3): 1409-1415. DOI:10.3892/ol.2015.3431 |
| [5] |
王坚, 于静萍, 汪建林, 等. 非手术食管癌患者放化疗中肿瘤组织病理反应和血清血管内皮生长因子的变化及其对预后的影响[J]. 中华肿瘤杂志, 2016, 38(8): 589-595. Wang J, Yu JP, Wang JL, et al. Pathologic response and changes of serum VEGF during chemoradiotherapy may predict prognosis in non-surgical patients with esophageal carcinoma[J]. Chin J Oncol, 2016, 38(8): 589-595. DOI:10.3760/cma.j.issn.0253-3766.2016.08.005 |
| [6] |
Mackenzie F, Ruhrberg C. Diverse roles for VEGF-A in the nervous system[J]. Development, 2012, 139(8): 1371-1380. DOI:10.1242/dev.072348 |
| [7] |
Dougher-Vermazen M, Hulmes JD, Böhlen P, et al. Biological activity and phosphorylation sites of the bacterially expressed cytosolic domain of the KDR VEGF-receptor[J]. Biochem Biophys Res Commun, 1994, 205(1): 728-738. DOI:10.1006/bbrc.1994.2726 |
| [8] |
Malhotra GK, Yanala U, Ravipati A, et al. Global trends in esophageal cancer[J]. J Surg Oncol, 2017, 115(5): 564-579. DOI:10.1002/jso.24592 |
| [9] |
Wu JB, Tang YL, Liang XH. Targeting VEGF pathway to normalize the vasculature:an emerging insight in cancer therapy[J]. Onco Targ Ther, 2018, 11: 6901-6909. DOI:10.2147/OTT.S172042 |
| [10] |
Bhattacharya R, Fan F, Wang R, et al. Intracrine VEGF signalling mediates colorectal cancer cell migration and invasion[J]. Br J Cancer, 2017, 117(6): 848-855. DOI:10.1038/bjc.2017.238 |
| [11] |
孙菲, 孙志强, 汪建林, 等. 阿帕替尼对食管癌Kyse-150细胞放射敏感性影响的实验研究[J]. 中华放射医学与防护杂志, 2017, 37(11): 805-809, 831. Sun F, Sun Z, Wang J, et al. Radiosensitizing effect of apatinib on esophageal cancer cell line Kyse-150[J]. Chin J Radiol Med Prot, 2017, 37(11): 805-809, 831. DOI:10.3760/cma.j.issn.0254-5098.2017.11.001 |
| [12] |
孔泽, 汪建林, 孙志强, 等. 阿帕替尼对食管鳞癌ECA-109细胞及其干性细胞辐射敏感性的影响及机制探讨[J]. 中华放射医学与防护杂志, 2018, 38(3): 161-167. Kong Z, Wang JL, Sun ZQ, et al. The radiosensitivity effects of apatinib on the esophageal cancer cell line ECA-109 and its stem-like cells[J]. Chin J Radiol Med Prot, 2018, 38(3): 161-167. DOI:10.3760/cma.j.issn.0254-5098.2018.03.001 |
| [13] |
Hu L, Sun F, Sun Z, et al. Apatinib enhances the radiosensitivity of the esophageal cancer cell line KYSE-150 by inducing apoptosis and cell cycle redistribution[J]. Oncol Lett, 2019, 17(2): 1609-1616. DOI:10.3892/ol.2018.9803 |
| [14] |
Yuan XH, Yang J, Wang XY, et al. Association between EGFR/KRAS mutation and expression of VEGFA, VEGFR and VEGFR2 in lung adenocarcinoma[J]. Oncol Lett, 2018, 16(2): 2105-2112. DOI:10.3892/ol.2018.8901 |
| [15] |
Soni A, Li F, Wang Y, et al. Inhibition of Parp1 by BMN673 effectively sensitizes cells to radiotherapy by upsetting the balance of repair pathways processing DNA double-strand breaks[J]. Mol Cancer Ther, 2018, 17(10): 2206-2216. DOI:10.1158/1535-7163.MCT-17-0836 |
| [16] |
Wang H, Mu X, He H, et al. Cancer radiosensitizers[J]. Trends Pharmacol Sci, 2018, 39(1): 24-48. DOI:10.1016/j.tips.2017.11.003 |
| [17] |
Biau J, Chautard E, De Koning L, et al. Predictive biomarkers of resistance to hypofractionated radiotherapy in high grade glioma[J]. Radiat Oncol, 2017, 12(1): 123. DOI:10.1186/s13014-017-0858-0 |
| [18] |
Dickey JS, Redon CE, Nakamura AJ, et al. H2AX:functional roles and potential applications[J]. Chromosoma, 2009, 118(6): 683-692. DOI:10.1007/s00412-009-0234-4 |
| [19] |
Fillingham J, Keogh MC, Krogan NJ. γ-H2AX and its role in DNA double-strand break repair[J]. Biochem Cell Biol, 2006, 84(4): 568-577. DOI:10.1139/o06-072 |
| [20] |
Fernandez-Capetillo O, Lee A, Nussenzweig M, et al. H2AX:the histone guardian of the genome[J]. DNA Repair (Amst), 2004, 3(8-9): 959-967. DOI:10.1016/j.dnarep.2004.03.024 |
| [21] |
Furuta T, Takemura H, Liao ZY, et al. Phosphorylation of histone H2AX and activation of Mre11, Rad50, and Nbs1 in response to replication-dependent DNA double-strand breaks induced by mammalian DNA topoisomerase I cleavage complexes[J]. J Biol Chem, 2003, 278(22): 20303-20312. DOI:10.1074/jbc.M300198200 |
| [22] |
Solier S, Pommier Y. The nuclear gamma-H2AX apoptotic ring:implications for cancers and autoimmune diseases[J]. Cell Mol Life Sci, 2014, 71(12): 2289-2297. DOI:10.1007/s00018-013-1555-2 |
| [23] |
Moeglin E, Desplancq D, Conic S, et al. Uniform widespread nuclear phosphorylation of histone H2AX is an indicator of lethal DNA replication stress[J]. Cancers(Basel), 2019, 11(3): 355-376. DOI:10.3390/cancers11030355 |
| [24] |
di Masi A, Cilli D, Berardinelli F, et al. PML nuclear body disruption impairs DNA double-strand break sensing and repair in APL[J]. Cell Death Dis, 2016, 7: e2308. DOI:10.1038/cddis.2016.115 |
| [25] |
Rezaeian AH, Li CF, Wu CY, et al. A hypoxia-responsive TRAF6-ATM-H2AX signalling axis promotes HIF1α activation, tumorigenesis and metastasis[J]. Nat Cell Biol, 2017, 19(1): 38-51. DOI:10.1038/ncb3445 |
| [26] |
Pennisi R, Antoccia A, Leone S, et al. HSP90α regulates ATM and NBN functions in sensing and repair of DNA double-strand breaks[J]. FEBS J, 2017, 284(15): 2378-2395. DOI:10.1111/febs.14145 |
| [27] |
Kang J, Ferguson D, Song H, et al. Functional interaction of H2AX, NBS1, and p53 in ATM-dependent DNA damage responses and tumor suppression[J]. Mol Cell Biol, 2005, 25(2): 661-670. DOI:10.1128/MCB.25.2.661-670.2005 |
| [28] |
Huang J, Wang X, Wen G, et al. miRNA2055p functions as a tumor suppressor by negatively regulating VEGFA and PI3K/Akt/mTOR signaling in renal carcinoma cells[J]. Oncol Rep, 2019, 42(5): 1677-1688. DOI:10.3892/or.2019.7307 |
| [29] |
Liao JB, Jin HL, Li SQ, et al. Apatinib potentiates irradiation effect via suppressing PI3K/AKT signaling pathway in hepatocellular carcinoma[J]. J Exp Clin Cancer Res, 2019, 38(1): 454. DOI:10.1186/s13046-019-1419-1 |
 2020, Vol. 40
2020, Vol. 40


