近距离放射治疗与外照射相比,具有正常组织损伤小、剂量跌落梯度大的优点,常用于子宫颈癌、直肠癌、食管癌等癌症的局部加量治疗,且取得了良好的治疗效果[1]。随着技术的发展,三维后装技术逐步取代了传统二维后装技术,计划系统相对剂量分布计算的准确性尤为关键。Acuros BV为三维近距离治疗计划系统采用的非均质剂量计算算法。国内外一些学者用IBA Matrix二维矩阵(1 024个电离室)对三维后装剂量分布测量进行了相关研究[2-5],但并未对二维矩阵测试结果是否存在偏差进行测试,且少有用PTW729二维矩阵(729个电离室)验证Acuros BV算法的研究。因此,本研究探讨PTW729二维矩阵电离室验证Acuros BV算法在相对剂量分布计算方面的可行性,为实际临床工作提供参考。
材料与方法1.测量设备:PTW729为德国PTW公司生产的二维矩阵电离室,有729个大小为5 mm×5 mm×5 mm平行板电离室,间隔5 mm,最大测量范围为270 mm×270 mm,有效测量层面距表面7.5 mm(密度为0.8 g/cm3,等效为8 mm固体水[6]),剂量率测量分辨率为0.1 mGy/min,有效测量范围0.5~48.0 Gy/min,重复频率为200 ms。美国Gafchromic EBT3胶片,厚度为0.28 mm,由中央0.030 mm作用层和两侧0.125 mm透明保护层组成,能量响应范围为1~1 000 cGy。其他设备为美国Varian GammaMedPlus iX高剂量率后装治疗机和Eclipse13.6三维后装治疗计划系统,瑞典IBA固体水,杭州麦迪凯组织补偿膜,美国Radiation Products Design Permadoc模体不锈钢施源器,日本EPSON Expression 1680扫描仪,德国PTW Verisoft patient plan verification分析比对软件。
2.胶片标定:分别用10、50、100、120、140、160、180、200、220、240、260、280,300、350、400、450、500、600、700和1 000 cGy标定胶片。光密度(optical density,OD)值的计算为:NetOD=log10(Iunexp/Iexp),Iunexp为同型号批次胶片未经过曝光的平均像素值,Iexp为经过曝光后的像素值[7]。
3.模体设计:本研究建立的模体如图 1所示,分别为PTW729二维矩阵电离室测量模体和胶片测量模体。这两种模体均采用2 cm厚固体水和5 cm厚固体水建立足够的正向和背向散射条件,分别置于整个模体的顶部和底部。利用组织补偿膜敷贴于施源器上方,使施源器与顶部2 cm厚固体水贴合固定。为保证两种方法测量条件一致,将施源器均放置于顶部2 cm固体水下方中心部位。施源器紧贴矩阵电离室(图 1中蓝色所示),因施源器到矩阵电离室有效测量平面的距离为7.5 mm,在用胶片测量时,需在胶片上利用8 mm厚固体水以等效该距离[6],施源器紧贴8 mm厚固体水(图 1中黄色所示)。

|
图 1 测试模体A. PTW729二维矩阵电离室模体;B.胶片模体 Figure 1 Measurement phantom A. Phantom for PTW729 2D array ion-chamber; B. Phantom for film |
4.比较方法:利用PTW分析比对软件,进行γ值比对分析[8]。选择自动位置校准功能匹配中心位置,减小因摆放施源器造成的误差。根据美国医学物理师协会(AAPM) TG 119号报告[9],比对条件设置为局部归一,3 mm位置偏差(DTA),3%剂量偏差,10%阈值。
5.后装治疗机检测:本研究所做测试均使用后装治疗机,为排除该机器的偏差对本研究的影响,本研究基于国家卫健委2017年颁布的“后装γ源近距离治疗质量控制检测规范”,用井型电离室和胶片,对后装机源活度、源传输到位精度、源累计定位误差和源驻留时间误差进行质量控制。
6. Acuros BV算法验证的必要性测试:采用图 1所示的模体,在计划系统中设计了一个单个施源器计划(共10个驻留点,驻留间隔5 mm,每个驻留点驻留10 s),分别用均质算法AAPM TG-43[10]和Acuros BV算法计算得到两个计划。在计划系统中,读取第5个驻留点右侧,水平距离1、2、3、4、和5 cm的点剂量。
7.二维矩阵电离室方法的准确性测试:首先,计算治疗计划系统(TPS)剂量分布,用图 1方法建立胶片测量模体,并在放胶片处用铅点标记胶片层面,即测量层面,取出胶片,用3 mm层厚CT扫描,传至计划系统,建立计划(1个施源器,19个驻留点,5 mm等间隔,每个驻留点驻留10 s),用Acuros BV算法计算。按照270 mm×270 mm大小,1 mm网格分辨率导出用铅点标记的测量层面的剂量分布。
然后,用胶片方法测量,将胶片按照图 1胶片模体所示位置插入模体,连接至后装机执行与计划系统同样的计划,然后取出胶片分析。将测量后的胶片用扫描仪按照正片,300 dpi,16 bit投射条件扫描成tiff图像。并利用胶片刻度曲线,通过PTW胶片分析软件,使扫描后的灰度图像携带剂量分布信息。
最后,用二维矩阵方法测量,建立图 1二维矩阵电离室测量模体,并连接至后装机,执行与计划系统同样的计划,保存测量结果。
8.二维矩阵电离室方法的稳定性测试:利用图 1所示的二维矩阵测量模体,选用单个施源器,执行3个计划进行测试(计划1:1个驻留点,驻留时间为20 s;计划2:4个等间隔20 mm的驻留点,驻留时间为25、20、15和10 s;计划3 :14个等间隔5 mm的驻留点,并调节驻留时间形成梨形剂量分布)。3个计划均用TPS中Acuros BV算法计算。
结果1.后装治疗机检测:利用井型电离室检测后装放射源192Ir活度为1.24×1011 Bq,与后装治疗机标称源活度偏差1.5%。用PermaDoc源到位精度验证模体,测试源到位精度偏差为-0.5 mm,源累计到位误差为+1 mm。用秒表测试源驻留时间偏差+0.1 s。均满足国家标准,对本研究结果无影响。
2.Acuros BV算法验证的必要性测试:结果如下表 1所示,剂量偏差均在10%左右。因此,施源器材料和非均匀组织对剂量分布的影响不容忽视,必须对Acuros BV算法进行验证。
|
|
表 1 TG-43号报告算法与Acuros BV算法的剂量偏差 Table 1 Dose deviation between TG-43 Report and Acuros BV algorithm |
3.二维矩阵的准确性测试:对TPS计算结果、PTW729二维矩阵测量结果和胶片测量结果分别进行两两γ比对分析,结果如图 2所示。胶片测量结果与TPS计算结果的γ通过率为93.9%,根据AAPM 119号报告[9],可视为Acuros BV算法计算准确。PTW729测量结果与TPS计算结果的γ通过率为98.9%,从图中可看出,检测出的偏差区域与胶片方法一致。PTW729测量结果与胶片测量结果的γ通过率为88%,相比于金标准——胶片方法,PTW729二维矩阵电离室方法存在误差,低估了剂量分布真实存在的差异。
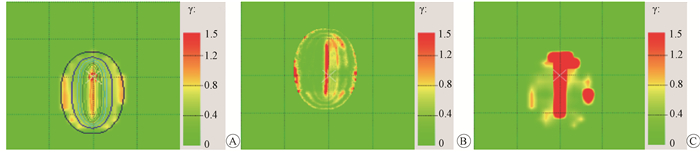
|
图 2 二维矩阵的准确性测试结果A. PTW729与TPS γ对比结果; B.胶片与TPS γ对比结果; C. PTW729与胶片γ对比结果 Figure 2 Accuracy test results for 2D array ion-chamber A.γ Comparison between PTW729 and TPS; B.γ Comparison between film and TPS; C.γ Comparison between PTW729 and film |
4.二维矩阵的稳定性测试:3个计划的PTW729测量结果与TPS计算结果进行γ对比分析,见图 3。3种剂量分布在近距离后装治疗中且具有代表性。3个计划γ通过率分别为95%、100%、100%。因此可认为该方法稳定性能较好。
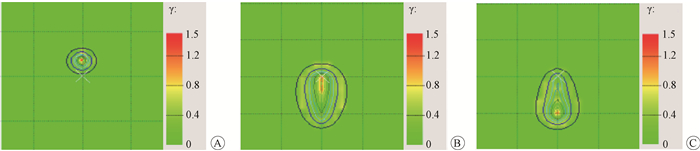
|
图 3 二维矩阵的稳定性测试结果A.计划1; B.计划2; C.计划3 Figure 3 Stability test results for 2D array ion-chamber A. Plan 1;B. Plan 2; C. Plan 3 |
讨论
通常临床中所用的基于TG-43号报告的后装剂量算法极大地简化了算法配置,将计算环境均视为均匀水模体,与实际情况偏差较大。Deshpande等[11]研究了TG-43和Acuros BV算法在横向散射剂量学中的差异,最大可达到10%。Sinnatamby等[12]研究发现,在乳腺插植计划中,Acuros BV算法较TG-43方法,因插植针为不锈钢材料,而引起的平均剂量差异范围为4%~53%。Rivard等[13]研究认为在临床使用中,不考虑源封装材料对剂量的影响,算出的剂量分布是无效的。瓦里安公司提出的Acuros BV算法考虑了不同组织密度、施源器材料等因素对计算结果的修正。因此,在做后装治疗质量控制时,仅仅对源活度、源到位精度和驻留时间精度进行测试,不足以保证治疗的准确性,还需要对计划系统的相对剂量计算精度做验证。比如Toossi等[14]对食管癌近距离治疗中剂量分布的准确性做了研究。
分析本研究结果可知,在检测能力方面,PTW729二维矩阵电离室方法具备与胶片方法一致的定性检测结果,两种方法与TPS计算的剂量分布的偏差均集中于施源器内的超高剂量区域以及最外层的低剂量区域(10%~20%剂量区)。这是因为放射源剂量分布的距离平方反比性质,距离源很近的区域,剂量梯度变化太大,测试中微小的距离误差都会引起较大偏差,而最外层低剂量区的偏差则是因为电离室和胶片在超低剂量区域响应的偏差引起的,受电离室和胶片自身材料能量响应精度影响。在精度方面,PTW729二维矩阵电离室方法检测精度较低。因为PTW729所测得数据是间隔0.5 cm离散的,在做γ分析比对时参与计算的点比实际的少很多,剂量分布则是通过数学插植算法得到的,而胶片得到的剂量分布则是连续的,较真实地反映了实际剂量分布的情况。又因为放射源剂量分布受距离的影响较大,因此,导致它与胶片方法的γ比对结果偏低,而与TPS的γ比对结果大于胶片方法。在实际操作方面,PTW729二维矩阵电离室方法不需要胶片剂量刻度、扫描等过程,不用购置昂贵的胶片和扫描仪,且重复性较好。经过3个案例的测试,PTW729测量结果的γ通过率均≥95%[8, 15],且分布偏差位置均位于超高剂量区和最外层低剂量区。
综上所述,PTW729二维矩阵电离室可以快速且准确地检测出Acuros BV算法计算相对剂量分布的偏差。相比胶片方法,具有检测成本低、操作简单、可快速查看结果、人为因素影响小的优点,可以作为Acuros BV计算相对剂量的日常快速验证验证工具。但是,PTW729二维矩阵电离室精度比胶片低,因此不适用于做计划系统Acuros BV算法的验收或者精确测量,此时仍应用胶片测量。精准放疗需要严格的质量控制,任何一种质量控制方式都有适用的场合,在日常的质量控制中,需要根据每种质量控制方式的特点和需求选择合适的方法。
本研究只讨论了相对剂量分布的情况,若要测试Acuros BV计算绝对剂量的准确性则仍需要进一步研究192Ir源周围点剂量的测量。
利益冲突 无
作者贡献声明 赵强负责实验设计、数据分析和论文撰写;吴湘阳负责实验指导、数据审核协助论文审阅;常晓斌、冯涛负责技术指导和辅助实验设计;杨迪、邓佳负责论文修改;张坤、屈喜梅、王学敏负责具体实验操作和数据采集
| [1] |
龚唯, 徐晓婷, 李莉, 等. 影像引导宫颈癌三维腔内放疗的临床初步观察[J]. 中国癌症杂志, 2015, 25(11): 906-910. Gong W, Xu XT, Li L, et al. Clinical preliminary observation on image-guided brachytherapy for cervical cancer[J]. China Oncol, 2015, 25(11): 906-910. DOI:10.3969/j.issn.1007-3969.2015.11.011 |
| [2] |
于浪, 杨波, 庞廷田, 等. 应用二维电离室矩阵对后装剂量分布的验证[J]. 协和医学杂志, 2013, 4(4): 408-412. Yu L, Yang B, Pang TT, et al. Use of two-dimensional ionization chamber array on brachytherapy dose verification[J]. Med J Peking Union Med Coll Hosp, 2013, 4(4): 408-412. DOI:10.3969/j.issn.1674-9081.2013.04.013 |
| [3] |
Yewondwossen M, Meng J. Commissioning of brachytherapy TPS using a 2D array of ion chambers[J]. J Phys Conf Ser, 2010, 250(1): 012054. DOI:10.1088/1742-6596/250/1/012054 |
| [4] |
刘浩, 李公平, 孙燕, 等. 二维电离室矩阵在近距离治疗的质量保证中的应用[J]. 中国医学物理学杂志, 2011, 28(4): 2718-2721. Liu H, Li GP, Sun Y, et al. Application of a two-dimensional ion-chamber array for quality assurance in brachytherapy[J]. Chin J Med Phys, 2011, 28(4): 2718-2721. DOI:10.3969/j.issn.1005-202X.2011.04.004 |
| [5] |
Moustafa R, Deiab NA, Elnaggar MH, et al. Dose distributions verification for high dose rate brachytherapy plans by using ionization chambers 2D array[J]. Int J Comput Technol, 2016, 15(3): 6618-6625. DOI:10.24297/ijct.v15i3.1685 |
| [6] |
Stelljes TS, Harmeyer A, Reuter J, et al. Dosimetric characteristics of the novel 2D ionization chamber array OCTAVIUS detector 1500[J]. Med Phys, 2015, 42(4): 1528-1537. DOI:10.1118/1.4914151 |
| [7] |
Inoue T, Sugimoto S, Fukata K, et al. SU-E-T-142:Evaluation of the energy dependence of gafchromic EBT3 film for electron beams[J]. Med Phys, 2012, 39(6Part11): 3735-3736. DOI:10.1118/1.4735200 |
| [8] |
Low DA, Dempsey JF. Evaluation of the γ dose distribution comparison method[J]. Med Phys, 2003, 30(9): 2455-2464. DOI:10.1118/1.1598711 |
| [9] |
Ezzell GA, Burmeister JW, Dogan N, et al. IMRT commissioning:multiple institution planning and dosimetry comparisons, a report from AAPM Task Group 119[J]. Med Phys, 2009, 36(11): 5359-5373. DOI:10.1118/1.3238104 |
| [10] |
Nath R, Anderson LL, Luxton G, et al. Dosimetry of interstitial brachytherapy sources:recommendations of the AAPM Radiation Therapy Committee Task Group No[J]. Med Phys, 1995, 22(2): 209-234. DOI:10.1118/1.597458 |
| [11] |
Deshpande S, Patwe P, Avdhoot S, et al. SU-E-T-345:Dose comparison of TG-43 and adcuros algorithm to account lateral scatter in dose distribution[J]. Med Phys, 2013, 40(6Part16): 283-284. DOI:10.1118/1.4814779 |
| [12] |
Sinnatamby M, Nagarajan V, Reddy S, et al. Dosimetric comparison of AcurosTM BV with AAPM TG43 dose calculation formalism in breast interstitial high-dose-rate brachytherapy with the use of metal catheters[J]. J Contemp Brachyther, 2015, 7(4): 273-279. DOI:10.5114/jcb.2015.54052 |
| [13] |
Rivard MJ, Kirk BL, Leal LC. Impact of radionuclide physical distribution on brachytherapy dosimetry parameters[J]. Nucl Sci Eng, 2005, 149(1): 101-106. DOI:10.13182/NSE05-A2480 |
| [14] |
Toossi MTB, Safaeian G, Toossi MHB, et al. Evaluation of dose distribution accuracy in HDR brachytherapy of esophagus cancer based on MRI normoxic polymer Gel dosimetry[J]. Iranian J Med Phys, 2010, 7(1): 1-14. DOI:10.22038/ijmp.2010.7267 |
| [15] |
Winiecki J, Morgas T, Majewska K, et al. The γ evaluation method as a routine QA procedure of IMRT[J]. Rep Pract Oncol Radiother, 2009, 14(5): 162-168. DOI:10.1016/s1507-1367(10)60031-4 |
 2020, Vol. 40
2020, Vol. 40


