2. 河北一洲肿瘤医院, 涿州 072750
2. Hebei Yizhou Cancer Hospital, Zhuozhou 072750, China
随着放疗技术的快速发展,外照射放疗(external beam radiation therapy,EBRT)已成为前列腺癌的重要治疗手段。放射治疗不仅能用于早期前列腺癌的根治性治疗,也可用于晚期前列腺癌的姑息性治疗,均有非常好的疗效,尤其是精确放疗技术的出现,在极大地提高放疗准确性的同时,更好地保护了周围正常组织和器官,减少了放疗后并发症的发生,从而降低了放射性损伤的发生率,提高了患者的生存质量和生存率。
RapidArc是美国瓦里安公司所采用的一种容积旋转调强放疗(volumetric modulated arc therapy,VMAT)技术,治疗过程中利用连续束流的同时,通过动态调节机架旋转速度、束流剂量率以及多叶准直器(MLC)叶片的速度以增加治疗束流调制的自由度[1-2],从而可获得较好的剂量分布。与常规的调强放疗(intensity modulated radiation therapy,IMRT)相比,VMAT可以降低机器跳数,减少治疗时间,提高治疗的精度[3-4]。然而,光子的IMRT或VMAT都会增加正常组织和器官的受照体积,从而增加其受照剂量,提高二次肿瘤的发生风险。与光子相比,质子因其独特的物理学特性,特别是后缘剂量的迅速跌落,在危及器官保护上体现了潜在的优势。目前,质子调强放疗(intensity modulated proton therapy,IMPT)技术已经应用于临床,研究证明前列腺癌质子放疗与光子放疗相比体现出了明显的剂量学优势[5-6]。IMPT主要是通过笔形束扫描(pencil beam scanning,PBS)技术运用窄质子束在三维方向上主动扫描靶体积,从而获得均匀的剂量分布。PBS的出现改变了传统被动散射的照射方式,提高靶区剂量适形度,降低中子剂量,成为目前质子治疗较为理想的剂量传递模式[7-8]。本研究旨在研究基于PTV的前列腺癌IMPT计划与RapidArc计划的剂量学特性,评估其计划质量差异,为临床应用提供参考。
资料与方法1.临床资料与模拟定位:回顾性选取解放军总医院第一医学中心早期前列腺癌患者10例,其中T2A期3例、T2B期4例、T2C期3例,中位Gleason评分为6.4分,中位年龄82岁。所有患者均取仰卧位,热塑体模固定,双手交叉抱肘置于额头,采用德国西门子大孔径模拟定位CT(SOMATOM Definition AS)进行模拟定位,扫描层厚0.3 cm,扫描范围为腰5椎体上缘至坐骨结节下2.0 cm处。
2.靶区勾画:前列腺癌临床靶区(CTV)包括前列腺及精囊;计划靶区(PTV)为CTV在头脚、左右及身体前方外放0.5 cm,直肠方向外放0.3 cm,同时勾画膀胱、直肠和股骨头等正常器官。PTV光子计划的处方剂量及质子计划相对生物效应(relative biological effectiveness,RBE)等效剂量均为70 Gy/28次。
3.治疗计划设计
(1) RapidArc计划:RapidArc计划设计采用美国瓦里安Eclipse Ver 10.0治疗计划系统(TPS);施照机器选用瓦里安Clinac iX 6 MV直线加速器,该设备配备Millennium 120 MLC,中间40对叶片和外侧各10对叶片在等中心处宽度分别为0.5、1.0 cm;最大速度2.5 cm/s;机架最大旋转速度4.8°/s;标定最大剂量率600 MU/min;机架角度控制均利用每2°控制点模式;最大控制点数177个。Eclipse的机架起始角度均为180.1°和179.9°,分别为逆时针和顺时针的2全弧计划,为减小凹凸槽效应小机头角度设为±15°;铅门均手动调整,采取固定铅门方式。RapidArc计划优化采用的是渐进式分辨率优化算法(progressive resolution optimizer,PRO),最终的剂量计算采用各向异性解析算法(anisotropic analytical algorithm,AAA),计算网格为2 mm。
(2) IMPT计划:IMPT计划设计采用RayStation Ver 7.0(RaySearch Laboratories, Stockholm,瑞典)TPS,数据模型选取IBA Protues Plus质子治疗系统,该系统配备360°旋转机架束流传输系统、PBS专用机头(dedicated nozzle,DN)、6自由度患者定位系统以及质子治疗图像引导系统。固定能量等时性回旋加速器C230可产生连续的230 MeV质子束,通过能量选择系统(energy selection system,ESS)将加速器引出的固定能量调整到PBS治疗所需的能量范围。PBS治疗模式最大射野30 cm×40 cm;最大、最小射程分别为32 g/cm2(226.09 MeV)和4.1 g/cm2(70 MeV)。IMPT计划设计采用两平行对穿野(90°和270°)进行多野优化(multiple field optimization,MFO),优化选用笔形束(PB)算法,束斑间隔及能量间隔选用默认值,分别用PB算法(Ver 4.2)和蒙特卡罗(MC)(Ver 4.1)算法进行最终剂量计算,计算网格为2 mm,MC的统计不确定性设为0.5%,其设计的计划分别定义为PB-IMPT和MC-IMPT。
4.剂量学评估:计划均要求100%处方剂量覆盖95%的靶区体积,根据TPS各自的特点设置优化参数,从剂量分布、剂量体积直方图(dose volume histogram,DVH)等方面评价治疗计划质量的差异。靶区评价指标包括D1%、HI和CI。HI=(D5%-D95%)/DT,其中D5%是指5%靶体积接受的最小剂量,D95%为95%靶体积接受的最低剂量;HI越低(接近0)表示靶剂量越均匀。CI=Vt, ref/Vt×Vt, ref/Vref,其中Vt, ref为参考等剂量线所包绕靶体积,Vt为靶体积,Vref是参考等剂量线包绕区域体积;CI介于0~1间,CI越接近1表示剂量分布适形度越好。前列腺癌OAR评价膀胱和直肠的V30、V40、V50、Dmean以及左右股骨头的Dmean。
5.统计学处理:采用SPSS 19.0软件进行分析,计量资料符合正态分布,结果用
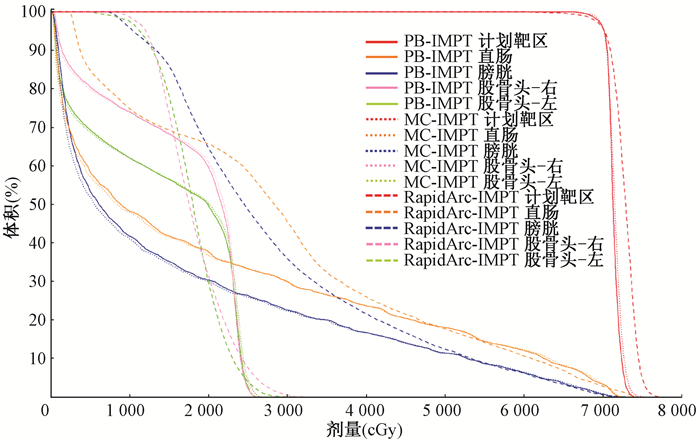
1.靶区剂量学参数比较:PB-IMPT和MC-IMPT计划的HI均要略优于RapidArc计划, 其中PB-IMPT与RapidArc计划的差异具有统计学意义(Z=-2.805,P=0.005),但CI均要略低于RapidArc计划,其中RapidArc与MC-IMPT计划的差异具有统计学意义(Z=-2.395,P=0.017);PB-IMRT计划的D1%要明显的优于RapidArc计划,且差异均有统计学意义(Z=-2.803,P < 0.05);对于PB-IMPT和MC-IMPT计划,PB-IMPT计划靶区的D1%、CI和HI都要略好于MC-IMPT计划,且差异均有统计学意义(Z=-2.805、-2.497、-2.803,P < 0.05),详见表 1和图 1。
|
|
表 1 10例前列腺癌质子与光子计划剂量学参数比较( |
|
注:PB-IMPT.应用笔形束算法计算的质子调强计划;MC-IMPT.应用蒙卡算法计算的质子调强计划 图 1 1例前列腺癌患者IMPT和RapidArc计划的DVH图比较 Figure 1 Comparison of the DVHs between IMPT and RapidArc plans for one prostate cancer case |
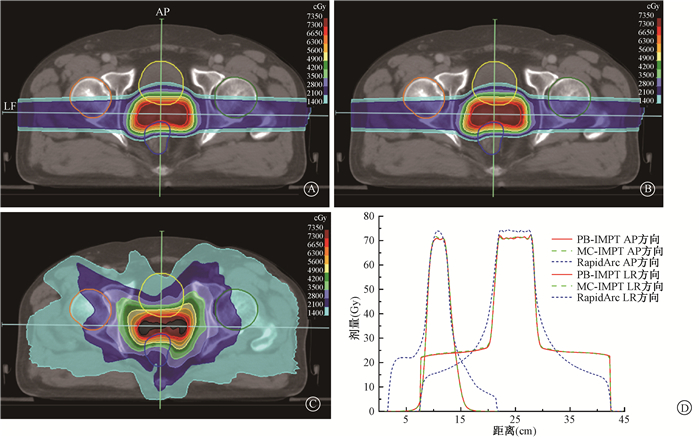
2.危及器官剂量学参数比较:除直肠V50外,PB-IMPT和MC-IMPT计划在危及器官的保护上均要优于RapidArc计划,其中,直肠V30(Z=-2.191、-1.988,P < 0.05)和Dmean(Z=-2.599、-2.497,P < 0.05),膀胱V30(Z=-2.701、-2.701,P < 0.05)、V40(Z=-2.395、-2.395,P < 0.05)和Dmean(Z=-2.701、-2.701,P < 0.05)差异有统计学意义。对于PB-IMPT和MC-IMPT计划,两者之间在危及器官受量上并没有明显差异,详见表 1。在计划的剂量分布上,特别是直肠和膀胱方向低剂量区的范围,PB-IMPT和MC-IMPT计划均要于小于RapidArc计划,见图 2。
|
注:PB-IMPT.应用笔形束算法计算的质子调强计划;MC-IMPT.应用蒙卡算法计算的质子调强计划;AP.患者前后方向的线剂量;LF.患者左右方向的线剂量 图 2 1例前列腺癌患者IMPT和RapidArc计划的剂量分布A. PB-IMPT;B. MC-IMPT;C. RapidArc;D.线剂量 Figure 2 Dose distribution of IMPT and RapidArc plans for one prostate cancer case A. PB-IMPT; B. MC-IMPT; C. RapidArc; D. Line Dose |
讨论
质子治疗的优势主要源于质子束的物理特性,有限的射程可以确定和控制其穿透深度,固有的陡峭半影边沿使布拉格峰或靶区后缘剂量迅速跌落至零,从而提供了降低放疗不良反应,提高肿瘤控制率的潜在机会。Hara等[9]对16例早期前列腺癌患者进行质子适形治疗,用磁共振成像(MRI)和前列腺特异抗原(PSA)观察治疗效果,得到了满意的局部控制率,同时减轻了皮肤和膀胱的反应,未见Ⅲ、Ⅳ级不良反应。前期质子治疗的大量研究主要是利用双散射和均匀扫描技术,治疗计划的设计主要是基于三维适形方式。Rana等[10]对前列腺癌均匀扫描质子治疗(uniform scanning proton therapy,USPT)计划和VMAT计划进行了比较,结果显示在低剂量和中剂量区域,USPT计划在危及器官保护上要明显优于VMAT计划,但在高剂量区域优势不明显。随着质子治疗技术的发展,PBS技术因其极好地束流调制和剂量适形能力等优势,逐渐取代了被动散射。Rana等[11]对前列腺癌IMPT和USPT计划进行了比较,发现IMPT计划具有更好的剂量学结果,特别是在直肠、膀胱及股骨头等危及器官的保护上。本研究是基于PBS技术的前列腺癌IMPT计划,采用两平行对穿野,与光子RapidArc计划相比,IMPT计划极大地保护了周围的正常组织和器官,降低了受量,体现了较好的剂量分布优势。
本研究可知,IMPT和光子RapidArc两种不同的放疗方式都满足了靶区的剂量的要求,得到了较好的剂量均匀性和靶区适形度,但在周围正常组织和器官的保护上了体现出了明显的差异。与RapidArc相比,IMPT不仅明显减少了靶区内高剂量区的体积,而且更好地的保护了直肠、膀胱以及双侧的股骨头,特别是在直肠的V30和Dmean、膀胱的V30、V40和Dmean以及左右股骨头的Dmean上均体现了明显地剂量学优势,其中Dmean分别减少约16%、40%、26%和24%。Trofimov等[12]对早期前列腺癌的光子调强和质子计划进行了比较,质子计划的靶区均匀性要优于光子调强计划,直肠和膀胱的平均剂量都要优于光子计划,且分别降低了26%和20%;Rana等[13]等对高危前列腺癌IMPT和RapidArc计划进行了比较,结果表明直肠和膀胱的平均剂量,IMPT计划要明显低于RapidArc计划,且IMPT计划得到了更低的直肠和膀胱的V30;Whitaker等[14]对高危前列腺癌IMPT和VMAT计划比较结果表明,与VMAT计划相比,IMPT明显地降低了危及器官受量,并得到了更好的靶区覆盖;Georg等[15]对局部前列腺癌VMAT、IMPT、碳离子治疗和近距离治疗计划的剂量学差异进行了评估,结果同样表明,IMPT在直肠和膀胱低、中剂量区域的保护上要优于VMAT计划。基于PBS技术的IMPT计划可以通过优化参数逆向优化束斑的位置、分布及权重,从而进一步改善靶区剂量,减少正常组织和器官的受量,增加肿瘤控制率,降低不良反应的发生。前列腺癌放疗的主要不良反应是泌尿生殖道和胃肠道的反应,也正因为这个原因限制了放疗剂量。研究表明,增加前列腺癌的放疗剂量可以得到更好的临床治疗效果[16-17]。应用质子治疗前列腺癌,可以给予肿瘤较高的剂量,并且可以增加对不良反应的耐受[16]。
前列腺癌的质子治疗通常采用两个平行对穿野,许多研究已证实非平行对穿野质子治疗前列腺的可行性。Trofimov等[18]和Tang等[19]研究表明,相比两平行对穿野,前斜野可以降低直肠的剂量;Cuaron等[20]临床研究结果表明,利用前斜野进行前列腺癌质子治疗具有良好的剂量可行性及可接受的较低的放疗不良反应。但不管是哪种布野方式,与质子两野IMPT计划相比,光子RapidArc计划360°旋转照射明显扩大了正常组织和器官低剂量区的照射范围,从而增加了二次肿瘤的发生率;而质子治疗可以使二次肿瘤的发生风险降低约50%[21]。从本研究中线剂量曲线可以看出,两平行野对穿的IMPT计划,避开了直肠和膀胱的照射,且在前后(AP)方向体现了更加陡峭的剂量梯度,降低了直肠和膀胱的受量;在左右(LR)方向即射野入射方向上,IMPT计划在一定距离内的剂量要高于RapidArc,这是由于质子的物理性质所决定的,其入射剂量约为峰值剂量的1/3,但随着深度的增加,其剂量梯度迅速增大,更好地保护了肿瘤后缘的正常组织。
与光子放疗相比,质子放疗虽然可以更好地保护正常组织和器官,提供更好的剂量分布,但质子放疗中存在更多的不确定性,尤其是对于剂量梯度变化较大的IMPT。质子的不确定性主要源于射程的不确定性、摆位误差及解剖结构的变化等,这些不确定性会对质子的穿透及布拉格峰的位置产生影响,使其发生潜在的偏移,对临床结果产生严重的影响,因此,控制和补偿质子的不确定性带来的剂量偏差非常重要。对于光子计划,通常使用PTV来补偿摆位误差,然而,对于IMPT计划,PTV有明显的限制和不足[22-23]。鲁棒性优化方法可以在IMPT计划优化时同时考虑射程不确定性和摆位误差引起的剂量扰动,弥补基于PTV计划的不足,提高计划的质量[24]。本研究主要是基于PTV进行计划设计,比较质子和光子用于前列癌放疗的剂量学差异及特点,并没有利用鲁棒性优化来考虑质子治疗过程中的不确定性。此外,前列腺癌质子计划射野优化方式的选择也相当重要,单野优化(single field optimization,SFO)可以使每个射野对束斑进行独立的优化,从而得到更加均匀的射野剂量分布;而MFO可以充分利用PBS技术形成高调制强度的剂量分布,更好的保护OARs,但会使得每个射野内的剂量高度不均匀,靶内外的梯度偏差较大,因此,与SFO相比,MFO计划对摆位和射程不确定性的敏感性更高[25]。
另外,通过利用MC算法对PB-IMPT计划进行二次剂量计算发现,除了MC-IMPT计划靶区D1%和HI有稍明显的升高外,两者在危及器官的受量上差异很小。从PB算法是质子治疗计划系统用于计算剂量分布的常用算法,它可以提供快速的优化及剂量计算,提高了计划的效率;MC算法能够基于截面数据的随机采样,追踪单个粒子的相互作用,从而能够提供更加精确的剂量计算[26]。Taylor等[27]研究发现,MC可以在高度不均匀组织如肺部中得到精确的治疗计划;Francesco等[28]利用乳腺癌质子治疗计划对PB和MC算法进行了评估,研究结果发现,PB算法无法得到足够的剂量精度,尤其是在较大的空气间隔(Air Gap,AP)情况下,而MC算法在所有测试条件下都可以得到更高的精度;Widesott等[29]在脑部肿瘤PBS质子治疗的研究结果发现,PB算法高估了靶区剂量,低估了危及器官受量,并且建议在使用射程移位器(range shifter,RS)、存在较大AP以及射野方向相切于患者体表时,需采用MC算法进行评估。但从本研究结果可以看出,不管是在剂量分布还是在DVH上,两者在前列腺癌的剂量计算中并没有体现出太明显的差别,PB和MC算法均可以用于前列癌患者质子治疗计划的剂量计算。
质子IMPT和光子RapidArc计划均能得到很好的覆盖,满足临床治疗的要求,但相比RapidArc计划,IMPT计划明显地降低了危及器官的受量,更好地保护了直肠、膀胱和股骨头等周围的正常组织,提高了计划的质量,体现出明显的剂量学优势。由于本研究进行鲁棒性和射野优化方法的比较,后续还要对前列腺癌的鲁棒性优化、临床疗效及不良反应等进行研究,以确定考虑质子不确定性对计划、患者生活质量的影响,为前列腺癌的临床治疗提供更好的参考。
利益冲突 无
作者贡献声明 杨涛负责计划设计,对结果进行处理和统计分析,撰写论文;徐寿平、解传滨负责设计实验, 指导论文的撰写和修改;龚璇、徐伟、王子申、方春锋负责数据收集;曲宝林、曹林负责指导监督实验进行
| [1] |
Bedford JL. Treatment planning for volumetric modulated arc therapy[J]. Med Phys, 2009, 36(11): 5128-5138. DOI:10.1118/1.3240488 |
| [2] |
杨涛, 徐伟, 徐寿平, 等. 两套TPS之间VMAT计划优化质量评价研究[J]. 中华放射肿瘤学杂志, 2017, 26(10): 1192-1198. Yang T, Xu W, Xu SP, et al. Evaluation of plan quality between two treatment planning systems for volumetric modulated arc therapy[J]. Chin J Radiat Oncol, 2017, 26(10): 1192-1198. DOI:10.3760/cma.j.issn.1004-4221.2017.10.018 |
| [3] |
Tang G, Earl MA, Luan S, et al. Comparing radiation treatments using intensity-modulated beams, multiple arcs, and single arcs[J]. Int J Radiat Oncol Biol Phys, 2010, 76(5): 1554-1562. DOI:10.1016/j.ijrobp.2009.04.003 |
| [4] |
Verbakel WF, Cuijpers JP, Hoffmans D, et al. Volumetric intensity-modulated arc therapy vs. conventional IMRT in head-and-neck cancer:a comparative planning and dosimetric study[J]. Int J Radiat Oncol Biol Phys, 2009, 74(1): 252-259. DOI:10.1016/j.ijrobp.2008.12.033 |
| [5] |
Chera BS, Vargas C, Morris CG, et al. Dosimetric study of pelvic proton radiotherapy for high-risk prostate cancer[J]. Int J Radiat Oncol Biol Phys, 2009, 75(4): 994-1002. DOI:10.1016/j.ijrobp.2009.01.044 |
| [6] |
Vargas C, Fryer A, Mahajan C, et al. Dose-volume comparison of proton therapy and intensity-modulated radiotherapy for prostate cancer[J]. Int J Radiat Oncol Biol Phys, 2008, 70(3): 744-751. DOI:10.1016/j.ijrobp.2007.07.2335 |
| [7] |
Pijls-Johannesma M. Proton and charged particle radiotherapy[J]. Int J Radiat Oncol Biol Phys, 2008, 71(1): 314. DOI:10.1016/j.ijrobp.2007.12.050 |
| [8] |
Jäkel O, Karger CP, Debus J. The future of heavy ion radiotherapy[J]. Med Phys, 2008, 35(12): 5653-5663. DOI:10.1118/1.3002307 |
| [9] |
Hara I, Murakami M, Kagawa K, et al. Experience with conformal proton therapy for early prostate cancer[J]. Am J Clin Oncol, 2004, 27(4): 323-327. DOI:10.1097/01.coc.0000071942.08826.cf |
| [10] |
Rana S, Cheng C, Zheng Y, et al. Proton therapy vs. VMAT for prostate cancer:a treatment planning study[J]. Int J Particle Ther, 2014, 1(1): 22-33. DOI:10.14338/IJPT.13-00003.1 |
| [11] |
Rana S, Cheng C, Zheng Y, et al. Dosimetric study of uniform scanning proton therapy planning for prostate cancer patients with a metal hip prosthesis, and comparison with volumetric-modulated arc therapy[J]. J Appl Clin Med Phys, 2014, 15(3): 4611. DOI:10.1120/jacmp.v15i3.4611 |
| [12] |
Trofimov A, Nguyen PL, Coen JJ, et al. Radiotherapy treatment of early-stage prostate cancer with IMRT and protons:a treatment planning comparison[J]. Int J Radiat Oncol Biol Phys, 2007, 69(2): 444-453. DOI:10.1016/j.ijrobp.2007.03.018 |
| [13] |
Rana S, Cheng C, Zhao L, et al. Dosimetric and radiobiological impact of intensity modulated proton therapy and RapidArc planning for high-risk prostate cancer with seminal vesicles[J]. J Med Radiat Sci, 2017, 64(1): 18-24. DOI:10.1002/jmrs.175 |
| [14] |
Whitaker TJ, Routman DM, Schultz H, et al. IMPT versus VMAT for pelvic nodal irradiation in prostate cancer:a dosimetric comparison[J]. Inter J Particle Ther, 2019, 5(3): 11-23. DOI:10.14338/IJPT-18-00048.1 |
| [15] |
Georg D, Hopfgartner J, GoRa J, et al. Dosimetric considerations to determine the optimal technique for localized prostate cancer among external photon, proton, or carbon-ion therapy and high-dose-rate or low-dose-rate brachytherapy[J]. Int J Radiat Oncol Biol Phys, 2014, 88(3): 715-722. DOI:10.1016/j.ijrobp.2013.11.241 |
| [16] |
Nihei K, Ogino T, Ishikura S, et al. Phase Ⅱ feasibility study of high-dose radiotherapy for prostate cancer using proton boost therapy:first clinical trial of proton beam therapy for prostate cancer in Japan[J]. Jpn J Clin Oncol, 2005, 35(12): 745-752. DOI:10.1093/jjco/hyi193 |
| [17] |
Zietman AL, DeSilvio ML, Slater JD, et al. Comparison of conventional-dose vs. high-dose conformal radiation therapy in clinically localized adenocarcinoma of the prostate:a randomized controlled trial[J]. JAMA, 2005, 294(10): 1233-1239. DOI:10.1001/jama.294.10.1233 |
| [18] |
Trofimov A, Nguyen PL, Coen JJ, et al. Radiotherapy treatment of early-stage prostate cancer with IMRT and protons:a treatment planning comparison[J]. Int J Radiat Oncol Biol Phys, 2007, 69(2): 444-453. DOI:10.1016/j.ijrobp.2007.03.018 |
| [19] |
Tang S, Both S, Bentefour H, et al. Improvement of prostate treatment by anterior proton fields[J]. Int J Radiat Oncol Biol Phys, 2012, 83(1): 408-418. DOI:10.1016/j.ijrobp.2011.06.1974 |
| [20] |
Cuaron JJ, Harris AA, Chon B, et al. Anterior-oriented proton beams for prostate cancer:a multi-institutional experience[J]. Acta Oncol, 2015, 54(6): 868-874. DOI:10.3109/0284186X.2014.986288 |
| [21] |
Schneider U, Lomax A, Pemler P, et al. The impact of IMRT and proton radiotherapy on secondary cancer incidence[J]. Strahlenther Onkol, 2006, 182(11): 647-652. DOI:10.1007/s00066-006-1534-8 |
| [22] |
Lomax AJ. Intensity modulated proton therapy and its sensitivity to treatment uncertainties 1:the potential effects of calculational uncertainties[J]. Phys Med Biol, 2008, 53(4): 1027-1042. DOI:10.1088/0031-9155/53/4/014 |
| [23] |
Unkelbach J, Chan TC, Bortfeld T. Accounting for range uncertainties in the optimization of intensity modulated proton therapy[J]. Phys Med Biol, 2007, 52(10): 2755-2773. DOI:10.1088/0031-9155/52/10/009 |
| [24] |
Albertini F, Hug EB, Lomax AJ. Is it necessary to plan with safety margins for actively scanned proton therapy?[J]. Phys Med Biol, 2011, 56(14): 4399-4413. DOI:10.1088/0031-9155/56/14/011 |
| [25] |
Lomax AJ, Boehringer T, Coray A, et al. Intensity modulated proton therapy:a clinical example[J]. Med Phys, 2001, 28(3): 317-324. DOI:10.1118/1.1350587 |
| [26] |
Paganetti H. Monte Carlo simulations will change the way we treat patients with proton beams today[J]. Br J Radiol, 2014, 87(1040): 20140293. DOI:10.1259/bjr.20140293 |
| [27] |
Taylor PA, Kry SF, Followill DS. Pencil beam algorithms are unsuitable for proton dose calculations in lung[J]. Int J Radiat Oncol Biol Phys, 2017, 99(3): 750-756. DOI:10.1016/j.ijrobp.2017.06.003 |
| [28] |
Francesco T, Francesco F, Stefano L, et al. Impact of dose engine algorithm in pencil beam scanning proton therapy for breast cancer[J]. Phys Med, 2018, 50(4): 7-12. DOI:10.1016/j.ejmp.2018.05.018 |
| [29] |
Widesott L, Lorentini S, Fracchiolla F, et al. Improvements in pencil beam scanning proton therapy dose calculation accuracy in brain tumor cases with a commercial Monte Carlo algorithm[J]. Phys Med Biol, 2018, 63(14): 145016. DOI:10.1088/1361-6560/aac279 |
 2020, Vol. 40
2020, Vol. 40


