鼻咽癌是我国南方最常见的恶性肿瘤之一,放射治疗是其最主要的治疗手段[1-2],由于鼻咽毗邻很多重要器官组织,因此放疗后不可避免地会出现口干、口腔黏膜炎、颈部放射性皮炎等各种并发症,其中口干最为常见,严重地影响了患者的生活质量[3-4]。目前临床上针对放射性口干并没有特效的治疗方法,较为常用的是氨磷汀和毛果芸香碱等,但由于各种不良反应限制了它们在临床上的应用[5]。近年来,很多研究表明,我国传统医学的中草药对放射性口干具有较好的防护作用,而且不良反应小,安全性高[6-7]。本课题组前期研究证明,肿节风在一定程度上对豚鼠腮腺早期辐射损伤有防护作用,并且可以在体外清除羟自由基[8-9]。本研究拟以SD大鼠为动物模型,采用不同浓度的肿节风处理经X射线照射腮腺后的大鼠,探讨其防护作用,为其在临床上的应用提供参考。
材料与方法1.仪器和主要试剂:肿节风由广西医科大学药理学实验室提供,酶联免疫吸附试验试剂盒(上海广锐生物科技有限公司),肿瘤坏死因子α(TNF-α)抗体为兔多克隆抗体(美国Abcam公司),二抗均为鼠/兔抗人单克隆抗体(上海长岛生物技术有限公司);蛋白酶K(原位细胞死亡检测试剂盒, POD, 上海罗氏制药有限公司);通用SP试剂盒、DAB显色剂(北京中杉金桥生物技术有限公司);医用电子直线加速器(Varian Clinac iX,美国瓦里安公司)。
2.实验动物分组与给药方案:SPF级SD雄性大鼠120只,体重150~180 g,由广西医科大学实验动物中心提供。动物饲养于符合医学实验动物环境设施要求的饲养环境中,通风良好,室温18~25℃,相对湿度40%~70%,12 h光照昼夜循环,实验动物生产许可证号为:SCXKG桂2014-0002,使用许可证:XYKG桂2014-0003。根据处理条件不同,将大鼠简单随机分为对照组、单纯照射组、低、中、高剂量肿节风加照射组(低、中、高剂量药物组),每组24只。药物组在照射前给予肿节风溶液灌胃1周,剂量参照中药药理学及人临床拟用剂量的换算按低(6.7 g·kg-1·d-1)、中(13.4 g·kg-1·d-1)、高(26.8 g·kg-1·d-1),相当人临床拟用剂量的10、20、40倍给予,对照组和单纯照射组给予等量的生理盐水,直至观察结束。
3.实验动物腮腺辐射损伤模型的建立:给予肿节风溶液灌胃1周后,将大鼠经2%戊巴比妥钠(0.16 ml/100 g)腹腔麻醉后仰卧于治疗床,在常规模拟定位机透视下确定涵盖腮腺区域的照射野并标记,大小为3 cm×4 cm;X射线从大鼠的腹面单前野垂直照射腮腺组织,源皮距为80 cm。单纯照射组和药物组均采用医用电子直线加速器给予15 Gy单次照射,每次6只,对照组不照射。
4.取材和标本处理:各组大鼠分别于10、40、70 d时,用2%戊巴比妥钠按0.16 ml/100 g腹腔麻醉后经腹主动脉取血,离心半径6 cm,4 000 r/min离心10 min取血清,-80℃冰箱保存。取部分腮腺以4%多聚甲醛固定、石蜡包埋、切片、脱蜡、水化,用于HE染色,光镜观察。另一部分腮腺组织切成1 mm3,用4℃的2%戊二醛固定30 min~2 h用于电镜观察腮腺组织的超微结构。
5.免疫组织化学检测:石蜡块4 μm厚连续切片,采用SP法,按照TNF-α试剂盒操作程序进行免疫组织化学染色。光镜下观察细胞质中出现棕红色或棕黄色染色者为阳性。在×400倍视野下,应用图像分析软件Image-Pro Plus 6.0计算视野内阳性细胞的平均吸光度(A)值。
6.血清活性氧簇(ROS)的测定:按照大鼠活性氧酶联免疫吸附试验试剂盒说明书的步骤进行操作,用酶标仪在450 nm波长依序测量各孔吸光度(A)值。最后用Curve Expert 1.3软件计算出各样品的实际浓度。
7.大鼠腮腺细胞形态学检测:按照常规方法进行苏木精-伊红(HE)染色,在×400倍视野下观察大鼠腮腺细胞形态学变化。电镜标本常规处理后用1%四氧化锇缓冲固定液中固定2 h,乙醇对样品进行梯度脱水,用丙酮置换乙醇3次,每次5 min;然后进行环氧树脂渗透和包埋,做成50 nm超薄组织切片载于铜网上,在透射电镜下观察腮腺细胞超微结构变化。
8.大鼠腮腺细胞凋亡检测:石蜡切片脱蜡、水化处理。加蛋白酶K20 μg/ml溶液,37℃下消化25 min。磷酸盐缓冲液(PBS)洗3次,每次5 min,将样本放入湿盒,加入TUNEL反应混合物50 μl,阴性对照用50 μl标记缓冲液代替TUNEL反应混合物,置于暗处,在37℃条件下孵育60 min。PBS洗3次,每次5 min。37℃条件下将样本放入湿盒,加入Anti-Fluorescein-POD conjugate,放置30 min。PBS洗3次,每次5 min。加入DAB液显色,在光镜下观察并控制显色(5~20 min)。自来水冲洗5 min。苏木素复染5 min,再次用水冲洗。梯度乙醇溶液常规脱水,二甲苯脱蜡,中性树胶封片,光镜下观察。在×400倍视野下,胞核为棕黄色的细胞为TUNEL阳性细胞,应用图像分析软件Image-Pro Plus 6.0计算视野内阳性细胞的平均吸光度(A)值。
9.统计学处理:采用SPSS 20.0软件进行数据分析。两组数据符合正态分布采用独立样本t检验,计量资料用
1.大鼠腮腺组织中TNF-α表达的改变:经X射线照射后,与对照组相比,单纯照射组TNF-α的表达明显升高,差异有统计学意义(t=-13.563、43.519、-15.249,P<0.05);与单纯照射组相比,照后10 d中、高剂量的肿节风均可降低TNF-α的上调,差异有统计学意义(t=7.525、11.445,P<0.05),照后40 d,各剂量肿节风的添加均可降低TNF-α的上调,差异有统计学意义(t=4.796、9.296、37.487,P<0.05);照后70 d,中、高剂量的肿节风可降低TNF-α的上调,差异有统计学意义(t=6.120、12.748,P<0.05)。且3个时间段的高剂量药物组较低剂量药物组效果明显,差异有统计学意义(t=10.093、-7.868、10.539,P<0.05,表 1,图 1)。
|
|
表 1 照射后不同时间各组大鼠腮腺组织中TNF-α蛋白表达水平的比较( |
|
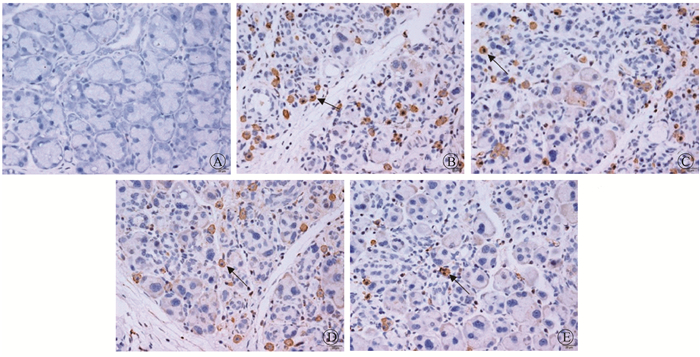
注:箭头指示为阳性细胞 图 1 照射后10 d大鼠腮腺组织中TNF-α蛋白表达情况IHC染色× 400 A.对照组;B.单纯照射组;C.低剂量药物组;D.中剂量药物组;E.高剂量药物组 Figure 1 The expression of TNF-α in the parotid gland tissues of rats at 10 day after the irradiation IHC staining ×400 A. Control group; B. Single irradiation group; C. Low dose of Sarcandra glabra group; D. Moderate dose of Sarcandra glabra group; E. High dose of Sarcandra glabra group |
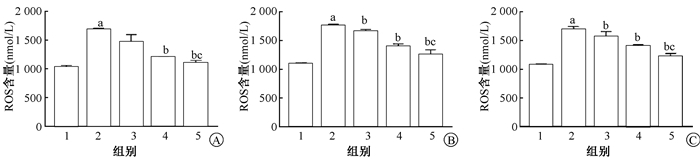
2.大鼠腮腺组织中ROS含量的变化:与对照组相比,单纯照射组ROS的含量迅速增加,差异有统计学意义(t=-24.723、-35.013、-19.515,P<0.05);与单纯照射组相比,照后10 d中、高剂量药物组ROS的含量有所降低,差异有统计学意义(t=25.022、17.829,P<0.05),照后40 d,药物组ROS的含量均有所降低,差异有统计学意义(t=3.733、12.910、10.550,P<0.05),照后70 d,药物组ROS的含量均有所降低,差异有统计学意义(t=2.298、8.799、11.185,P<0.05)。且3个时间点的高剂量药物组较低剂量药物组效果明显,差异有统计学意义(t=5.295、8.138、6.545,P<0.05,图 2)。
|
注:1.空白组;2.单纯照射组;3.低剂量6.7 g ·kg-1 ·d-1药物组;4.中剂量13.4 g ·kg-1 ·d-1药物组;5.高剂量26.8 g ·kg-1 ·d-1药物组。a与对照组相比,t=-24.723、-35.013、-19.515,P<0.05;b与单纯照射组相比,t=25.022、17.829、3.733、12.910、10.550、2.298、8.799、11.185,P<0.05;c与6.7 g·kg-1·d-1药物组相比,t=5.295、8.138、6.545,P<0.05 图 2 不同剂量肿节风对辐射诱导后不同时间大鼠腮腺组织中ROS水平的影响A.10 d; B.40 d; C.70 d Figure 2 Influence of different dosages of Sarcandra Glabra on ROS levels in rat parotid gland at diffient time after irradiation A.10 d; B.40 d; C.70 d |
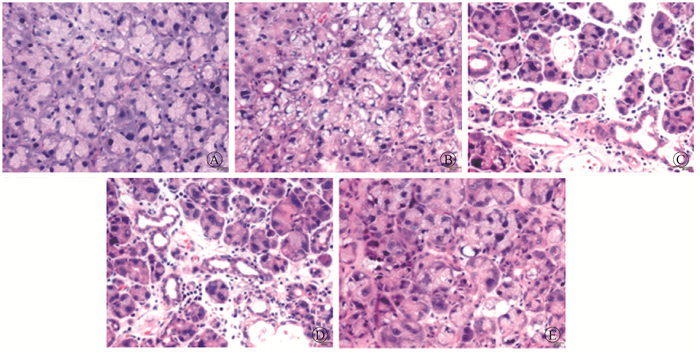
3.大鼠腮腺组织结果改变:在光镜下观察到各时段对照组腮腺细胞呈圆形,大小一致,胞质饱满,核染色质清晰,界限清楚;导管细胞呈单层排列,排列规则。单纯照射组腮腺细胞萎缩,核固缩,空泡形成,腺泡间质纤维化,大量炎性细胞浸润,以淋巴细胞为主;导管细胞排列紊乱,大小不一。各药物组腮腺细胞病理改变与单纯照射组相似,但程度较之减轻。低、中剂量药物组的细胞损坏程度介于单纯照射组和高剂量药物组之间(图 3)。
|
图 3 照射后70 d大鼠腮腺细胞组织病理学改变HE染色×400 A.对照组;B.单纯照射组;C.低剂量药物组;D.中剂量药物组;E.高剂量药物组 Figure 3 Histopathological changes of parotid gland tissues of rats at 70 d after irradiation HE staining ×400 A. Control group; B. Single irradiation group; C. Low dosage of Sarcandra glabra group; D. Moderate dosage of Sarcandra glabra group; E. High dosage of Sarcandra glabra group |
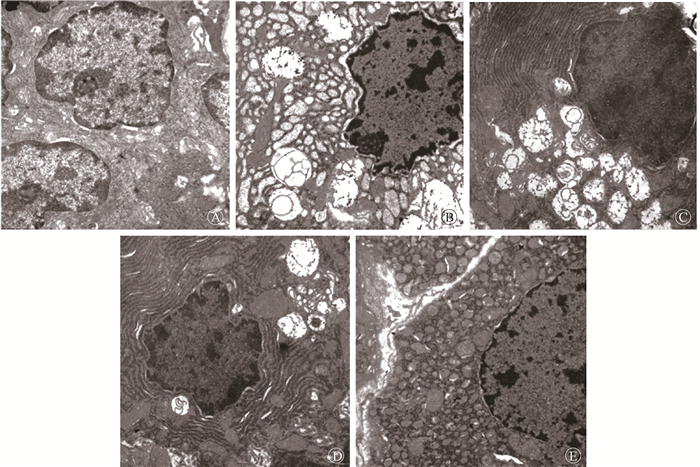
4.大鼠腮腺超微结构变化:各时间段对照组腮腺细胞的超微结构中均可见胞质内有圆形致密的分泌颗粒,少量透明溶酶体,线粒体、高尔基体和内质网等细胞器结构正常。细胞核染色质均匀,无团块,核膜厚度正常,核仁明显。单纯照射组细胞中只有极少量的分泌颗粒,大量溶酶体出现,粗面内质网结构被破坏,呈不规则排列。细胞核中的染色质固缩分散在核膜上,呈致密大团块状,且细胞核形状极不规则,核仁被挤到核膜边缘。高剂量药物组腮腺细胞中分泌颗粒明显高于单纯照射组,但数量未达到正常水平,有极少量溶酶体;细胞核中的染色质均匀分散在核膜上,细胞核基本呈圆形;线粒体基本正常。低、中剂量药物组的细胞损坏程度介于单纯照射组和高剂量药物组之间(图 4)。
|
图 4 肿节风对照射后70 d大鼠腮腺细胞超微结构的影响TEM ×20 000 A.对照组;B.单纯照射组;C.低剂量药物组;D.中剂量药物组;E.高剂量药物组 Figure 4 Influence of Sarcandra Glabra on the ultrastructure of rat parotid gland tissues at 70 d after irradiation TEM ×20 000 A. Control group; B. Single irradiation group; C. Low dosage of Sarcandra glabra group; D. Moderate dosage of Sarcandra glabra group; E. High dosage of Sarcandra glabra group |
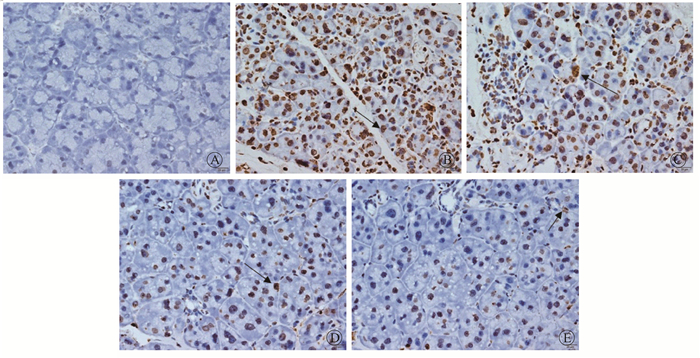
5.大鼠腮腺细胞凋亡的变化:结果示于图 5和表 2。在照射后10 d和40 d时,TUNEL染色结果显示辐射后大鼠腮腺中凋亡的阳性细胞的平均吸光度(A)明显较对照组增加,差异有统计学意义(t=-4.639、-3.979,P<0.05)。而10 d组中加用高剂量肿节风干预组的阳性细胞平均吸光度(A)明显减少,差异有统计学意义(t=3.176,P<0.05);且40 d组中高剂量较低剂量肿节风效果更明显,差异有统计学意义(t=4.553,P<0.05)。
|
注:箭头指示为阳性细胞 图 5 肿节风对照射后10 d大鼠腮腺组织细胞凋亡的影响TUNEL × 400 A.对照组;B.单纯照射组;C.低剂量药物组;D.中剂量药物组;E.高剂量药物组 Figure 5 Influence of Sarcandra Glabra on the apoptosis induction of rat parotid gland cells at 10 d after irradiation TUNEL ×400 A. Control group; B. Single irradiation group; C. Low dose of Sarcandra glabra group; D. Moderate dose of Sarcandra glabra group; E. High dose of Sarcandra glabra group |
|
|
表 2 照射后不同时间各组大鼠腮腺组织细胞凋亡水平的比较( |
讨论
近年来使用生长因子、谷氨酰胺、锌剂等药物防止放射性口咽黏膜炎成为该领域研究热点,而最佳药物仍存在争议[10]。研究发现,粒细胞-巨噬细胞集落刺激因子可促进损伤口腔黏膜修复,对放射性口咽黏膜炎有一定的防治效果[11]。但也有研究得出粒细胞-巨噬细胞集落刺激因子不能改善患者黏膜改变程度、疼痛和患者放疗期间的生存质量[12],提示粒细胞-巨噬细胞集落刺激因子的作用仍存在争议。有小样本研究提示补充谷氨酰胺可能对接受放疗头颈部肿瘤患者发生放射性口咽黏膜炎具有防治作用,但西班牙研究显示口服谷氨酰胺并不能降低接受放疗或化疗头颈部肿瘤患者第6周口咽黏膜炎的发生率和严重程度[13]。两项来自日本的临床研究支持聚普瑞锌可明显降低头颈部肿瘤接受放疗时放射性口咽黏膜炎的发生率,且可缩短持续时间[14-15]。但一项入组144例头颈部肿瘤患者的随机、双盲、安慰剂对照试验中发现,补充锌剂并不能减少放射性口咽黏膜炎的发生[16]。故目前临床上仍没有防治放射性口咽黏膜炎的金标准。
很多研究表明,祖国传统医学的中草药对放射性口干具有较好的防护作用[6-7],肿节风为金粟兰科植物草珊瑚的干燥全株,又名九节茶,其应用广泛,在动物体内吸收快、药效长,生物利用度高,无明显的不良反应,其成分比较复杂,主要含有黄酮、异嗦皮咤、反丁烯二酸等,其中黄酮类化合物对自由基有清除作用,有抑制肿瘤、改善免疫功能、抑制非感染引起的炎症等作用,在临床上主要用于抗炎和抗肿瘤治疗[17]。由此可见,肿节风在临床上有一定的应用价值,但对于其在辐射损伤中的保护作用还需进一步研究。
大量研究表明,X射线产生的过量ROS的积累可以损伤细胞线粒体膜,导致细胞线粒体膜电位降低[18-19],继而导致线粒体膜通透性增加,激活线粒体细胞凋亡途径,诱导细胞凋亡[19]。同时引起氧化应激,激活炎症反应,诱发炎症细胞因子产生[20]。邹佳华等[21]发现X射线首先引起大量ROS产生,进而诱发炎症因子TNF-α的表达;而且在添加活性氧抑制剂N-乙酰半胱氨酸(NAC)后,ROS明显受到抑制,继而引起TNF-α下降, 提示在X射线照射中ROS与TNF-α两者密不可分。
本研究通过建立肿节风的大鼠辐射模型,旨在研究肿节风对辐射损伤的防护作用,采用酶联免疫吸附实验可以很灵敏地检测出微量的ROS含量变化,肿节风干预后ROS含量明显下降,且高剂量的肿节风对ROS的清除作用较强。提示该药可能是通过清除电离辐射所产生的ROS起到抗氧化并保护腮腺细胞的作用。同时采用腮腺组织切片HE染色、TUNEL染色、免疫组织化学染色等形态学方法观察,结果显示,经X射线照射后,腮腺细胞中大量透明溶酶体出现,内质网被破坏,细胞核中的染色质固缩分散在核膜上,细胞核形状极不规则,核仁被挤到核膜边缘。此外,线粒体肿胀,通透性增加,腮腺细胞凋亡率明显增加,TNF-α表达水平升高,而使用肿节风干预后表现出类似活性氧清除剂的作用,肿节风可改善腮腺细胞线粒体肿胀,降低通透性,减少细胞凋亡,引起TNF-α下降,使细胞损坏现象得到了明显的抑制,且与药物的剂量大小有关。
综上,本研究结果表明肿节风有一定的辐射防护作用,且与药物的剂量大小有关,其机制可能是肿节风通过清除由辐射引起的ROS,减轻由ROS导致的细胞超微结构的破坏和进一步的炎症反应,同时抑制腮腺细胞过度凋亡,从而达到保护腮腺的作用,因此本研究为将来肿节风的产业化研发提供了坚实的理论基础,肿节风也有望成为临床上治疗放射性口干的重要手段。
志谢 感谢广西医科大学青年科学基金项目(XMUYSF016)和广西高校中青年教师科研基础能力提升项目(018Y013、019Y015)对本研究的资助
利益冲突 全体作者无学术纷争,所写内容均中立客观,不存在任何利益冲突
作者贡献声明 么一丹负责实验和数据分析,并撰写论文;张婷婷协助完成实验;胡凯参与研究设计,提出修改意见;王仁生负责研究设计和论文审核
| [1] |
Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. DOI:10.3322/caac.21492 |
| [2] |
Chen YP, Chan A, Le QT, et al. Nasopharyngeal carcinoma[J]. Lancet, 2019, 394(10192): 64-80. DOI:10.1016/S0140-6736(19)30956-0 |
| [3] |
Wu H, Chen X, Yang X, et al. Early prediction of acute xerostomia during radiation therapy for head and neck cancer based on texture analysis of daily CT[J]. Int J Radiat Oncol Biol Phys, 2018, 102(4): 1308-1318. DOI:10.1016/j.ijrobp.2018.04.059 |
| [4] |
Jiang N, Zhao Y, Jansson H, et al. Experiences of xerostomia after radiotherapy in patients with head and neck cancer:a qualitative study[J]. J Clin Nurs, 2018, 27(1-2): 100-108. DOI:10.1111/jocn.13879 |
| [5] |
韩鹏炳, 冀雪娟, 高力英, 等. 氨磷汀对鼻咽癌放射治疗中唾液腺功能的保护作用[J]. 中国辐射卫生, 2019, 28(1): 98-101. Han PB, Ji XJ, Gao LY, et al. Protective effect of amifostine on salivary gland function in radiotherapy of nasopharyngeal carcinoma[J]. Chin J Radiol Health, 2019, 28(1): 98-101. DOI:10.13491/j.issn.1004-714x.2019.01.027 |
| [6] |
刘杨, 马婕, 杨云莉, 等. 鼻咽癌放射性口干症与腮腺受照射体积相关性研究[J]. 中华放射肿瘤学杂志, 2018, 27(3): 235-239. Liu Y, Ma J, Yang YL, et al. Relationship between radiation-induced xerostomia and the volume of parotid glands exposed in radiotherapy for nasopharyngeal carcinoma[J]. Chin J Radiol Oncol, 2018, 27(3): 235-239. DOI:10.3760/cma.j.issn.1004-4221.2018.03.002 |
| [7] |
谭潇, 刘屏, 郭代红. 放疗用抗辐射药研究进展[J]. 国际药学研究杂志, 2016, 43(5): 870-875. Tan X, Liu P, Guo DH. Anti-radiation drugs for radiotherapy:research advances[J]. J Int Pharm Res, 2016, 43(5): 870-875. DOI:10.13220/j.cnki.jipr.2016.05.012 |
| [8] |
秦俭, 滕家安, 王仁生, 等. 肿节风浸膏对腮腺早期放射损伤作用的实验研究[J]. 中国辐射卫生, 2008, 17(3): 269-271. Qin J, Teng JA, Wang RS, et al. Experiment of radioprotective early radiation damage of Sarcandra Glabra on salivary gland:Observe the tissue morphology following fractionated radiation on head-neck region in Guinea-pig models[J]. Chin J Radiol Health, 2008, 17(3): 269-271. DOI:10.3969/j.issn.1004-714X.2008.03.006 |
| [9] |
Moslemi D, Nokhandani AM, Otaghsaraei MT, et al. Management of chemo/radiation-induced oral mucositis in patients with head and neck cancer:A review of the current literature[J]. Radiother Oncol, 2016, 120(1): 13-20. DOI:10.1016/j.radonc.2016.04.001 |
| [10] |
Jasper J, Roithmann S, Camilotti RS, et al. Effect of G-CSF on oral mucositis and traumatic ulcers produced in the tongue of rats undergoing radiotherapy:clinical and histologic evaluation[J]. Oral Surg Oral Med Oral Pathol Oral Radiol, 2016, 122(5): 587-596. DOI:10.1016/j.oooo.2016.07.021 |
| [11] |
Hoffman KE, Pugh SL, James JL, et al. The impact of concurrent granulocyte-macrophage colony-stimulating factor on quality of life in head and neck cancer patients:results of the randomized, placebo-controlled Radiation Therapy Oncology Group 9901 trial[J]. Qual Life Res, 2014, 23(6): 1841-1858. DOI:10.1007/s11136-014-0628-5 |
| [12] |
Lopez-Vaquero D, Gutierrez-Bayard L, Rodriguez-Ruiz JA, et al. Double-blind randomized study of oral glutamine on the management of radio/chemotherapy-induced mucositis and dermatitis in head and neck cancer[J]. Mol Clin Oncol, 2017, 6(6): 931-936. DOI:10.3892/mco.2017.1238 |
| [13] |
Suzuki A, Kobayashi R, Shakui T, et al. Effect of polaprezinc on oral mucositis, irradiation period, and time to discharge in patients with head and neck cancer[J]. Head Neck, 2016, 38(9): 1387-1392. DOI:10.1002/hed.24446 |
| [14] |
Doi H, Fujiwara M, Suzuki H, et al. Polaprezinc reduces the severity of radiation-induced mucositis in head and neck cancer patients[J]. Mol Clin Oncol, 2015, 3(2): 381-386. DOI:10.3892/mco.2014.479 |
| [15] |
Sangthawan D, Phungrassami T, Sinkitjarurnchai W. A randomized double-blind, placebo-controlled trial of zinc sulfate supplementation for alleviation of radiation-induced oral mucositis and pharyngitis in head and neck cancer patients[J]. J Med Assoc Thai, 2013, 96(1): 69-76. |
| [16] |
郭晓玲, 康丽霞, 任美芳, 等. 黄芪多糖对糖尿病肾病肾小管上皮细胞凋亡、转分化及ROS含量的影响研究[J]. 中国免疫学杂志, 2018, 34(3): 388-392. Guo XL, Kang LX, Ren MF, et al. Effect of astragalus polysaccharides on apoptosis, transdifferentiation and ROS content in renal tubular epithelial cells of diabetic nephropathy[J]. Chin J Immun, 2018, 34(3): 388-392. DOI:10.3969/j.issn.1000-484X.2018.03.014 |
| [17] |
Xin LT, Yue SJ, Fan YC, et al. Cudrania tricuspidata:an updated review on ethnomedicine, phytochemistry and pharmacology[J]. RSC Adv, 2017, 7(51): 31807-31832. DOI:10.1039/C7RA04322H |
| [18] |
Chang Y, He L, Li Z, et al. Designing core-shell gold and selenium nanocomposites for cancer radiochemotherapy[J]. Acs Nano, 2017, 11(5): 4848-4858. DOI:10.1021/acsnano.7b01346 |
| [19] |
Shan F, Shao Z, Jiang S, et al. Erlotinib induces the human non-small-cell lung cancer cells apoptosis via activating ROS-dependent JNK pathways[J]. Cancer Med, 2016, 5(11): 3166-3175. DOI:10.1002/cam4.881 |
| [20] |
Zhang C, Wang J, Ma X, et al. ACE2-EPC-EXs protect ageing ECs against hypoxia/reoxygenation-induced injury through the miR-18a/Nox2/ROS pathway[J]. J Cell Mol Med, 2018, 22(3): 1873-1882. DOI:10.1111/jcmm.13471 |
| [21] |
邹佳华, 余昭胜, 邓光锐, 等. X射线照射后活性氧对巨噬细胞分泌肿瘤坏死因子-α和转化生长因子-β1的影响[J]. 安徽医药, 2018, 22(8): 1444-1448. Zhou JH, Yu ZS, Deng GR, et al. ROS-induced expression of TNF-α and TGF-β1 in the RAW264[J]. Anhui Med Pharm J, 2018, 22(8): 1444-1448. DOI:10.3969/j.issn.1009-6469.2018.08.004 |
 2020, Vol. 40
2020, Vol. 40


