宫颈癌是最常见的妇科肿瘤,治疗上多以放疗、手术为主的综合治疗,放射治疗在局部晚期宫颈癌综合治疗中占有极其重要的地位[1]。标准的宫颈癌放疗由盆腔外照射和腔内近距离治疗构成。在盆腔放疗期间,电离辐射诱导肠黏膜发生炎症反应[2],粪便的变化代表肠道炎症最早和最直接的表现。因此,粪便是研究急性放射性肠炎(radiation-induced acute intestinal symptoms, RIAIS)的理想生物介质。此外,粪便容易获得,并且相比其他体液或组织更简单,这些优势是使用患者粪便样本来研究RIAIS代谢组学的原因[3]。
放射性肠炎是宫颈癌最重要的放疗并发症,严重者可导致肠壁溃疡、穿孔甚至窦道形成等并发症。通过微生物分子生态学技术,可以全面了解患者放射治疗期间肠道菌群结构、分子代谢产物变化。代谢组学可以同时测量数千种代谢产物,并描述了疾病进展的整体和动态特征,已成功用于生物标志物发现、癌症的早期诊断、靶向治疗和治疗反应预测等[4-8]。代谢产物(尤其代谢标志物)的变化,可以在宫颈癌放射性肠炎发生的早期诊断中发挥重要作用。因此,本研究观察和比较宫颈癌放疗期间患者粪便中代谢产物的变化。
资料与方法1.入组标准:选取2017年9月至2018年6月在苏州大学附属第一医院放疗科接受根治性或术后放射治疗的ⅠB至Ⅳ期宫颈癌患者51例,其中1例患者因入组后不能按要求留存有效标本而剔除,共50例。满足以下条件:病理确诊为宫颈癌患者;既往无肠道疾病、代谢疾病病史;放疗开始前3 d自愿接受临床营养医师的标准化膳食指导。本研究已通过医院伦理委员会审批(2016伦理审批第100号),所有患者签署知情同意书。
2.盆腔外照射治疗方法
(1) 模具制作及模拟定位:50例患者于放疗准备前一晚服用缓泻剂清洁肠道和排气,空腹,采取仰卧位,体模固定。静脉增强造影,使用模拟定位机对每例患者进行扫描,扫描范围从L3至股骨中段,扫描层厚0.3 cm。扫描后将每例患者CT图像传至瑞典医科达MONACO系统中。
(2) 靶区勾画:按美国肿瘤放射治疗协作组织(RTOG)及日本临床肿瘤协作组织(JCOG)标准勾画宫颈癌盆腔外照射靶区及危及器官(OAR)。针对根治性盆腔外照射,靶区包括肿瘤靶区(GTV)(包括原发灶及盆腔阳性淋巴结)、宫颈、子宫、阴道(结合侵犯情况)、宫旁、盆腔淋巴引流区,并根据实际病情个体化勾画腹股沟淋巴引流区、腹主动脉旁淋巴引流区等。针对术后辅助盆腔外照射,需先按国际妇产科联盟(FIGO) 2018指南明确高危因素(Peters′ criteria)或中危因素(鳞癌:Sedlis′ criteria;腺癌:4因素模型),靶区包括盆腔淋巴引流区、阴道旁、阴道上部(结合侵犯情况),并根据实际病情个体化勾画盆腔残留阳性淋巴结、可疑淋巴管囊肿、镜下阳性的韧带残端等。OAR勾画包括直肠、膀胱、结肠、小肠、脊髓、双侧股骨头等。所有患者GTV、临床靶区(CTV)、OAR均由同一位放疗医师勾画并且由副主任医师以上医师审批通过。
(3) 处方剂量:针对根治性盆腔外照射,盆腔淋巴引流区(CTV1):45 Gy/25次,宫旁区域(CTV2):50 Gy/25次,阳性淋巴结(GTVnd):56 Gy/28次,若存在腹主动脉旁或腹股沟淋巴引流区进展,腹主动脉旁淋巴引流区(CTV3):40 Gy/20次,腹股沟淋巴引流区(CTV4):45 Gy/25次。针对术后辅助盆腔外照射,中危CTV1:45 Gy/25次,高危CTV1:50.4 Gy/28次,余靶区处方剂量可按根治性外照射方案执行,阴道残端阳性者需在外照射结束后执行后装放疗补量治疗。OAR的剂量限值:膀胱V40<50%,直肠V40<40%,结肠V40<30%,小肠V40<20%,股骨头V45<5%。
(4) 放疗计划制定及实行:将勾画好的放疗靶区经医生工作站传输至治疗计划系统(TPS),经物理师制定9野逆向旋转调强放疗计划,后经副主任级别及以上医生确认及进行计划验证,后行容积旋转调强放射治疗(VMAT)。放疗加速器采用瑞典医科达医用直线加速器(Elekta Synergy),治疗射线类型为6 MV X射线。
3.近距离放射治疗
(1) 模具制作及模拟定位:外照射放疗结束后共有13例患者(12例根治患者和1例阴道切缘距肿瘤边界<2 cm的术后辅助治疗患者)被评估为需接受宫颈癌后装治疗。本研究后装放疗采用CT引导的三维后装放射治疗技术。所有患者于后装放疗前一晚服用缓泻剂清洁肠道和排气,空腹,采取仰卧位,体模固定。非增强CT断层扫描,使用模拟定位机对每例患者进行扫描,扫描范围从L3至股骨中段,扫描层厚0.3 cm。扫描后将每例患者CT图像传至核通Oncentra系统中。
(2) 靶区勾画:根据欧洲放射治疗学与肿瘤学协会(GEC-ESTRO)勾画标准,对高风险临床靶区(HR-CTV)、膀胱、乙状结肠和直肠进行轮廓分析。直肠和乙状结肠下界在HR-CTV下方至少2 cm,上界至每个子宫上方2 cm处的勾画轮廓。
(3) 处方剂量:要求靶区D90≥90%处方剂量,同时要求膀胱D2 cm3(2 cm3体积受到的最小剂量)、直肠、乙状结肠D2 cm3<450 cGy。
(4) 放疗计划制定及实行:由同一位放疗医师利用荷兰Oncentra治疗计划系统逆向调强腔内治疗计划设计并进行优化,计划评估由一名物理师和一名放疗科副主任医师以上的主管医师协商一致。每位患者自外照射结束开始,每周行192Ir高剂量率后装治疗2次,累计共行4~6次后装治疗。
4.急性放射性肠炎反应的评估:在治疗期间每周监测所有患者的不良反应,急性放射性肠炎的严重程度根据不良事件的常用术语标准(NCI-CTCAE)进行分类。
5.粪便样本的收集
(1) 对照组样本收集:分别在20~35岁、36~60岁、61~70岁正常女性中收集粪便样本,各5份,作为对照组(FCK),分装至冻存管中,储存于液氮中。
(2) 病例组样本收集:在4个时间点收集患者的粪便样本:放射基线期(F0);放疗起2周(F2);放疗起4周(F4);放疗起6周(Ff)。采集完后分装至冻存管中,储存于液氮中。
(3) 匹配分组:分别在放疗期间4个时间点,与对照样本相比较,即F0 vs.FCK(A组),F2 vs.FCK(B组),F4 vs.FCK(C组),Ff vs.FCK(D组), 各50例。
6.粪便样本的代谢组学检测
(1) 试剂与材料:LC-MS级水(H2O)、乙腈(CAN)、甲醇(MeOH)、0.1%甲酸(FA)的水溶液、2-氯苯丙氨酸购于上海国药集团化学试剂有限公司。冷冻离心仪(H1650-W,长沙湘仪离心机仪器有限公司);混匀仪(QL-866,海门其林贝尔仪器制造有限公司);纯水仪(Arium mini,德国赛多利斯集团);真空浓缩仪(53050,德国艾本德股份公司);液相色谱仪(ACQUITY UPLC,美国沃特世科技有限公司);质谱仪(OrbitraP XL,美国赛默飞世尔科技公司)。
(2) 粪便上清样本的制备:取粪便100 mg于2 ml管中(样品量不足按照等比例缩减),加入500 μl双蒸(DD) H2O(4℃),充分混匀1 min,加入1 ml甲醇(-20℃),涡旋振荡30 s。放入超声波机,室温处理10 min,冰上放置30 min,再在14 000 r/min,离心半径90 mm, 4℃离心10 min。取上清液1 200 μl,转移到新的离心管中,样品用真空离心浓缩仪浓缩,最后用400 μl 2-氯苯丙氨酸(0.02‰)甲醇水溶液(1:1, 4℃)溶解样品,0.22 μm膜过滤,得到待测样本。
(3) 质谱平台的建立:收集同一观察对象粪便样本,分别制备成平行样本,进行精密度考察。采用苏州帕诺米克生物医药科技有限公司设备共享平台的ACQUITY UPLC液相色谱仪及LTQ OrbitraP XL质谱仪,摸索并优化液相色谱-质谱联用(LC/MS)分析条件,并进行方法学的考察,通过对比匹配度评价鉴定化合物种类,利用Proteowizard软件中偏最小二乘法-判别分析(PLS-DA)分析生物样本的代谢组学数据,并进行模式识别,采用响应置换检验法验证模型是否通过拟合验证。采用液相色谱-质谱联用仪软件系统,进行数据获取的质量控制。最终建立稳定的基于LC/MS的生物样本代谢组全谱分析平台。
(4) 色谱条件:使用ACQUITY UPLCⓇHSS T3 1.8 μm(2.1×150 mm)色谱柱,自动进样器温度设为4℃,以0.25 ml/min的流速,40℃柱温,进样5 μl进行梯度洗脱,流动相为0.1%甲酸水(A)- 0.1%甲酸乙腈(B)。梯度洗脱程序为0~1 min,2% B;1~9.5 min,2%~50% B;9.5~14 min,50%~98% B;14~15 min,98% B;15~15.5 min,98%~2% B;15.5~17 min,2% B。
(5) 质谱条件:仪器使用Thermo LTQ OrbitraP XL,电喷雾离子源(ESI),正负离子电离模式,正离子喷雾电压为4.80 kV,负离子喷雾电压为4.50 kV,鞘气45 arb(arbitrary unit,气体流量单位),辅助气15 arb。毛细管温度325℃,毛细管电压35 V/-15 V,管透镜电压50 V/-50 V,以分辨率60 000进行全扫描,扫描范围89~1 000(质荷比),并采用诱导碰撞解离方式(collision-induced dissociation, CID)进行二级裂解,碰撞电压为30 eV,同时采用动态排除(重复计数为2)去除无必要的MS/MS信息,动态排除时间设置为15 s。
7.统计学处理:通过无监督分析方法如主成分分析,得到的PCA模型反映了代谢组学数据的原始状态,有利于掌握宫颈癌患者放疗期间粪便代谢产物的整体情况并从整体上进行把握。用PLS-DA消除与病理状态无关的系统变异,帮助筛选负责类别分离的粪便中的差异代谢产物。正交-偏最小二乘判别分析(OPLS-DA)可以在不降低模型预测能力的前提下,有效减少模型的复杂性和增强模型的解释能力,从而最大程度查看放疗不同时间点差异代谢产物变化。代谢产物的基本筛选条件为P≤0.05,变量重要性投影(VIP)值≥1。考虑本研究涉及4个时间段代谢产物分析,采用一维方差分析进一步寻找差异代谢产物。P < 0.05为差异有统计学意义。
结果1.宫颈癌放疗患者的放射性肠炎概况:共纳入50例宫颈癌患者,其中12例接受了根治性放疗(盆腔外照射联合后装放疗),37例接受了术后辅助盆腔外照射治疗,另有1例术后患者因阴道切缘距肿瘤边界2 cm接受了盆腔外照射联合后装阴道补量放疗。目标患者年龄区间在30~79岁,中位年龄51岁。其中46例病理为鳞癌,2例为腺癌,2例为腺鳞癌。纳入患者的详细临床特征列于表 1。
|
|
表 1 50例宫颈癌放射治疗患者临床特征 Table 1 Clinial characteristics of 50 cervical cancer patients |
本研究中,42例患者出现0~1级放射性肠炎反应,8例患者发生2~3级放射性肠炎反应,无4级及以上放射性肠道不良反应发生。研究发现,接受同步化疗的患者急性放射性肠炎发生率高(χ2=13.882,P<0.05);而年龄、放疗方式(根治或者辅助放疗)等因素与急性放射性肠炎的发生无相关关系(P>0.05)。
2.粪便上清样本的代谢组学分析:共对50例宫颈癌患者进行粪便上清代谢产物变化的检测,分为A、B、C及D组,进行比较分析。共测得3 036个负离子模式和2 734个正离子模式代谢峰。
正交-偏最小二乘判别分析(orthogonal projections to latent structures discriminant analysis, OPLS-DA)。x和y轴分别为预测主成分得分,正交主成分得分。本研究使用第一主成分和第二正交成分构建OPLS-DA模型如图 1。在OPLS-DA评分图中,A、B、C、D 4组的模型均具有明显的分类效果。将P值≤0.05和VIP>1的粪便代谢产物视为潜在的差异代谢产物(表 2),并在随后的分析中进行研究。
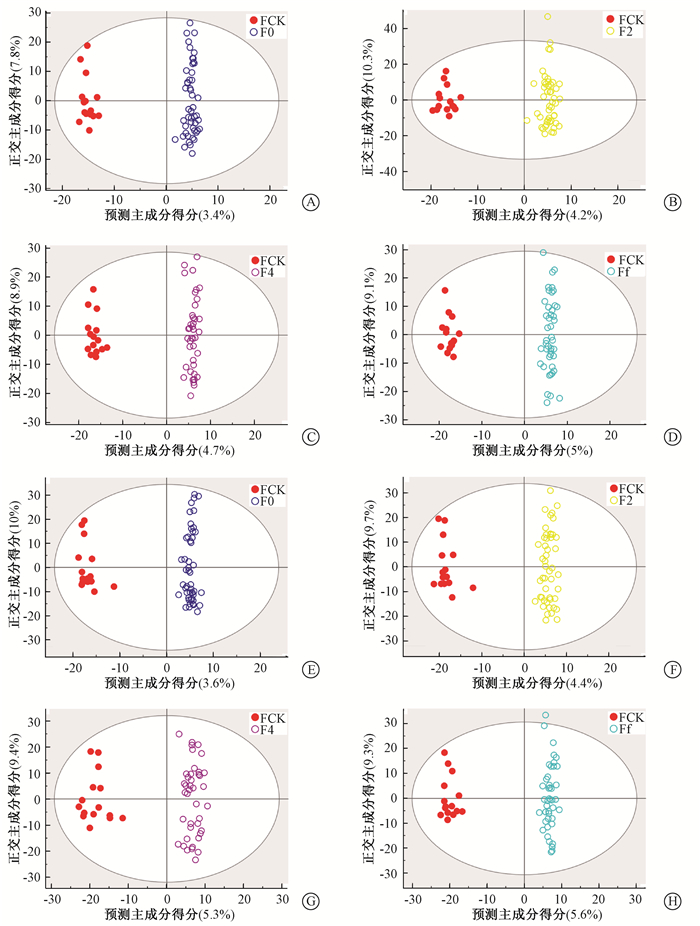
|
注:FCK.对照组;F0.放疗基线期;F2.放疗起2周;F4.放疗起4周;Ff.放疗起6周 图 1 放疗4个时间点的正交-偏最小二乘判别分析(OPLS-DA)得分图A~D.正离子模式;E~H.负离子模式 Figure 1 OPLS-DA score plots at 4 time points of radiotherapy A-D. Positive ion mode; E-H. Negative ion mode |
|
|
表 2 121个潜在差异代谢产物 Table 2 121 potential biomarkers |
3.差异代谢产物的相关性分析:通过计算所有代谢物两两之间的皮尔森相关系数来分析各个代谢物间的相关性。利用R(v3.1.3)中的cor.test()函数对121种代谢物关联分析进行统计检验,P < 0.05则有显著相关性。本研究将筛选出的相互关联且关联系数大于0.5的代谢物绘制代谢物关联热图(图 2)。从图 2可见,各个代谢物之间具有明显的相关性。
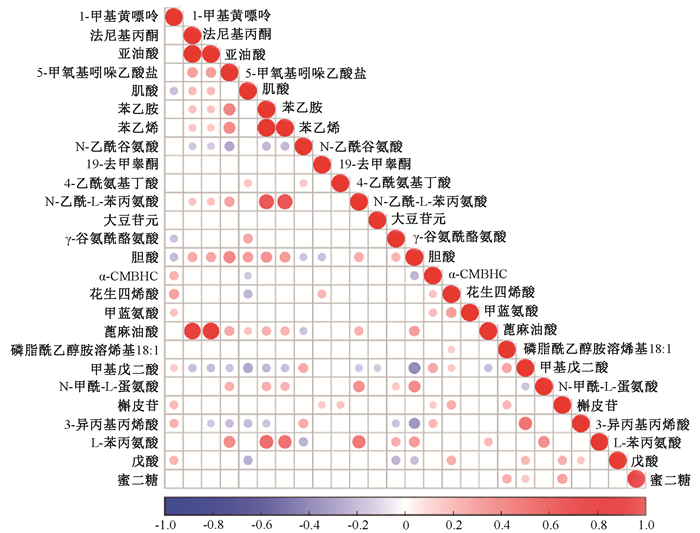
|
注:红色为正相关,蓝色为负相关 图 2 放疗4个时间点间的共代谢产物关联热图 Figure 2 Heat map of common biomarkers at 4 time points of radiotherapy |
4.差异代谢产物通路的遴选与归类:对之前已筛选出的121个变化显著的代谢产物,进一步纳入时间变量因素(F0、F2、F4、Ff),对粪便上清中变化明显的共代谢产物作进一步筛选,遴选出19个共差异代谢产物,包括:1-甲基黄嘌呤、亚油酸、5-氨基戊酸、苯乙胺、苯乙烯、N-乙酰谷氨酸、19\|去甲睾酮、4-乙酰氨基丁酸、N-乙酰-L-苯丙氨酸、大豆苷元、胆酸、花生四烯酸、甲蓝氨酸、N-甲酰-L-蛋氨酸、槲皮苷、苯丙氨酸、葡糖酸、蜜二糖及α-CMBHC。将筛选出来的19个差异代谢产物进行聚类归纳,结合代谢产物关联热图及其代谢途径,进行分类(表 3)。同时总结所有差异代谢物在参与的代谢通路中的变化趋势图(图 3),从图 3可知,参与烟酸和烟酰胺代谢通路的粪便代谢产物整体表达下调,参与苯丙氨酸及酪氨酸代谢通路、亚油酸代谢通路及赖氨酸降解代谢通路的粪便代谢产物表达整体都呈现上调趋势。
|
|
表 3 19个差异代谢产物在4个时间点的均值 Table 3 Mean values of 19 biomarkers at four time points |
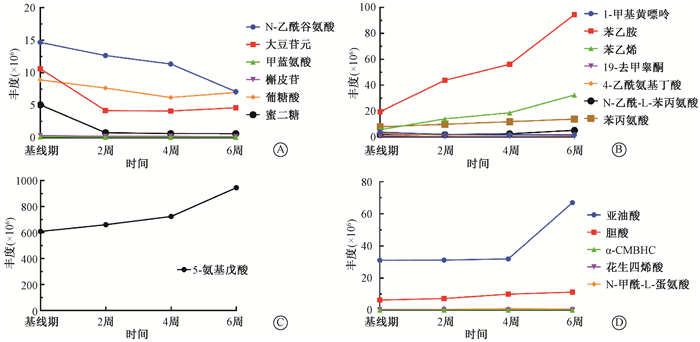
|
图 3 不同放疗时期4条相关代谢途径中代谢产物的变化趋势A.苯丙氨酸及酪氨酸代谢途径;B.烟酸和烟酰胺代谢途径;C.赖氨酸降解途径;D.亚油酸代谢途径 Figure 3 Trends of metabolites in four related metabolic pathways in different periods of radiation therapy A. Phenylalanine tyrosine pathway; B.Niacin and nicotinamide pathway; C. Lysine degradation pathway; D. linoleic acid pathway |
讨论
目前,针对放射性肠炎的临床诊断采用急性放射反应评分标准(RTOG/EORTC)分级,但多项研究表明,基于临床症状的RTOG分级标准对急性放射性肠炎的诊断与实际损伤往往有较大差异[9];而放射性肠炎(RE)急性期属于电子肠镜操作相对禁忌,更多慢性放射性肠炎患者因恐惧心理往往拒绝肠镜检查。因此,目前临床缺乏简单、快速、有效、无创的诊断方法。本研究中,利用非靶向代谢组学平台来探讨粪便上清中显著改变的代谢产物与急性放射性肠炎间相关关系,为急性放射性肠炎的预测及诊疗提供新思路和新方法。
本研究发现,随着时间与剂量的累加,患者的肠道不良反应发生率明显增加,反应程度也逐渐加重。对比健康人群,接受放疗患者的粪便上清中代谢产物发生了显著的变化,其中121个差异代谢产物变化有统计学意义(P < 0.05)。在纳入时间变量后,又继续遴选出19个差异代谢产物,并证实了它们间的相关性。同时通过实验数据进行浓缩和拓扑分析筛选出4条变化有意义的代谢通路,分别为下调的烟酸和烟酰胺代谢通路,上调的苯丙氨酸及酪氨酸代谢通路、亚油酸代谢通路及赖氨酸降解代谢通路。
研究认为,烟酸和烟酰胺代谢通路与肠道炎症应答相关。烟酰胺是一种水溶性维生素,是维生素B族中的一员。烟酸可以在活体内被转变为烟酰胺。在细胞中,烟酸被用于合成烟酰胺腺嘌呤二核苷酸(NAD)与烟酰胺腺嘌呤二核苷酸磷酸(NADP)。Wang等[10]通过小鼠模型观察到还原型辅酶Ⅰ(NADH)对辐射(RT)小鼠的肠道具有明显保护作用,NADH可以通过激活自噬,促进PI3K/AKT自噬途径。实验结果发现,NADH处理过的RT小鼠活性氧(ROS)的产生明显低于未处理过的RT小鼠,说明NADH可以减轻辐射诱导的肠道损伤。而NADPH氧化酶是一组将NADPH中的电子转移到氧分子上的氧化还原酶,参与介导细胞生长,细胞存活和死亡的信号通路。为了应答炎症刺激,巨噬细胞和嗜中性粒细胞通过吞噬NADPH氧化酶(NOX)产生超氧化物。非吞噬NADPH氧化酶(如膜中的NOX2)产生的ROS参与调节各种类型的非吞噬细胞中的细胞内信号传导级联[11]。这些酶具有高稳定性,导致辐射暴露后连续的ROS产生。N-乙酰谷氨酸是谷氨酸与乙酰辅酶A进行乙酰化反应生成,而乙酰辅酶A参与NADH的合成。射线引起肠道炎症,为了响应炎症刺激,巨噬细胞和嗜中性粒细胞通过吞噬NADPH氧化酶(NOX)产生超氧化物使机体合成大量NOX,消耗体内NADH使其表达降低。本研究中,参与烟酸和烟酰胺代谢通路的代谢产物表达下调,其中N-乙酰谷氨酸在放疗4个时间点的表达均明显下调,且在放疗结束时下调最显著,推测这与肠道黏膜放疗反应的辐射剂量依赖性相关。
此外,亚油酸代谢途径也参与了肠道炎症的级联反应。亚油酸通过影响胆固醇合成参与脂质代谢。脂质是辐射暴露产生自由基的主要目标之一[12-14]。在高剂量照射时,可以在辐射模型中观察到脂质过氧化[15-16]。细胞内亚油酸的增加,可以刺激ROS的产生,并激活氧化还原敏感因子,如NK-κB和AP-1[17-18]。同时亚油酸可引起线粒体Ca2+的沉积,线粒体膜出现暂时的超极化,减少氧的消耗量,促进细胞色素C释放,导致细胞凋亡。本研究中,粪便代谢产物中参与亚油酸代谢的代谢产物呈现上调趋势,其中亚油酸表达上调最明显,也反映了放射治疗可以引起宫颈癌患者肠黏膜脂质过氧化,刺激肠道炎症的发生。
与之相反的是,赖氨酸代谢途径主要站在炎症的对立面,主要起到了肠道保护作用。Li等[19]通过实验证明,在辐射暴露后给受照小鼠加用神经原性分化因子(NeuroD)对受辐射影响的肠道具有保护作用,可减轻肠道损伤的发生。辐射诱导了实验小鼠NeuroD的表达,减少了辐射诱导产生的肠道绒毛脱落和隐窝萎缩,从而保护肠道黏膜。赖氨酸末端14Aa肽和结构域中的C末端对NeuroD蛋白的转录是必须的[20-21]。另一方面赖氨酸通过影响5-羟色胺受体,增强肠道修复和氯化钠依赖性阿片肽转运来影响腹泻。Ghosh等[22]发现,提供动物蛋白质量可以减少肠道损伤,而赖氨酸可以显著提高蛋白质质量,大大减少服用人群腹泻的发生率。由此可见,赖氨酸在缓解放疗引起的肠道损伤中起到重要作用。本试验中,参与赖氨酸降解的下游产物5-氨基戊酸表达上调,且在放疗第4周至放疗结束时上调最明显,进一步导致了粪便上清中赖氨酸含量下降,说明在放疗结束时赖氨酸降解达到顶峰,此时无法履行肠道保护功能,也提示了随着放疗剂量的递增,可以通过外源性补充赖氨酸重新启动肠道黏膜的保护机制。
此外,苯丙氨酸及酪氨酸代谢通路也加入了肠道保护的序列。酪氨酸是人体的条件必需氨基酸和生酮生糖氨基酸,在人及动物体内由苯丙氨酸羟化而产生。而酪氨酸激酶(tyrosine kinase,TK),是一种酪氨酸特异性蛋白激酶。肠壁组织损伤是急性放射性肠炎的发病机制之一,现已证明,肠道组织在黏膜屏障破坏后能分泌促炎细胞因子和释放介质进入体循环,在局部乃至全身炎症反应中起重要作用[23-25]。研究发现,IL-2基因的破坏会导致肠道发生炎症甚至是实验小鼠的死亡,这表明IL-2对于控制肠道炎症具有重要作用[26]。Kumar等[27]证明IL-2可以通过Janus激酶3(Jak3)的时间依赖性酪氨酸磷酸化来刺激肠细胞中的伤口修复。Jak3和绒毛蛋白可以协调伤口修复过程的开始,并且在长期修复期间可以跟随替代信号传导途径。先前也有报道Src激酶在表皮生长因子诱导的肠上皮细胞的伤口修复过程中刺激绒毛蛋白的酪氨酸磷酸化[28]。这些都可能与辐射诱导肠道黏膜引发炎症反应有关。本研究中参与苯丙氨酸及酪氨酸代谢途径的代谢产物表达上调,其中苯乙胺及苯丙氨酸在放疗的4个时间点明显上调,尤其是放疗4周至结束的时间段上调最明显。苯乙胺由酪氨酸参与合成,苯丙氨酸参与酪氨酸合成,这些都证明放疗期间粪便上清中酪氨酸的表达上调,提示该阶段机体启动了自身的肠道保护作用。考虑与放疗引起的肠道损伤导致体内的Janus激酶3和绒毛蛋白等酪氨酸磷酸化来刺激肠道细胞的损伤修复有关,目前鲜有研究证明这一观点,值得进一步探索其与肠道病理结构变化的相关关系。
综上所述,本研究利用LC-MS的非靶向代谢组学对宫颈癌放疗患者粪便上清中的代谢产物进行了统计分析,绘制出宫颈癌放疗患者粪便上清中代谢产物的变化谱。共归纳出19种与时间剂量相关的共差异代谢产物,并分析出其参与的4条代谢途径:烟酸和烟酰胺代谢通路、亚油酸代谢通路、苯丙氨酸及酪氨酸代谢通路和赖氨酸降解代谢通路。如何为这些共差异代谢产物进行定性分析,明确其在放射性肠炎中的功能与作用,需要今后在细胞及动物试验水平上进一步论证。
志谢 感谢苏州市科技发展计划项目(SS201628)对本研究的支持
利益冲突 本研究由署名作者按以下贡献申明独立开展,未接受任何不当的职务或者财务利益,在此对研究的独立性和科学性予以保证
作者贡献声明 贺晓兰负责样本收集、数据分析及论文撰写;马辰莺负责课题研究方向拟定、技术路线制定与统计学分析;徐晓婷指导论文修改
| [1] |
Chai Y, Wang J, Gao Y, et al. Identification of biomarkers for radiation-induced acute intestinal symptoms (RIAISs) in cervical cancer patients by serum protein profiling[J]. JRadiat Res, 2015, 56(1): 134-140. DOI:10.1093/jrr/rru081 |
| [2] |
Kim KT, Chae HS, Kim JS, et al. Thalidomide effect in endothelial cell of acute radiation proctitis[J]. WorldJGastroenterol, 2008, 14(30): 4779-4783. DOI:10.1093/jrr/rru081 |
| [3] |
Chai Y, Wang J, Wang T, et al. Application of 1H NMR spectroscopy-based metabonomics to feces of cervical cancer patients with radiation-induced acute intestinal symptoms[J]. Radiother Oncol, 2015, 117(2): 294-301. DOI:10.1016/j.radonc.2015.07.037 |
| [4] |
Fan TW, Higashi RM, Lane AN. Integrating metabolomics and transcriptomics for probing SE anticancer mechanisms[J]. Drug Metab Rev, 2006, 38(4): 707-732. DOI:10.1080/03602530600959599 |
| [5] |
Wikoff WR, Gangoiti JA, Barshop BA, et al. Metabolomics identifies perturbations in human disorders of propionate metabolism[J]. Clin Chem, 2007, 53(12): 2169-2176. DOI:10.1373/clinchem.2007.089011 |
| [6] |
Chen J, Zhao X, Fritsche J, et al. Practical approach for the identification and isomer elucidation of biomarkers detected in a metabonomic study for the discovery of individuals at risk for diabetes by integrating the chromatographic and mass spectrometric information[J]. Anal Chem, 2008, 80(4): 1280-1289. DOI:10.1021/ac702089h |
| [7] |
Wu H, Xue R, Lu C, et al. Metabolomic study for diagnostic model of oesophageal cancer using gas chromatography/mass spectrometry[J]. JChromatogrBAnalyt Technol Biomed Life Sci, 2009, 877(27): 3111-3117. DOI:10.1016/j.jchromb.2009.07.039 |
| [8] |
Deng C, Zhang X, Li N. Investigation of volatile biomarkers in lung cancer blood using solid-phase microextraction and capillary gas chromatography-mass spectrometry[J]. JChromatogrBAnalyt Technol Biomed Life Sci, 2004, 808(2): 269-277. DOI:10.1016/j.jchromb.2004.05.015 |
| [9] |
Andreyev HJ, Vlavianos P, Blake P, et al. Gastrointestinal symptoms after pelvic radiotherapy: role for the gastroenterologist?[J]. IntJRadiat Oncol Biol Phys, 2005, 62(5): 1464-1471. DOI:10.1016/j.ijrobp.2004.12.087 |
| [10] |
Wang JT, Xie WQ, Liu FQ, et al. NADH protect against radiation enteritis by enhancing autophagy and inhibiting inflammation through PI3K/AKT pathway[J]. AmJTransl Res, 2018, 10(6): 1713-1721. |
| [11] |
Bedard K, Krause KH. The NOX family of ROS-generating NADPH oxidases: physiology and pathophysiology[J]. Physiol Rev, 2007, 87(1): 245-313. DOI:10.1152/physrev.00044.2005 |
| [12] |
Kergonou JF, Bernard P, Braquet M, et al. Effect of whole-body gamma irradiation on lipid peroxidation in rat tissues[J]. Biochimie, 1981, 63(6): 555-559. DOI:10.1016/s0300-9084(81)80088-0 |
| [13] |
Schwenke K, Coslar S, Mühlensiepen H, et al. Lipid peroxidation in microsomes of murine bone marrow after low-dose gamma-irradiation[J]. Radiat Environ Biophys, 1994, 33(4): 315-323. DOI:10.1007/bf01210453 |
| [14] |
Nakazawa T, Nagatsuka S. Radiation-induced lipid peroxidation and membrane permeability in liposomes[J]. IntJRadiat Biol Relat Stud Phys Chem Med, 1980, 38(5): 537-544. DOI:10.1080/09553008014551351 |
| [15] |
Srinivasan M, Sudheer AR, Pillai KR, et al. Lycopene as a natural protector against gamma-radiation induced DNA damage, lipid peroxidation and antioxidant status in primary culture of isolated rat hepatocytes in vitro[J]. Biochim Biophys Acta, 2007, 1770(4): 659-665. DOI:10.1016/j.bbagen.2006.11.008 |
| [16] |
Prasad NR, Menon VP, Vasudev V, et al. Radioprotective effect of sesamol on gamma-radiation induced DNA damage, lipid peroxidation and antioxidants levels in cultured human lymphocytes[J]. Toxicology, 2005, 209(3): 225-235. DOI:10.1016/j.tox.2004.12.009 |
| [17] |
Ghosh SP, Singh R, Chakraborty K, et al. Metabolomic changes in gastrointestinal tissues after whole body radiation in a murine model[J]. Mol Biosyst, 2013, 9(4): 723-731. DOI:10.1039/c3mb25454b |
| [18] |
Quehenberger P, Bierhaus A, Fasching P, et al. Endothelin 1 transcription is controlled by nuclear factor-kappaB in AGE-stimulated cultured endothelial cells[J]. Diabetes, 2000, 49(9): 1561-1570. DOI:10.2337/diabetes.49.9.1561 |
| [19] |
Li M, Du A, Xu J, et al. Neurogenic differentiation factor NeuroD confers protection against radiation-induced intestinal injury in mice[J]. Sci Rep, 2016, 6: 30180. DOI:10.1038/srep30180 |
| [20] |
Chen J, Li G, Lu J, et al. A novel type of PTD, common helix-loop-helix motif, could efficiently mediate protein transduction into mammalian cells[J]. Biochem Biophys Res Commun, 2006, 347(4): 931-940. DOI:10.1016/j.bbrc.2006.06.173 |
| [21] |
Noguchi H, Bonner-Weir S, Wei FY, et al. BETA2/NeuroD protein can be transduced into cells due to an arginine- and lysine-rich sequence[J]. Diabetes, 2005, 54(10): 2859-2866. DOI:10.2337/diabetes.54.10.2859 |
| [22] |
Ghosh S, Smriga M, Vuvor F, et al. Effect of lysine supplementation on health and morbidity in subjects belonging to poor peri-urban households in Accra, Ghana[J]. AmJClin Nutr, 2010, 92(4): 928-939. DOI:10.3945/ajcn.2009.28834 |
| [23] |
Iacob S, Iacob DG. Infectious threats, the intestinal barrier, and its trojan horse: dysbiosis[J]. Front Microbiol, 2019, 10: 1676. DOI:10.3389/fmicb.2019.01676 |
| [24] |
Li C, Zhou HC, Nie YL, et al. Effects of lipopolysaccharide on T lymphocyte cell subsets and cytokine secretion in mesenteric lymph nodes of mice: Histological and molecular study[J]. Environ Toxicol Pharmacol, 2019, 71: 103214. DOI:10.1016/j.etap.2019.103214 |
| [25] |
Unno N, Menconi MJ, Salzman AL, et al. Hyperpermeability and ATP depletion induced by chronic hypoxia or glycolytic inhibition in Caco-2BBe monolayers[J]. AmJPhysiol, 1996, 270(6 Pt 1): G1010-1021. DOI:10.1152/ajpgi.1996.270.6.G1010 |
| [26] |
Sadlack B, Merz H, Schorle H, et al. Ulcerative colitis-like disease in mice with a disrupted interleukin-2 gene[J]. Cell, 1993, 75(2): 253-261. DOI:10.1016/0092-8674(93)80067-o |
| [27] |
Kumar N, Mishra J, Narang VS, et al. Janus kinase 3 regulates interleukin 2-induced mucosal wound repair through tyrosine phosphorylation of villin[J]. JBiol Chem, 2007, 282(42): 30341-30345. DOI:10.1074/jbc.C600319200 |
| [28] |
George SP, Wang Y, Mathew S, et al. Dimerization and actin-bundling properties of villin and its role in the assembly of epithelial cell brush borders[J]. JBiol Chem, 2007, 282(36): 26528-26541. DOI:10.1074/jbc.M703617200 |
 2020, Vol. 40
2020, Vol. 40


