2. 青岛市城阳人民医院放射治疗科 266109
2. Department of Radiation Oncology, Chenyang People's Hospital, Qingdao 266109, China
调强放射治疗由于其技术上的复杂性,治疗前需对患者治疗计划进行剂量验证[1]。γ指数是一种定量比较两种剂量分布平面的常用方法[2],通常使用胶片或二维/三维探测器阵列测量模体中的实际剂量分布,与计划系统导出模体的剂量分布进行γ分析。与胶片验证方法相比,探测器阵列测量方法更加便捷,但空间分辨率较低,测量数据有效评估点数较少,测量数据插值、剂量计算网格大小及剂量评估阈值选择对γ通过率影响较大[3-4]。立体定向调强放射治疗具有照射野小、单次剂量高、适形度高、射野边缘剂量梯度大等特点[5],因此对立体定向调强放射治疗的患者计划剂量验证时使用探测器阵列测量时需考虑上述因素对验证结果的影响。
本研究回顾性分析了2012年2月—2018年11月期间在北京大学第三医院接受立体定向放射治疗的50例患者计划的剂量验证结果,分析测量数据插值、剂量计算网格大小及剂量评估阈值选择的不同对计划剂量验证结果的影响,为建立适合临床要求的剂量验证评价标准提供参考。
资料与方法1.一般临床资料:50例立体定向放射治疗患者计划均在美国瓦里安公司Eclipse Version 10.0治疗计划系统完成设计。计划靶区(PTV)体积8.0~123.0 cm3,平均体积为(48.3±33.3)cm3 ;计划设计使用6 MV X射线,采用固定机架角调强放疗(IMRT)技术,3~11个射野,计划平均子野数(475±123)个。计划剂量分割模式采用10分次,5~ 7 Gy/次。
2.患者计划剂量验证:
(1) 验证设备:采用德国IBA公司MatriXX电离室矩阵系统及其配套的MultiCube固体水模(德国Schwarzenbruck公司)进行数据测量。Matri XX阵列采用32×32平面矩阵结构,共1 020个电离室,有效测量面积为24 cm×24 cm,电离室直径为0.45 cm,高0.5 cm,有效灵敏体积为0.08 cm3,电离室间隔0.762 cm,建成厚度3.2 cm。MultiCube固体水模,密度为1.045 g/cm3。使用Brilliance BigBore 16排CT模拟机(荷兰Philips公司),1 mm层厚扫描,扫描结束后将验证模体CT图像传送至Eclipse治疗计划系统,建立验证计划模体模型。
(2) 数据测量:测量前先对MatriXX进行预照射,28 cm×28 cm,500 MU,预热15~20 min。测量时使用连续测量模式,300 ms采样频率,温度、气压校正。预热完成后测量本底漏电流,然后使用10 cm×10 cm射野,100 MU,对MatriXX进行绝对剂量校准。患者计划治疗前,将计划移植到验证模体,Eclipse计划系统计算剂量分布,剂量计算算法为各向异性分析算法(AAA),剂量计算网格默认为2.5 mm,计划系统导出的平面剂量分布分辨率为0.469 mm。生成验证计划时将机架角度归零度,剂量计算时考虑了组织不均匀性修正对剂量的影响。
3.剂量验证结果分析:剂量验证结果分析使用配套OmniPro I′mRT软件(Version 1.7),比较测量的平面剂量分布与计划系统导出的模体中心平面剂量分布。平面剂量分布差异分析使用γ指数[1],γ计算按绝对最大剂量进行归一,剂量评估阈值默认为10%。测量数据默认插值为1 mm后再进行γ计算。
γ分析时将参考分布为MatriXX实际测量的剂量分布,被评估分布为计划系统导出的剂量分布。γ评估标准分别选择2%/2 mm、3%/2 mm和3%/3 mm 3种标准。测量数据插值分别选择线性插值(1.00 mm)和不插值(7.62 mm)两种分辨率,比较测量数据不插值与插值下平均γ通过率的不同。计划系统剂量计算网格分别选择1.0、2.5和4.0 mm 3种计算网格大小,比较选择1.0、4.0与2.5 mm的计算网格下的平均γ通过率的不同。剂量评估阈值分别选择10%、20%和30%,比较选择20%和30%与10%阈值下的平均γ通过率的不同。
4.统计学处理:使用SPSS 24.0软件分析测量数据插值、剂量计算网格大小及剂量评估阈值选择不同对γ通过率的影响,计量资料呈正态分布用x±s表示,两两之间比较采用配对t检验。P<0.05为差异具有统计学意义。
结果1.患者计划剂量验证γ通过率结果:表 1为50例立体定向放射治疗患者计划剂量验证γ通过率结果。按绝对最大剂量进行归一,剂量评估阈值为10%,剂量计算网格为2.5 mm。
|
|
表 1 测量数据采用不同的插值、剂量计算网格大小及剂量评估阈值选择的γ平均通过率(%,x±s) Table 1 The γ passing rates of measured data effected by interpolation, dose calculation grid size and dose assessment threshold(%, x±s) |
2.测量数据插值选择的影响:图 1显示了MatriXX测量数据选择插值与否对患者计划剂量验证结果平均γ通过率的影响。相比对测量数据选择线性插值(1.00 mm),测量数据选择不插值(7.62 mm),2%/2 mm、3%/2 mm和3%/3 mm标准下的γ平均通过率差异有统计学意义(t=10.75、8.68、6.34,P<0.05),γ平均通过率分别增加7.4%、3.6%和1.4%。
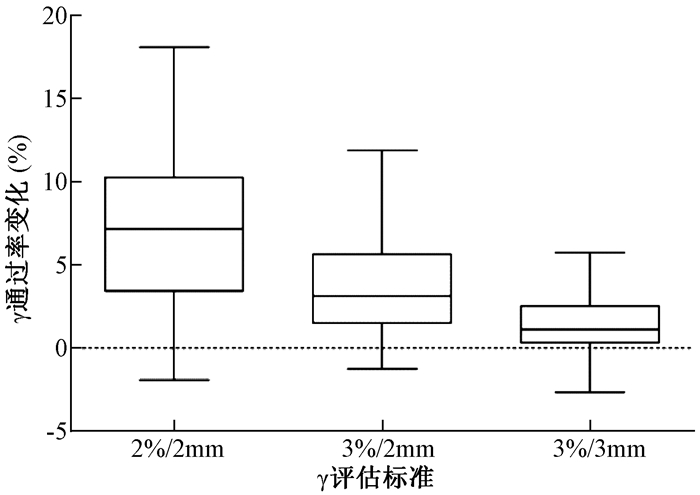
|
图 1 `测量数据插值对患者计划剂量验证平均γ通过率的影响 Figure 1 The relationship between γ passing rate and interpolation of measurement data |
3.剂量计算网格大小选择的影响:图 2显示了计划系统剂量计算使用不同的剂量计算网格大小对患者计划剂量验证结果平均γ通过率的影响。相比计划系统剂量计算使用2.5 mm剂量计算网格,使用1.0 mm剂量计算网格时,2%/2 mm、3%/2 mm和3%/3 mm标准下,γ平均通过率差异有统计学意义(t=8.41、9.06、5.30,P<0.05),分别增加3.8%、1.9%和0.8%。使用4.0 mm剂量计算网格,3种标准下γ平均通过率差异有统计学意义(t=-13.76、-13.15、-9.80,P<0.05),分别减少6.5%、6.0%和3.5%。
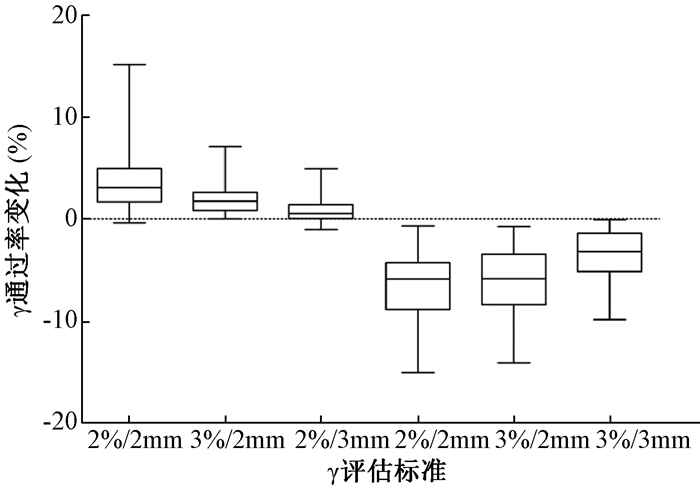
|
图 2 不同的剂量计算网格大小对患者计划剂量验证平均γ通过率的影响 Figure 2 The relationship between γ passing rate and dose calculation grid size of Eclipse planning system |
4.剂量评估阈值选择的影响:立体定向调强计划剂量验证结果的γ平均通过率随着评估区域阈值增加(10%、20%和30%)而变小。图 3显示了验证分析时使用不同的剂量评估阈值对患者计划剂量验证结果平均γ通过率的影响。相比剂量评估阈值为10%,当阈值设置为20%时,2%/2 mm、3%/2 mm和3%/3 mm标准下,γ平均通过率差异有统计学意义(=-8.60、-5.86、-4.68,P<0.05),分别降低了2.4%、1.0%和0.6%。当阈值设置为30%,3种标准下γ平均通过率差异有统计学意义(t=-9.45、-6.66、-5.06,P<0.05),分别降低4.0%、1.7%和0.9%。
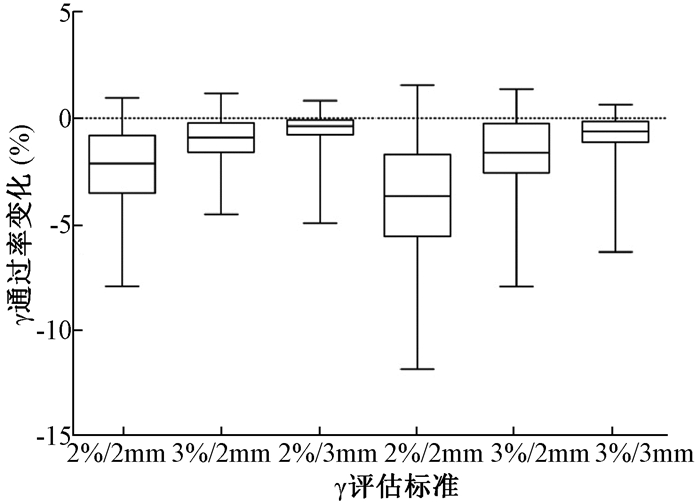
|
注:图中显示的是相比10%的剂量评估阈值,当阈值为20%和30%时,标准下平均γ通过率的变化情况 图 3 剂量评估阈值对患者计划剂量验证平均γ通过率影响 Figure 3 The relationship between γ passing rate and dose assessment threshold of measured data |
讨论
美国医学物理师学会(AAPM)推荐,调强放疗系统应用临床前,使用电离室点剂量验证结合胶片平面剂量验证的方法进行调强放疗患者计划剂量验证[6]。北京大学第三医院开展调强放疗初期也使用电离室结合胶片测量剂量验证方法[7],但该方法过程复杂,验证结果容易受到多种因素的影响,临床上广泛使用二维/三维阵列、电子射野影像系统(EPID)等方法用于计划剂量验证。与电离室结合胶片测量剂量验证方法相比,二维/三维阵列测量方法更加便捷,广泛用于调强剂量验证[8-10]。Yan等[11]对18例鼻咽癌IMRT计划采用Mapcheck和胶片剂量验证结果分析发现,使用Mapcheck的γ平均通过率为(95.5±2.1)%,而使用胶片的γ平均通过率为(97.8±1.0)%,认为鼻咽癌计划剂量验证可以使用Mapcheck代替胶片。Zhang等[12]对9例SBRT肺癌患者计划使用0.016 cm3微型电离室进行点剂量验证,Delta4和Matri XX进行剂量验证,结果发现点剂量偏差均在± 3.0%范围内,平面剂量验证3%/3 mm标准的γ通过率超过98%,且两种阵列验证工具一致性较好。本研究结果与Zhang等[12]研究相近,50例立体定向放射治疗患者计划剂量验证平面剂量验证3%/3 mm标准的γ平均通过率为97.7%,只有1例患者计划剂量验证γ通过率<90%。
调强计划验证结果与γ评估标准的选择密切有关[1],分析时应选择合适的γ评估标准。普遍接受标准是3%/3 mm标准下γ通过率至少为90%[6]。对于γ通过率<90%的患者计划,则需仔细分析查找原因,重复测量或重新设计治疗计划[7]。因此,临床上γ评估标准选择若过于严格,会使得大部分计划不能通过验证,需要对各个失败病例查找原因,增加工作量;相反,标准选择过于松弛,则不能发现验证过程中的细微偏差,可能导致医疗差错发生[4]。
AAPM TG142号报告[13]每月质量保证中规定,实施IMRT技术的加速器,要求激光灯与加速器等中心偏差<1 mm。通常对二维/三维阵列等验证设备摆位时,加速器激光灯与验证设备中心线对齐,偏差可控制在1 mm以内。故若验证设备经严格精确摆位后,与加速器等中心偏差应在2 mm以内。Aarup等[14]对比分析肺部肿瘤SBRT计划中使用AAA算法与蒙特卡罗算法差别,使用6 MV和18 MV X射线设计计划,结果发现中心层面均匀组织的等剂量线的差异均在2%以内,但在肺组织中,肿瘤的中值剂量最大偏差分别为5.9%和8.9%。因此,立体定向调强计划剂量验证结果分析中选择γ评估标准时,距离符合度可选择2 mm,剂量符合度可选择3%标准。
立体定向调强放射治疗计划照射靶区小、单次剂量高、剂量分布适形度高、剂量梯度大,剂量验证时对验证设备的测量精度和分辨率要求也高[4]。与胶片高分辨率相比,阵列中的探测器单元尺寸相对较大,空间分辨率较低,临床上通常将测得结果插值到较高的分辨率进行分析,但插值对γ计算结果有影响。Dorenlot等[15]研究使用2D MatriXX矩阵验证TOMO患者计划时将测量数据分辨率线性插值到1 mm,3%/3 mm标准下γ平均通过率为(97.9±2.4)%,研究表明γ通过率与射野尺寸和照射剂量无关,但随着照射靶区减小,通过率明显下降,并指出对于非线性剂量梯度较大的复杂病例,探测器矩阵分辨率较大是造成测量不准确性的误差来源。立体定向调强计划治疗靶区小、剂量梯度大,数据插值对验证结果影响较大。本研究50例患者计划验证测量数据选择线性插值,2%/2 mm、3%/2 mm和3%/3 mm标准下γ平均通过率分别为86.3%、94.1%和97.7%;不插值时,γ平均通过率分别增加7.4%、3.6%和1.4%。
计划系统剂量计算的准确性将直接影响计划剂量验证结果[1],计划系统剂量计算的准确性通常受到计划系统算法和计算网格大小等因素影响[6, 16-17]。Ong等[18]研究计算网格对小野计算和容积调强计划的影响时发现,1 mm计算网格的剂量准确性要优于2.5 mm,但计算时间增加5倍以上。Snyder等[19]在研究脊柱立体定向放射治疗的网格大小对剂量计算精度的影响时也发现,1.0 mm的计算网格计算的脊髓的受量最准确,但在实际临床工作中也需要考虑计算时间的增加。本研究使用3种不同的计算网格分析,发现随着计算网格变小,不同标准下γ平均通过率均增加。各标准下γ平均通过率很高时候,对各个参数选择对结果的影响不明显。2%/2 mm评估标准下γ平均通过率较低,相比4.0 mm剂量计算网格1.0 mm下,γ平均通过率增加约10%。结合立体定向调强计划的照射野小、射野边缘剂量梯度大等特点,计划验证分析时,若使用严格的评估标准,将计算网格设置为1.0 mm。
AAPM TG 218报告[20]针对IMRT剂量验证时不同的剂量区域使用不同的评估标准,推荐将剂量分布区域划分为高剂量高梯度区、高剂量低梯度区和低剂量低梯度区域。Stojadinovic等[21]分析了50例调强患者计划验证结果,使用3 mm距离符合度下,对不同区域分别采用局部剂量差异7%、15%、25%和40%的标准,γ通过率为(93.4%±2.3)%。立体定向调强计划中治疗靶区体积较小[5],通常<5 cm,计划中大多数剂量分布都是由低剂量低梯度区域主导,γ计算点数中,低剂量低梯度区域的计算点比例较高,对整个计划的γ通过率的影响较大。本研究剂量分布评估时阈值分别选择10%、20%和30%,γ平均通过率下降;但随着区域阈值增加,γ计算点数减少,高剂量高梯度区域个别点的剂量差异影响整体分辨率,对γ通过率的影响明显,计划验证分析时建议剂量评估阈值选择10%~20%。
立体定向放射治疗患者计划的剂量验证分析中,测量数据插值、剂量计算网格大小及剂量评估阈值选择的不同对剂量验证结果均有影响,进行立体定向放射治疗患者计划剂量验证时需要考虑。
利益冲突 本人与本人家属、其他研究者,未因进行该研究而接受任何不正当的职务与财务利益,在此对研究的独立性和科学性予以保证作者贡献声明 张喜乐负责设计研究方案,测量、收集、整理数据和统计分析,论文撰写;杨瑞杰和王俊杰提供科研思路和科研方案指导,修改论文;李君参与病例验证测量和数据收集;安道剑协助整理数据;李佳奇协助修改论文
| [1] |
Low DA, Moran JM, Dempsey JF, et al. Dosimetry tools and techniques for IMRT[J]. Med Phys, 2011, 38(3): 1313-1338. DOI:10.1118/1.3514120 |
| [2] |
Low DA, Dempsey JF. Evaluation of the gamma dose distribution comparison method[J]. Med Phys, 2003, 30(9): 2455-2464. DOI:10.1118/1.1598711 |
| [3] |
Chandraraj V, Stathakis S, Manickam R, et al. Comparison of four commercial devices for RapidArc and sliding window IMRT QA[J]. J Appl Clin Med Phys, 2011, 12(2): 3367. DOI:10.1120/jacmp.v12i2.3367 |
| [4] |
Huang JY, Pulliam KB, McKenzie EM, et al. Effects of spatial resolution and noise on gamma analysis for IMRT QA[J]. J Appl Clin Med Phys, 2014, 15(4): 4690. DOI:10.1120/jacmp.v15i4.4690 |
| [5] |
Videtic GM, Hu C, Singh AK, et al. A randomized phase 2 study comparing 2 stereotactic body radiation therapy schedules for medically inoperable patients with stage I peripheral non-small cell lung cancer:NRG Oncology RTOG 0915(NCCTG N0927)[J]. Int J Radiat Oncol Biol Phys, 2015, 93(4): 757-764. DOI:10.1016/j.ijrobp.2015.07.2260 |
| [6] |
Ezzell GA, Burmeister JW, Dogan N, et al. IMRT commissioning:multiple institution planning and dosimetry comparisons, a report from AAPM Task Group 119[J]. Med Phys, 2009, 36(11): 5359-5373. DOI:10.1118/1.3238104 |
| [7] |
杨瑞杰, 张喜乐, 刘路, 等. 2010例调强放疗患者计划剂量验证结果分析[J]. 中华放射医学与防护杂志, 2016, 36(12): 917-921. Yang RJ, Zhang XL, Liu L, et al. Analysis of 2010 patient-specific intensity-modulated radiation therapy dosimetric verification results[J]. Chin J Radiol Med Prot, 2016, 36(12): 917-921. DOI:10.3760/cma.j.issn.0254-5098.2016.12.008 |
| [8] |
杨瑞杰, 王俊杰, 许峰, 等. 电子射野影像系统用于调强放疗剂量验证[J]. 中华放射医学与防护杂志, 2013, 33(1): 55-57. Yang RJ, Wang JJ, Xu F, et al. The electronic portal imaging device for dosimetric verification of intensity-modulated radiation therapy[J]. Chin J Radiol Med Prot, 2013, 33(1): 55-57. DOI:10.3760/cma.j.issn.0254-5098.2013.01.014 |
| [9] |
McCowan PM, Van Uytven E, Van Beek T, et al. An in vivo dose verification method for SBRT-VMAT delivery using the EPID[J]. Med Phys, 2015, 42(12): 6955-6963. DOI:10.1118/1.4935201 |
| [10] |
Vikraman S, Manigandan D, Karrthick KP, et al. Quantitative evaluation of 3D dosimetry for stereotactic volumetric-modulated arc delivery using COMPASS[J]. J Appl Clin Med Phys, 2014, 16(1): 5128. DOI:10.1120/jacmp.v16i1.5128 |
| [11] |
Yan C, Wang ZH, Hu HS, et al. Map check for dose verification of intensity-modulated radiotherapy in the treatment of nasopharyngeal carcinoma[J]. Tumor, 2009, 29(5): 486-489. DOI:10.3781/j.issn.1000-7431.2009.05.020 |
| [12] |
Zhang J, Wu VW, Lu J, et al. Dosimetric verification of stereotactic body radiation therapy for lung cancer treatment plans using flattening filter-free beams[J]. Tumori, 2015, 101(6): 631-636. DOI:10.5301/tj.5000363 |
| [13] |
Klein EE, Hanley J, Bayouth J, et al. Task Group 142 report. Quality assurance of medical accelerators[J]. Med Phys, 2009, 36(9): 4197-4212. DOI:10.1118/1.3190392 |
| [14] |
Aarup LR, Nahum AE, Zacharatou C, et al. The effect of different lung densities on the accuracy of various radiotherapy dose calculation methods:implications for tumour coverage[J]. Radiother Oncol, 2009, 91(3): 405-414. DOI:10.1016/j.radonc.2009.01.008 |
| [15] |
Dorenlot A, Hoog C, Tessonnier T, et al. Retrospective of 300 delivery quality assurance of patients treated with the tomotherapy HI-ART 2 using the IBA matrixx-evolution[J]. Phys Med, 2013, 29(Suppl 1): e36. DOI:10.1016/j.ejmp.2013.08.113 |
| [16] |
Mittauer K, Lu B, Yan G, et al. A study of IMRT planning parameters on planning efficiency, delivery efficiency, and plan quality[J]. Med Phys, 2013, 40(6): 061704. DOI:10.1118/1.4803460 |
| [17] |
Huang B, Wu L, Lin P, et al. Dose calculation of Acuros XB and anisotropic analytical algorithm in lung stereotactic body radiotherapy treatment with flattening filter free beams and the potential role of calculation grid size[J]. Radiat Oncol, 2015, 10: 53. DOI:10.1186/s13014-015-0357-0 |
| [18] |
Ong CL, Cuijpers JP, Senan S, et al. Impact of the calculation resolution of AAA for small fields and RapidArc treatment plans[J]. Med Phys, 2011, 38(8): 4471-4479. DOI:10.1118/1.3605468 |
| [19] |
Snyder Karen C, Liu M, Zhao B, et al. Investigating the dosimetric effects of grid size on dose calculation accuracy using volumetric modulated arc therapy in spine stereotactic radiosurgery[J]. J Radiosurg SBRT, 2017, 4(4): 303-313. |
| [20] |
Miften M, Olch A, Mihailidis D, et al. Tolerance limits and methodologies for IMRT measurement-based verification QA:Recommendations of AAPM Task Group No. 218[J]. Med Phys, 2018, 45(4): e53-53e83. DOI:10.1002/mp.12810 |
| [21] |
Stojadinovic S, Ouyang L, Gu X, et al. Breaking bad IMRT QA practice[J]. J Appl Clin Med Phys, 2015, 16(3): 5242. DOI:10.1120/jacmp.v16i3.5242 |
 2019, Vol. 39
2019, Vol. 39


