2. 国家癌症中心 中国医学科学院北京协和医学院肿瘤医院放疗科, 北京 100021;
3. 南方医科大学公共卫生学院放射医学系, 广州 510515;
4. 浙江省肿瘤医院放射科, 杭州 310022
2. Department of Radiation Oncology, National Cancer Center/Cancer Hospital, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100021, China;
3. Department of Radiation Medicine, School of Public Health, Southern Medical University, Guangzhou 510515, China;
4. Department of Radiology, Zhejiang Cancer Hospital, Hangzhou 310022, China
立体定向放射治疗(SBRT),是针对早期肺癌与肺部寡转移灶开展的新型放射治疗方式[1-2]。SBRT是一种有效的非侵入性放射治疗,有肿瘤控制率高、患者生存期长且治疗周期短、性价比高等优势。SBRT治疗早期非小细胞肺癌(NSCLC),通常采用1~8次大剂量照射,总剂量范围48~66 Gy[3-4]。研究显示,早期NSCLC经SBRT治疗后,5年局部控制率86%,5年总生存率47%;在早期NSCLC(cT1~2aN0M0)中SBRT的临床价值不亚于外科手术获益[5]。SBRT表现出量效关系,提示剂量提升后,疾病局部控制率明显改善,这为增加SBRT治疗剂量提供了理论依据。
然而,SBRT的临床价值与潜在风险仍缺乏多中心前瞻性临床研究[6]。同时,基于SBRT大剂量低分割的放射生物学基础研究也相对缺乏[7]。放射性肺损伤是胸部肿瘤放射治疗过程中最常见的并发症之一,也是影响患者预后的重要因素[8-9]。开展针对SBRT大剂量低分割动物模型基础实验,有助于进一步理解SBRT引起正常组织不良反应的放射生物学机制,为深入开展SBRT临床治疗提供放射生物学参考。
材料与方法1.动物照射及分组:采用8~10周龄C57BL6雌性小鼠,SPF级饲养,购自上海西普尔必凯实验动物有限公司,许可证号:SCXK(沪)2013-0016。饲养条件:温度(23±1)℃,相对湿度(55±5)%,每日光照12 h,自由摄食饮水。照射前经异氟烷诱导麻醉后,经专用小鼠胸部照射装置固定[10]。采用Mevtron 6700 Linac医用直线加速器(德国西门子公司),6 MV X射线进行全肺野照射,照射剂量率3 Gy/min,源皮距100 cm。照射剂量梯度实验分别给予0、2.0 Gy×5次、4.0 Gy×5次、6.0 Gy×5次、7.0 Gy×5次、8.5 Gy×5次;每日照射1次,连续5 d。实验组,单次照射结果采用前期已发表实验数据[11],剂量分别为10.5、12.5、14.5、17.5、20.0 Gy。健康对照组不接受X射线照射(0 Gy)。健康对照组与各剂量实验组每组均采用随机数表法分配12只小鼠。
2. CT影像学定量分析:根据前期研究结论[11],基于CT肺密度与体积参数进行小鼠肺纤维化定量评估时,照射后24周差异最为显著且可靠。因此,本研究采用照射后24周行CT扫描成像,间距为0.6 mm,层厚0.6 mm,采集时间为32 s。将图像重建为138 mm×138 mm的横向视野(FOV),矩阵为512×512。CT图像三维重建后经自动区域生长三维分割计算出肺部平均密度值,即CT值(Hounsfield unit,HU)与肺部体积值(cm3)[11]。
3.放射生物学建模:根据CT平均肺密度与肺体积这两个关键CT参数分别建立Boltzmann模型剂量-效应关系曲线(Mathematica v11.0软件),公式如下:
| $ y = \frac{{{A_1} - {A_2}}}{{1 + {{\rm{e}}^{(x - {x_0})/dx}}}} + {A_2} $ | (1) |
式中,x0为中位剂量或半数有效剂量E50,Gy;y为肺部CT影像学改变(即平均肺密度或体积改变),HU;x为总剂量,Gy;剂量常数dx为1;A1、A2分别为函数的两个极值,即初始值与最终值。
4.基因芯片及数据分析:X射线照射后第24周,采用颈椎脱臼法处死小鼠提取新鲜肺组织。肺组织经TRIzol试剂(北京索莱宝科技有限公司)处理后,通过RNeasy试剂盒(北京索莱宝科技有限公司)分离提取总RNA。全基因组基因表达阵列进行样品分析。自带软件包进行表达矩阵的生成,数据注释和处理。数据进行log2转换以说明基因的表达上升或者下降。mRNA相对表达量的倍数计算方法:倍数变化=2-ΔΔCt=2-(ΔCt实验组-ΔCt对照组);ΔCt=Ct待测样品- Ct内参。R v3.4.4软件包进行监督与非监督聚类分析,包括主成分分析(PCA)、层次聚类(HC)、K均值聚类和自组织映射,以分析不同时间点辐射与基因表达趋势关系,识别剂量相关基因的表达。
5.统计学处理:采用GraphPad Prism 7软件进行数据分析。所有数据均符合正态分布,数据以x±s表示,两组间比较采用独立样本t检验。线性回归模型分析两组独立数据的关联程度。双因素方差分析比较两组剂量间基因转录水平差异。P<0.05为差异有统计学意义。
结果1.不同分割剂量组肺部CT改变:小鼠接受全肺X射线分割照射后24周,经CT成像三维重建后冠状位显示:相比健康对照组(0 Gy),中等剂量照射组(6.0 Gy×5次)出现明显肺部磨玻璃影、斑片状实变影(肺组织密度增厚)等明显间质性肺纤维化改变,但肺部结构与外周轮廓未出现明显改变;高剂量组(8.5 Gy×5次)则出现广泛的纤维索条影、伴有肺结构变形、支气管牵拉性扩张、肺泡结构严重破坏等晚期肺纤维化表现。
2.不同分割剂量照射后肺组织转录水平改变:为研究不同分次剂量照射后肺组织生物学水平改变,经基因芯片检测后分析肺纤维化相关基因标志物[12-17]的转录调控改变。与影像学结果相符,一系列肺纤维化相关基因在中等剂量(30.0 Gy)组均出现了明显的上调,而在高剂量(42.5 Gy)组这一转录水平的改变尤为显著(图 1)。这些纤维化相关基因包括包括胶原蛋白Ⅰ(COL1α1、COL1α2)、胶原蛋白Ⅲ(COL3α1)、胶原蛋白Ⅳ(COL4α1、COL4α2、COL4α3、COL4α4)、胶原蛋白Ⅴ(COL5α1)、血浆铜蓝蛋白(ceruloplasmin,CP)、羧肽酶A3(carboxypeptidase A3,CPA3)、胰腺分泌颗粒膜糖蛋白(pancreatic secretory granule membrane major glycoprotein,GP2)、71 KDa热休克同源蛋白(heat shock cognate 71 kDa protein,HSPA8)、胰岛素样生长因子结合蛋白2(insulin-like growth factor binding protein 2,IGFBP2)、淋巴细胞胞质蛋白1(LCP1)、基质金属蛋白酶12(MMP12)、基质金属蛋白酶13(MMP13)、基质金属蛋白酶14(MMP14)、基质金属蛋白酶2(MMP2)、转化生长因子β(TGFβ1)、原肌球蛋白α-3链(Tropomyosin 3,TPM3)。相比较中等(30.0 Gy)与高剂量(42.5 Gy)组,肺组织纤维化相关基因的转录水平差异具有统计学意义(t=3.939, P<0.05,图 1)。
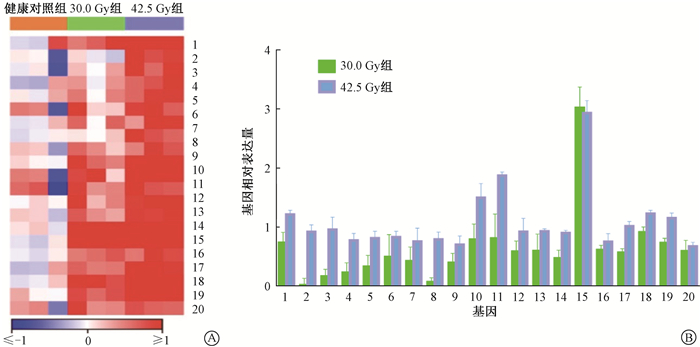
|
注:1. COL1α1;2. COL1α2;3. COL3α1;4. COL4α1;5. COL4α2;6. COL4α3;7. COL4α4;8. COL5α1;9. CP;10. CPA3;11. GP2;12. HSPA8;13. IGFBP2;14. LCP1;15. MMP12;16. MMP13;17. MMP14;18. MMP2;19. TGFBI;20. TPM3 图 1 小鼠接受不同剂量X射线全肺照射后24周肺纤维相关基因标志物转录水平差异A.基因表达相对表达值热图;B. 30.0 Gy组与42.5 Gy组相对对照组基因表达量 Figure 1 Transcriptional analysis of fibrosis related genes in lung tissues at 24 weeks after whole thoracic irradiation A. Heatmap of gene expression levels in each group; B. Relative gene expression levels in 30.0 Gy and 42.5 Gy irradiation groups |
3.不同分割剂量照射后组织病理学改变:对不同分割剂量照射后肺组织进行胶原蛋白染色,提示相对于健康对照组,中、高剂量组肺间质及肺泡间隙出现弥漫性胶原纤维沉积、肺泡间隔明显增厚以及大量免疫细胞浸润,其中以组织浸润性巨噬细胞[18]为主。高剂量组肺泡结构出现明显改变、肺泡隔破坏严重等纤维化晚期表现(图 2)。这些组织病理学改变与影像学、分子生物学结果高度一致,进一步证实了分次剂量依赖的肺纤维化改变过程。
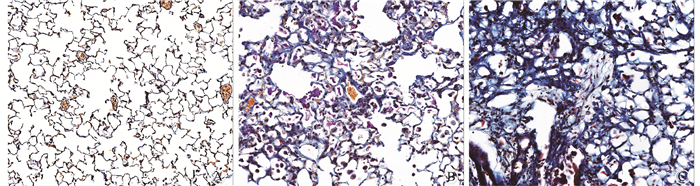
|
图 2 小鼠接受不同剂量X射线全肺照射后24周肺部纤维化胶原蛋白染色比较Masson胶原纤维染色×20 A. 0 Gy;B.30.0 Gy;C.42.5 Gy Figure 2 Different lung fibrosis levels by collagen staining 24 weeks after whole thoracic irradiation Masson collagen fiber staining ×20 A. 0 Gy; B.30.0 Gy; C.42.5 Gy |
4. X射线致肺密度改变的剂量-效应关系:为定量比较分次相对单次照射致肺密度改变规律,本研究根据24周肺部CT三维图像并量化分析取得各剂量组小鼠平均肺密度值。经Boltzmann模型回归分析建立分次相对单次照射致纤维化剂量-效应关系,5次分割照射引起肺密度增加的中位剂量(或半数有效剂量E50)为(30.80±0.80)Gy(回归拟合度校正R2=0.97),相比单次照射中位剂量(13.68±0.14)Gy(前期实验数据[11]经Boltzmann模型重新分析后获得,校正R2=0.99)显著提高(图 3)。当5次分割照射总剂量<25.0 Gy,或单次照射总剂量<12.0 Gy时,不会诱发肺密度明显增加,提示分割照射可以明显提高肺部耐受剂量。根据肺密度剂量-效应曲线,当5次分割照射方案总剂量在25.0~35.0 Gy范围时,肺密度会随剂量迅速增加,因此可认为该剂量范围是分次照射(5次分割)诱导小鼠肺纤维化的敏感剂量区间。
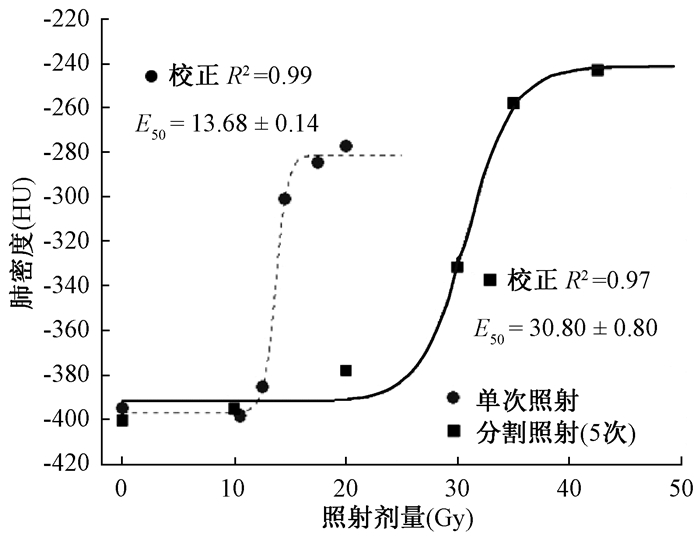
|
图 3 分割照射(5次)相比单次照射致肺密度增高的剂量-效应关系 Figure 3 Dose-response relationship of averaged CT lung density alternations with respect to five-fraction vs. single-fraction of ionizing radiation exposure |
5.分割照射相比单次照射致肺体积变化的剂量-效应关系:根据肺纤维化影像学特征的另一指标,平均肺密度参数进行Boltzmann模型回归分析显示,增加分割照射次数明显减轻电离辐射对正常肺组织的损伤作用。分次照射引起肺体积变化的中位剂量为(31.31±7.07)Gy(校正R2=0.92),对比单次照射中位剂量(15.56±2.71)Gy(前期实验数据[11]经Boltzmann模型重新分析后获得,校正R2=0.88)显著提高(图 4)。5次分割照射总剂量<20.0 Gy、或单次照射总剂量<12.0 Gy时,不会造成肺体积明显变化,提示分割照射可以增加肺部放射耐受剂量。根据肺体积剂量-效应曲线,当5次分割照射方案总剂量在20.0~40.0 Gy范围时,肺体积下降趋势最为迅速,因此可认为该剂量范围是分割照射(5次分割)诱导小鼠肺纤维化的敏感剂量区间。
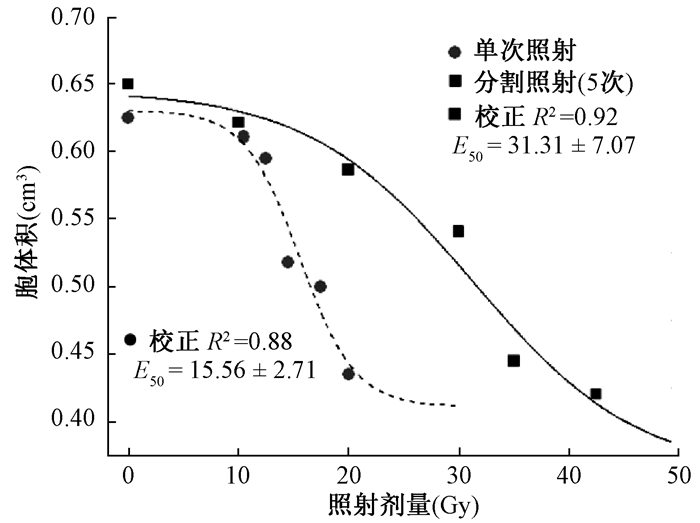
|
图 4 分割照射(5次)相比单次照射致肺体积减少的剂量-效应关系 Figure 4 Dose-response relationship of lung volume changes with respect to five-fraction vs. single-fraction of ionizing radiation exposure |
讨论
研究如何减轻放射性肺损伤是发挥肺癌与肺转移灶精准放疗优势的当务之急。放疗分次照射生物学效应研究对于临床实践具有重要的参考意义。尤其是当前调强放疗(IMRT)与螺旋断层放疗(TOMO)技术的不断推广普及,全肺平均剂量(Dmean)在评估肺部放射性损伤风险的价值相比三维适形放疗显得更为重要。本研究主要着眼于全肺平均剂量(Dmean)与放射性肺损伤发生的直接关系;在前期已提出的精准辐射诱导小鼠肺损伤模型[10]、基于低剂量CT成像与三维图像分割算法的肺纤维化影像学定量[11]等基础上,本研究建立了分割照射与单次照射正常肺组织耐受的平均剂量-效应模型。以CT肺密度和肺体积改变作为主要评价指标,肺组织对分割照射放疗方案的耐受性相比单次照射有了显著提高。根据经典放射生物学4R的概念[19],正常细胞DNA修复能力远大于肿瘤细胞,分割照射有助于保护正常细胞得到修复而对肿瘤细胞有更大的杀伤作用[20]。另一方面,由于细胞再增殖作用,射线可以刺激肿瘤和正常细胞的分裂[21]。肿瘤细胞的再增生是导致治疗失败或者复发的重要因素[22]。肿瘤细胞的增殖速度远大于正常细胞,因此不得不考虑治疗带来的肿瘤细胞死亡和再增生的动态平衡。分割照射能够有效持续杀伤肿瘤细胞再增生所导致的癌细胞增加。正常组织的再增殖具有良好的控制机制,这种治疗期间的再增生是机体修复所必需的,可以尽可能减轻放疗所致的不良反应。事实上,再增殖也是加速超分割放疗的重要生物学机制[23]。综上所述,相比单次照射方案,本研究所观察到肺组织对分割照射耐受剂量明显提高,从放射生物学的角度可以解释为分割照射可以通过修复和再增殖最大限度保护正常组织。
与前期单次照射实验相一致的是,分割照射诱导肺纤维化同样具有明显的阈值效应,且阈值剂量得以明显提高。当5次分割照射总剂量<25.0 Gy,CT肺密度不会发生明显改变;分割照射总剂量<20.0 Gy,肺体积无明显差异。该结论进一步提示该剂量范围以内,辐射诱导肺损伤可以得到较为充分地修复,从而降低了发生放射纤维化的概率。另外,与单次照射试验不同的是,分割照射方案中肺体积随剂量改变的敏感性较肺密度更高。这揭示了在放射性肺纤维化进展过程中,肺组织密度与肺体积改变对射线的依赖性不仅取决于总剂量大小,也与分割次数和分次剂量存在一定关联。在分割照射实验中,辐射诱导肺密度与体积改变的中位剂量相对较一致,分别是(30.80±0.80)与(31.31±7.07)Gy。尽管肺密度与肺体积是两个相对独立的影像学参数,但在晚期肺纤维化中对剂量-肺部影像学改变的提示作用在逐渐趋向一致。
本研究采用小鼠全肺野照射,与SBRT的部分照射有所不同,临床上SBRT靶区周围肺组织受量可显著提高,但由于受照射体积非常局限,通常不会引起明显肺损伤现象。这是由于正常组织或肿瘤对放疗的辐射反应直接取决于其所有克隆细胞或组织再生细胞的根除程度。从器官结构或功能亚基的角度来看,肺是经典的并行器官[24],这一基本功能单位的几何排列属性直接影响了放射性肺损伤的剂量-效应曲线及其对不同分次照射模式的耐受能力。但对于多发肺转移结节(总体体积较大时),同期做SBRT需要注意全肺平均剂量。在局部晚期肺癌放化疗时全肺平均剂量一般需低于15~17 Gy/25~30次;鼻咽癌转移瘤姑息全肺放疗时20 Gy/10~20次,这些限制剂量均与本研究提示的20 Gy/5次较为一致。此外,常规临床评价指标通常是2级的放射性肺炎发生率,而本研究是基于影像学参数的变化,这可能为病变早期及隐匿性肺损伤的诊断提供了潜在可能。
随着计算机辅助影像诊断和影像组学研究的不断深入,数字化影像学工具对无创、精准分析机体病理生理学改变有着重要意义,可以更好地服务于放射生物学与放射肿瘤学研究。本研究定量分析了肺组织分割放疗的生物学效应,建立了正常肺组织大剂量低分割照射生物学效应预测模型与剂量耐受关系,为进一步探索放射性肺纤维化不同分割方案生物学有效剂量效应模型、开展局部肺野照射等研究奠定了基础。
利益冲突 无作者贡献声明 周成、陈明负责实验设计和论文撰写;吴润叶、周兆明参与结果分析,指导修改;封巍、徐裕金、王谨、张鹏与陈媛媛协助实验并负责数据统计与探讨;石磊负责CT图像数据分析
| [1] |
Rusthoven KE, Kavanagh BD, Burri SH, et al. Multi-institutional phase Ⅰ/Ⅱ trial of stereotactic body radiation therapy for lung metastases[J]. J Clin Oncol, 2009, 27(10): 1579-1584. DOI:10.1200/JCO.2008.19.6386 |
| [2] |
Eriguchi T, Takeda A, Sanuki N, et al. Stereotactic body radiotherapy for T3 and T4N0M0 non-small cell lung cancer[J]. J Radiat Res, 2016, 57(3): 265-272. DOI:10.1093/jrr/rrw023 |
| [3] |
Timmerman R, Paulus R, Galvin J, et al. Stereotactic body radiation therapy for inoperable early stage lung cancer[J]. JAMA, 2010, 303(11): 1070-1076. DOI:10.1001/jama.2010.261 |
| [4] |
Soldà F, Lodge M, Ashley S, et al. Stereotactic radiotherapy (SABR) for the treatment of primary non-small cell lung cancer; systematic review and comparison with a surgical cohort[J]. Radiother Oncol, 2013, 109(1): 1-7. DOI:10.1016/j.radonc.2013.09.006 |
| [5] |
Chang JY, Senan S, Paul MA, et al. Stereotactic ablative radiotherapy versus lobectomy for operable stage I non-small-cell lung cancer:a pooled analysis of two randomised trials[J]. Lancet Oncol, 2015, 16(6): 630-637. DOI:10.1016/S1470-2045(15)70168-3 |
| [6] |
Timmerman R, McGarry R, Yiannoutsos C, et al. Excessive toxicity when treating central tumors in a phase Ⅱ study of stereotactic body radiation therapy for medically inoperable early-stage lung cancer[J]. J Clin Oncol, 2006, 24(30): 4833-4839. DOI:10.1200/JCO.2006.07.5937 |
| [7] |
Shibamoto Y, Miyakawa A, Otsuka S, et al. Radiobiology of hypofractionated stereotactic radiotherapy:what are the optimal fractionation schedules?[J]. J Radiat Res, 2016, 57 Suppl 1: i76-76i82. DOI:10.1093/jrr/rrw015 |
| [8] |
Marks LB, Yu X, Vujaskovic Z, et al. Radiation-induced lung injury[J]. Semin Radiat Oncol, 2003, 13(3): 333-345. DOI:10.1016/S1053-4296(03)00034-1 |
| [9] |
Mehta V. Radiation pneumonitis and pulmonary fibrosis in non-small-cell lung cancer:pulmonary function, prediction, and prevention[J]. Int J Radiat Oncol Biol Phys, 2005, 63(1): 5-24. DOI:10.1016/j.ijrobp.2005.03.047 |
| [10] |
耿继武, 刘浩, 曹立基, 等. 无创吸入式麻醉精准肺野照射装置在小鼠肺损伤研究中的应用[J]. 中国辐射卫生, 2018, 27(2): 109-113. Geng JW, Liu H, Cao LJ, et al. Application of non-invasive inhalation anesthesia precision thoracic irradiation device in a mouse model[J]. Chin J Radiol Health, 2018, 27(2): 109-113. DOI:10.13491/j.issn.1004-714x.2018.02.004 |
| [11] |
耿继武, 刘浩, 李子尧, 等. 基于三维生物学有效剂量的肺纤维化分层与预测模型[J]. 中国医学物理学杂志, 2018, 35(7): 749-752. Geng JW, Liu H, Li ZY, et al. Three-dimensional biologically effective dose model for stratification and prediction of lung fibrosis[J]. Chin J Med Phy, 2018, 35(7): 749-752. DOI:10.3969/j.issn.1005-202X.2018.07.002 |
| [12] |
李欢欢, 高宏生, 魏路清. 肺泡上皮来源的血清标志物对肺纤维化的诊断价值[J]. 武警医学, 2015, 26(7): 729-731. Li HH, Gao HS, Wei LQ. Diagnostic value of serum markers derived from alveolar epithelium for pulmonary fibrosis[J]. Med J Chin PAPF, 2015, 26(7): 729-731. DOI:10.3969/j.issn.1004-3594.2015.07.026 |
| [13] |
魏路清, 彭守春. 间质性肺疾病的生物学标志物研究进展[J]. 中国实用内科杂志, 2014, 34(8): 748-751. Wei LQ, Peng SC. Research progress on biomarkers of interstitial lung disease[J]. Chin J Pract Int Med, 2014, 34(8): 748-751. DOI:10.7504/nk2014070104 |
| [14] |
周惠琼, 张奉春. 涎液化糖链抗原-6在间质性肺疾病诊疗中的价值[J]. 协和医学杂志, 2018, 9(3): 207-212. Zhou HQ, Zhang FC. The value of Krebs von den Lungen-6 in the clinical management of interstitial lung diseases[J]. Med J Peking Union Med Coll Hosp, 2018, 9(3): 207-212. DOI:10.3969/j.issn.1674-9081.2018.03.004 |
| [15] |
张蓓, 高惠英, 李小峰. 系统性硬化病合并间质性肺疾病发病机制和治疗的研究进展[J]. 中华风湿病学杂志, 2017, 21(2): 136-138. Zhang B, Gao HY, Li XF. Advances in the pathogenesis and treatment of systemic sclerosis with interstitial lung disease[J]. Chin J Rheumatol, 2017, 21(2): 136-138. DOI:10.3760/cma.j.issn.1007-7480.2017.02.016 |
| [16] |
朱晨, 赵亚滨, 孔灵菲, 等. 涎液化糖链抗原-6在不同类型的弥漫性间质性肺疾病患者血清和支气管肺泡灌洗液中的表达及临床意义[J]. 中华结核和呼吸杂志, 2016, 39(2): 93-97. Zhu C, Zhao YB, Kong LF, et al. The expression and clinical role of KL-6 in serum and BALF of patients with different diffuse interstitial lung diseases[J]. Chin J Tuberc Respir Dis, 2016, 39(2): 93-97. DOI:10.3760/cma.j.issn.1001-0939.2016.02.004 |
| [17] |
陈明, 曾明, 何兴轩. 肺纤维化疾病生物标志物的研究进展[J]. 中国药理学与毒理学杂志, 2017, 31(2): 187-194. Chen M, Zeng M, He XX. Research progress in biomarkers of pulmonary fibrosis diseases[J]. Chin J Pharmacol Toxicol, 2017, 31(2): 187-194. DOI:10.3867/j.issn.1000-3002.2017.02.10 |
| [18] |
Meziani L, Mondini M, Petit B, et al. CSF1R inhibition prevents radiation pulmonary fibrosis by depletion of interstitial macrophages[J]. Eur Respir J, 2018, 51(3). DOI:10.1183/13993003.02120-2017 |
| [19] |
Dale R, Jones B. Radiobiological modelling in radiation oncology[M]. London: The British Institute of Radiology, 2007: 292.
|
| [20] |
Thames HD, Hendry JH, Moore JV, et al. The high steepness of dose-response curves for late-responding normal tissues[J]. Radiother Oncol, 1989, 15(1): 49-53. DOI:10.1016/0167-8140(89)90117-5 |
| [21] |
Kim JJ, Tannock IF. Repopulation of cancer cells during therapy:an important cause of treatment failure[J]. Nat Rev Cancer, 2005, 5(7): 516-525. DOI:10.1038/nrc1650 |
| [22] |
Yom SS. Accelerated repopulation as a cause of radiation treatment failure in non-small cell lung cancer:review of current data and future clinical strategies[J]. Semin Radiat Oncol, 2015, 25(2): 93-99. DOI:10.1016/j.semradonc.2014.12.002 |
| [23] |
Haslett K, Pottgen C, Stuschke M, et al. Hyperfractionated and accelerated radiotherapy in non-small cell lung cancer[J]. J Thorac Dis, 2014, 6(4): 328-335. DOI:10.3978/j.issn.2072-1439.2013.11.06 |
| [24] |
Källman P, Agren A, Brahme A. Tumour and normal tissue responses to fractionated non-uniform dose delivery[J]. Int J Radiat Biol, 1992, 62(2): 249-262. DOI:10.1080/09553009214552071 |
 2019, Vol. 39
2019, Vol. 39


