2. 衢州市人民医院放射科 324000
2. Department of Radiology, Quzhou People's Hospital, Quzhou 324000, China
伴随着心血管病的患病率攀升,CT冠状动脉成像(coronary computed tomography angiography, CCTA)检查量持续递增,由此而导致的辐射风险引起业界的持续关注[1-3]。沿用至今,容积CT剂量指数(volume CT index,CTDIvol)与剂量长度乘积(dose length product,DLP)仍是辐射剂量报告的主流指标。由于CTDIvol和DLP均存在基于体模的不合理性,未考虑患者因素对辐射剂量的影响[4-6],美国医学物理学家学会(American Association of Physicists in Medicine,AAPM)引入新的辐射剂量指标—体型特异性剂量估算值(size-specific dose estimate, SSDE)[5-6]。该指标以有效直径(effective diameter, deff)或水有效直径(water equivalent diameter, dw)量化患者特有的体型特征,获取基于两者的SSDE(SSDEdeff和SSDEdw)。SSDE的研究多在于评估CT平扫SSDEdeff和SSDEdw差异,胸部CT扫描的SSDEdeff较SSDEdw明显低估辐射剂量[7-13]。作为胸部CT检查范畴的CCTA扫描范围自气管隆突下1 cm至心脏膈面,其解剖区域并不等同于胸部扫描,并且对比剂的引入也改变了组织结构对X射线的衰减。由此,先前两种SSDE估算胸部扫描辐射剂量的差异在CCTA中可能并不具备适用性,并且之前的研究也未探求估算剂量差异的影响因素[7-9]。本研究旨在评估SSDEdeff和SSDEdw估算值在CCTA检查中的估算差异,并探讨其影响因素。
资料与方法1.一般资料:本研究为回顾性分析,从衢州市人民医院影像归档和通信系统(picture archiving and communication systems, PACS)中检索于2018年3月至5月行CCTA检查的患者共114例。纳入标准:心率<65次/min。排除标准:冠状动脉支架植入术后;机械瓣膜置换手术史;既往有冠状动脉旁路移植术;扫描范围中心层面图像存在体表金属或未完全包括解剖结构。最终,共90例患者纳入研究,其中男性54例,女性36例,年龄33~87岁,中位年龄63岁,体质量指数(body mass index,BMI) 15.56~29.41 kg/m2,平均(23.28±2.97)kg/m2。
2. CCTA扫描方法:使用日本东芝Aquilion ONE ViSON 320排CT。所有患者心率≤ 65次/min,采用成人CCTA前瞻性心电触发单心动周期轴扫描模式,采集时相73%~77% R-R间期。管电压100 kV,使用自动曝光控制技术(automatic exposure control: SURE Exposure 3D),配合使用自适应迭代重建(adaptive iterative reconstruction 3D, AIDR 3D)技术, 噪声水平27 HU。探测器组合分别为240 × 0.5 mm、256 × 0.5 mm、280 × 0.5 mm和320 × 0.5 mm,对应120、128、140和160 mm的z轴扫描范围,实际扫描范围根据个体患者气管隆突下1 cm至心脏膈面的z轴距离选择某一探测器组合,机架转速为0.275 s/转,扫描视野400 mm × 400 mm,包括横断面所有的解剖结构,采集矩阵512 × 512,重组层厚/层间隔为0.5 mm/0.25 mm。使用双筒高压注射器,以4.5~5.0 ml/s,注射对比剂0.6 ml/kg(350 mgI/ml,碘海醇),随后同速注射生理盐水30 ml。将Surestart监测兴趣区置于扫描范围中心层面的降主动脉,触发阈值为300 HU。
3.数据测量与计算:为了在CCTA检查中准确获取含气肺组织、脂肪、软组织、骨骼及被强化的心腔血管的X射线衰减信息和扫描范围的SSDE,测量并计算dw的横断面图像需要包括扫描区域所有解剖结构,并且层厚适当[6]。在CCTA源图像层厚/层间隔为0.5 mm/0.25 mm的基础上,采用显示视野等同扫描视野的方式,重组层厚/层间隔为5 mm/5 mm,并包括所有解剖结构的横断面图像,以获取CCTA扫描中横断面所有组织结构对X射线的整体衰减信息。选取中心层面图像导入Mimics套装软件(比利时Materialise公司),通过阈值分割,结合补洞、保持外形最大化和蒙片编辑技术提取横断面图像轮廓,记录Mimics自动报告的横断面图像平均CT值和总像素数量。利用径线测量工具,获取图像的前后径(AP,cm)和左右径(LAT,cm)。通过设置不同的阈值分割范围提取低衰减特性的含气肺组织、较低衰减特性的脂肪、较高衰减特性的软组织和高衰减特性的骨骼和强化的心腔血管,其面积和平均CT值分别记为Arealow、SIlow;Areafat、SIfat;Areasoft、SIsoft;Areahigh、SIhigh。
参照AAPM 204[5]及220号[6]报告进行相关数据计算:
| $ d_{\mathrm{eff}}=\sqrt{A P \times L A T} $ | (1) |
| $ d_{\mathrm{w}}=2 \sqrt{\left(\frac{\mathrm{CT}_{\mathrm{ROI}}}{1000}+1\right) \cdot \frac{A_{\mathrm{ROI}}}{\pi}} $ | (2) |
| $ A_{\mathrm{ROI}}=N \times A_{\mathrm{pixel}} $ | (3) |
| $ f=4.378094 \times \exp (-0.04331124 \times d) $ | (4) |
| $ S S D E=f \times C T D I_{\mathrm{vol}} $ | (5) |
式中:deff为有效直径;AP和LAT分别为图像的前后径和左右径;dw为水当量直径;CTROI和AROI分别为横断面图像的平均CT值和横断面积;N为像素数量;Apixel为单个像素面积;f为有效直径或水当量直径的体型转换系数;SSDE为根据有效直径或水当量直径计算的体型特异性剂量估算值;CTDIvol为剂量报告显示的容积CT剂量指数。
根据体型特异性剂量估算值的计算方法将数据结果分为A组和B组。A组,基于deff计算SSDE,SSDEdeff=fdeff×CTDIvol;B组,基于dw计算SSDE,SSDEdw=fdw×CTDIvol。计算体模直径与中心层面图像deff或dw的差值,记为Δ32d(cm)。计算SSDEdeff和SSDEdw的相对误差=(SSDEdw-SSDEdeff)×100%/SSDEdw,平均绝对相对误差值(mean absolute relative difference, MARD)计算方法为SSDEdeff与SSDEdw的相对误差取绝对值后的平均值,评估两种方法估算CT冠状动脉成像的辐射剂量差异。
4.图像质量评价:根据国际心血管CT学会(Society of Cardiovascular Computed Tomography, SCCT)冠状动脉18段分法[14],由两名经验丰富的医师评估冠状动脉树,重度钙化、闭塞远端及直径<2 mm的血管段不做评估。评分标准分位4个级别:1级图像质量优秀,图像噪声小,冠状动脉无伪影,血管段边缘锐利清晰;2级图像质量良好,图像噪声较小,轻度伪影,血管段边缘清晰;3级图像中等,图像噪声较大,有伪影,轻度影响管壁显示;4级图像质量为差,图像噪声严重,重度伪影,血管段无法评估。以图像质量中等以上认为满足诊断图像质量要求。
5.统计学处理:数据分析使用SPSS 22.0统计软件。计数资料以频数或百分比表示。计量资料进行Shapiro\|Wilk正态性检验,CTDIvol、SSDEdeff和SSDEdw还需进行Levene方差齐性检验,符合正态分布以(x±s)表示,偏态分布以中位数(四分位间距)[M(Q1, Q3)]表示。使用配对样本t检验比较两组的Δ32d、体径;使用Wilcoxon符号秩检验比较两组的SSDE。比较CTDIvol、SSDEdeff和SSDEdw的差异使用Friedman分析。正态分布的双变量相关性使用Pearson相关分析,偏态分布则使用Spearman相关分析,双变量相关程度使用最小二乘法线性回归分析。使用多元逐步线性回归分析各独立因素对平均绝对相对误差值的影响。P<0.05为差异有统计学意义。
结果1.图像质量:除外解剖变异、重度钙化和2 mm以下的血管段,共评估血管段1 357段,所有血管段均满足诊断要求,其中1级血管段为71.19%(966/1 357),2级血管段为24.47%(332/1 357),3级血管段4.34%(59/1 357);未出现4级血管段。
2.辐射剂量及其相关参数:所有检查均顺利完成,图像满足诊断要求,共测量90个层面的横断面图像。其中2个层面的deff>32 cm,88个层面的deff<32 cm;所有层面的dw<32 cm。两组的Δ32d、体径、SSDE差异均具有统计学意义(t=-18.118、18.118,Z=-8.186, P<0.05),见表 1。所有患者的M(Q1, Q3),CTDIvol为9.10(8.80,9.43)mGy,SSDEdeff为12.34(11.75, 12.98)mGy,SSDEdw为13.78(13.02,15.04)mGy,CTDIvol较SSDEdeff和SSDEdw低约26.26%(7.75%~43.49%)和33.96%(15.65%~48.80%)。三者之间的差异具有统计学意义(χ2=176.089, P<0.05)。SSDEdeff较SSDEdw低约10.45%。
|
|
表 1 两组行CT冠状动脉成像检查的患者体型特异性剂量估算值的相关参数(x±s) Table 1 Relevant parameters of size-specific dose estimates of groupsAand B(x±s) |
3.体型特异性剂量估算值与体型的相关性:SSDEdeff、SSDEdw与BMI均呈负相关(r=-0.765、-0.680,P<0.05)。SSDEdeff、SSDEdw与dw均呈负相关(r=-0.700、-0.840,P<0.05)。deff、dw与BMI均呈正相关(r=0.869、0.823,P<0.05,图 1)。
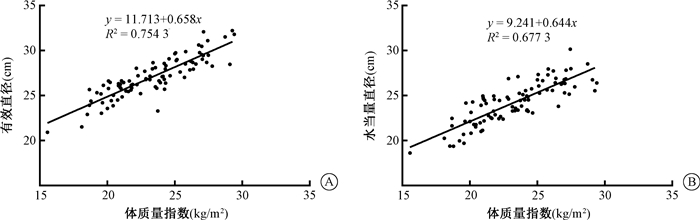
|
图 1 90例患者体质量指数与有效直径和水当量直径的散点图 A.体质量指数与有效直径;B.体质量指数与水当量直径 Figure 1 Scatter plots of two variables for 90 patients A. Body mass index vs. effective diameter; B. Body mass index vs. water equivalent diameter |
4. MARD与体型的相关性及影响因素:总体MARD为11.39%。MARD与BMI相关性无统计学意义(P>0.05)。MARD与deff呈正相关(r=0.251, P<0.05),与dw呈负相关(r=-0.379,P<0.05,图 2)。独立因素影响MARD的多元逐步线性回归分析显示,SIhigh、Areafat、SIfat和SIsoft未进入回归方程,Arealow、Areasoft与MARD均独立正相关(β=0.634、0.102,P<0.05),Areahigh、SIlow均与MARD独立负相关(β=-0.234、-0.343,P<0.05)。
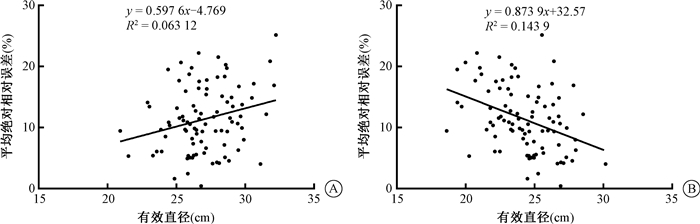
|
图 2 90例患者体径与体型特异性剂量估算值的平均绝对相对误差值的散点图 A.有效直径与体型特异性剂量估算值的平均绝对相对误差值;B.水当量直径与体型特异性剂量估算值的平均绝对相对误差值 Figure 2 Scatter plots of two variables for 90 patients A. Effective diameter vs. mean absolute relative difference of size-specific dose estimate; B. Water equivalent diameter vs.mean absolute relative difference of size-specific dose estimate |
讨论
CCTA检查以较小的视野显示冠状动脉,但由于显示野没有完整包括所有解剖结构,并且层厚/层间隔为0.5 mm/0.25 mm的重建参数也不符合AAPM 220报告所建议的计算SSDE的图像要求[6],据此计算的deff和dw都将显著低于实际值,从而可能导致SSDE高估。此外,显示野外的解剖结构也是接受X射线照射,需要纳入扫描区域解剖结构的X射线衰减信息。因此,本研究以400 mm×400 mm的扫描视野采集数据,且图像的测量与分析均基于整个胸部层面,确保能包括横断面所有的解剖结构,为SSDE准确计算提供影像基础。而在实际工作中,扫描参数的设定必须保证图像质量满足诊断要求的临床要务。本研究采用比常规大的扫描野,潜在影响图像质量,但结果显示血管段图像均能满足临床诊断。
CTDIvol以既定的参数,通过扫描直径16或32 cm的聚甲基丙烯酸甲酯标准体模获取。体模为均质性结构,而人体各种解剖结构对X射线的衰减具有差异性,并且体模直径大于多数患者的实际体径deff和dw。因此,体模并不能真实表示患者的体型,CTDIvol较大的低估患者CT检查的辐射剂量[8, 10-12]。本研究CTDIvol分别较SSDEdeff和SSDEdw低估约26.26%和33.96%。相比较CTDIvol,SSDE有效提高了估算辐射剂量的准确性[5-6, 8, 13]。但在胸部CT扫描中SSDEdeff比SSDEdw有较明显的低估[7-9, 14-15]。本研究CCTA扫描范围不同于胸部检查,但SSDEdeff仍较SSDEdw低估,与胸部的体模实验和临床研究结果相近[7, 16-18]。这可能与CCTA检查中,尽管由于心脏的存在,但含气的肺组织依然占横截面较大比例有关。由于deff仅有几何维度信息,SSDEdeff实际低估了CCTA检查患者的辐射剂量,而dw补充了deff缺少的衰减信息,SSDEdw对辐射剂量的估算更合理,也更准确,并且相关研究[8, 19-20]也多以SSDEdw展开,并以其为基值计算扫描范围内受照射器官的辐射剂量。
患者辐射剂量受体型相关因素,如BMI、体径、横截面积、组织结构分布及对X射线衰减等的影响[5-6]。与之前的研究[8, 11-12]不同,本研究结果,无论以BMI或dw作为体型指标,SSDEdeff和SSDEdw均伴随体型增大而减小。这可能与迭代重建技术在相对较低的辐射剂量水平下就可保证较大体型患者的图像质量有关,同时也受到f与体型负指数函数关系的影响。而SSDEdeff和SSDEdw均与dw和BMI负相关,表现为一致性的变化方向则可能为dw与BMI的正向变化所导致。
估算辐射剂量的准确性受体型指标影响。但BMI作为体型指标仅能解释67.73%的dw变化,导致其并不显著影响MARD。与此不同,deff和dw显著影响MARD。MARD与deff正相关,与dw负相关。因此,可以预期,随着deff的降低或dw的持续增大,SSDEdeff与SSDEdw在deff或dw的某一临界值,两种估算剂量存在等同的可能,SSDEdeff可发挥其简便的优势,替代SSDEdw表征患者接受的辐射剂量。在影响MARD的诸多因素中,Arealow具有最高的回归系数β,是MARD的最重要影响因素,而SIlow、Areahigh、Areasoft的回归系数逐个降低,对MARD的影响渐次减弱,SIhigh、Areafat、SIfat和SIsoft未进入回归方程,对MARD并不产生显著影响。在具体的影响上,随着Arealow和Areasoft在总体组织结构中的比例增加,MARD增加。由此,肺气肿患者CCTA检查可能具有更高MARD的风险,而成年女性由于乳腺的原因导致Areasoft增加,其估算剂量的MARD可能更低。其他的MARD影响因素,SIlow和Areahigh均与MARD呈反向关系,低衰减结构CT值增加和高衰减结构面积的增加将促进MARD降低。但CCTA检查中低衰减结构主要为含气肺组织,其CT值相对稳定。临床实际中SIlow可能并不对MARD产生明显的影响。而CCTA检查人群的体型、体脂分布、心脏形态多有较大波动,加之实时扫描中屏气状态的原因,中心层面充盈对比剂的心腔面积将可能出现较大的变化直接影响Areahigh的波动。因此,CCTA检查对比剂的引入可能会是临床中影响MARD较明显的因素。而具体到疾病中,引起心腔增大如扩张型心肌病等,其CCTA检查估算剂量的MARD可能更小。而肺气肿患者多为滴状心,心腔面积较小,可能进一步加大CCTA检查Arealow所致的高MARD风险。
本研究存在以下不足。首先,数据来源于一种CT机型,结果是否适用于其他CT设备尚不确定。其次,因受限于探测器的锥形束效应,扫描范围首尾两侧未能完全包括解剖结构,本研究仅使用中心层面估算辐射剂量,但其估算剂量与利用全层面估算的辐射剂量相近[5, 9-10]。
总之,CCTA检查的体型特异性剂量估算值,SSDEdeff较SSDEdw低估,对比剂引入造成高衰减面积的增加可能影响两种辐射剂量估算的差异,但含气肺组织的低衰减结构面积占比是最重要的影响因素。
利益冲突 全体作者无利益冲突,进行该项研究未接受任何不正当职务及财务获益,并对本研究的独立性和科学性予以保证作者贡献声明 徐健负责研究设计、数据统计分析、论文撰写;何小龙、方焕新、王相权负责文献整理和数据处理; 毛德旺负责研究方案的指导、审核、论文指导及校对
| [1] |
Alhailiy AB, Kench PL, McEntee MF, et al. Establishing diagnostic reference levels for cardiac computed tomography angiography in Saudi Arabia[J]. Radiat Prot Dosim, 2018, 181(2): 129-134. DOI:10.1093/rpd/ncx306 |
| [2] |
Mafalanka F, Etard C, Rehel JL, et al. Establishment of diagnostic reference levels in cardiac CT in France:a need for patient dose optimisation[J]. Radiat Prot Dosim, 2015, 164(1-2): 116-119. DOI:10.1093/rpd/ncu317 |
| [3] |
Geisel D, Zimmermann E, Rief M, et al. DNA double-strand breaks as potential indicators for the biological effects of ionising radiation exposure from cardiac CT and conventional coronary angiography:a randomised, controlled study[J]. Eur Radiol, 2012, 22(8): 1641-1650. DOI:10.1007/s00330-012-2426-1 |
| [4] |
Leng S, Shiung M, Duan X, et al. Size-specific dose estimates for chest, abdominal, and pelvic CT:effect of intrapatient variability in water-equivalent diameter[J]. Radiology, 2015, 276(1): 187-190. DOI:10.1148/radiol.15142160 |
| [5] |
American Association of Physicists in Medicine. Report of AAPM TG 204: size-specific dose estimates (SSDE) in pediatric and adult body CT examinations[R]. Alexandria: AAPM, 2011: 1-22.
|
| [6] |
American Association of Physicists in Medicine. Report of APPM TG 220: use of water equivalent diameter for calculating patient size and size-specific dose estimates (SSDE) in CT[R]. Alexandria: AAPM, 2014: 1-23.
|
| [7] |
袁子龙, 王国柱, 张照喜, 等. 比较不同体型特异性剂量评估算法在估算成人胸腹部CT扫描中辐射剂量的差异[J]. 中华放射医学与防护杂志, 2016, 36(11): 852-856. Yuan ZL, Wang GZ, Zhang ZX, et al. Comparison of different SSDE methods in evaluating the radiation dose in chest and abdomen CT scan[J]. Chin J Radiol Med Prot, 2016, 36(11): 852-856. DOI:10.3760/cma.j.issn.0254-5098.2016.11.011 |
| [8] |
Gabusi M, Riccardi L, Aliberti C, et al. Radiation dose in chest CT:assessment of size-specific dose estimates based on water-equivalent correction[J]. Phys Med, 2016, 32(2): 393-397. DOI:10.1016/j.ejmp.2015.12.008 |
| [9] |
Boos J, Kröpil P, Bethge OT, et al. Accuracy of size-specific dose estimate calculation from center slice in computed tomography[J]. Radiat Prot Dosim, 2018, 178(1): 8-19. DOI:10.1093/rpd/ncx/069 |
| [10] |
Kidoh M, Utsunomiya D, Oda S, et al. Validity of the size-specific dose estimate in adults undergoing coronary CT angiography:comparison with the volume CT dose index[J]. Int J Cardiovasc Imaging, 2015, 31(Suppl 2): 205-211. DOI:10.1007/s10554-015-0782-z |
| [11] |
Smith-Bindman R, Moghadassi M, Wilson N, et al. Radiation doses in consecutive CT examinations from five University of California Medical Centers[J]. Radiology, 2015, 277(1): 134-141. DOI:10.1148/radiol.2015142728 |
| [12] |
Christner JA, Braun NN, Jacobsen MC, et al. Size-specific dose estimates for adult patients at CT of the torso[J]. Radiology, 2012, 265(3): 841-847. DOI:10.1148/radiol.12112365 |
| [13] |
Moore BM, Brady SL, Mirro AE, et al. Size-specific dose estimate (SSDE) provides a simple method to calculate organ dose for pediatric CT examinations[J]. Med Phys, 2014, 41(7): 071917. DOI:10.1118/1.4884227 |
| [14] |
Leipsic J, Abbara S, Achenbach S, et al. SCCT guidelines for the interpretation and reporting of coronary CT angiography:a report of the Society of Cardiovascular Computed Tomography Guidelines Committee[J]. J Cardiovasc Comput Tomogra, 2014, 8(5): 342-358. DOI:10.1016/j.jcct.2014.07.003 |
| [15] |
Valeri G, Cegna S, Mari A, et al. Evaluating the appropriateness of dosimetric indices in body CT[J]. Radiol Med, 2015, 120(5): 466-473. DOI:10.1007/s11547-014-0476-y |
| [16] |
Wang J, Duan X, Christner JA, et al. Attenuation-based estimation of patient size for the purpose of size specific dose estimation in CT. Part I. Development and validation of methods using the CT image[J]. Med Phys, 2012, 39(11): 6764-6771. DOI:10.1118/1.4754303 |
| [17] |
Wang J, Christner JA, Duan X, et al. Attenuation-based estimation of patient size for the purpose of size specific dose estimation in CT. Part Ⅱ. Implementation on abdomen and thorax phantoms using cross sectional CT images and scanned projection radiograph images[J]. Med Phys, 2012, 39(11): 6772-6778. DOI:10.1118/1.4757586 |
| [18] |
Bostani M, McMillan K, Lu P, et al. Attenuation-based size metric for estimating organ dose to patients undergoing tube current modulated CT exams[J]. Med Phys, 2015, 42(2): 958-968. DOI:10.1118/1.4906132 |
| [19] |
zsoykal I·, Yurt A, Akgüngör K. Size-specific dose estimates in chest, abdomen, and pelvis CT examinations of pediatric patients[J]. Diagn Interv Radiol, 2018, 24(4): 243-248. DOI:10.5152/dir.2018.17450 |
| [20] |
Choirul Anam, Freddy Haryanto, Rena Widita, et al. Dose-volume product (DVP) as descriptor for estimating total energy imparted to patient undergoing CT examination[J]. J Med Phys Biop, 2016, 3(1): 45-55. |
 2019, Vol. 39
2019, Vol. 39


