2. 山东大学附属山东省肿瘤医院放疗科, 济南 250117;
3. 山东大学附属山东省肿瘤医院核医学科, 济南 250117;
4. 山东大学附属山东省肿瘤医院乳腺外科, 济南 250117
2. Department of Radiation Oncology, Shandong Cancer Hospital Affiliated to Shandong University, Jinan 250117, China;
3. Department of Nuclear Medicine, Shandong Cancer Hospital Affiliated to Shandong University, Jinan 250117, China;
4. Department of Breast Surgery, Shandong Cancer Hospital Affiliated to Shandong University, Jinan 250117, China
内乳淋巴结(internal mammary lymph node,IMLN)作为乳腺癌淋巴引流的第一站淋巴结[1],是乳腺癌转移的重要途径之一[2]。内乳区预防性照射可以降低复发率及远处转移率,提高患者的生存率[3]。目前,IMLN照射的最佳靶区范围尚存争议,而且区域淋巴结照射靶区范围相关研究,多数是依据转移淋巴结中心点分布范围界定靶区范围[4-6],但转移淋巴结通常是各向异性不均匀生长的,而且转移淋巴结自身及其周围解剖结构可能存在变异,使得转移淋巴结的中心点不能真正代表淋巴结的中心,而临床检查阴性患者SPECT/CT显像的内乳前哨淋巴结(internal mammary sentinel lymph node, IM-SLN)则不同于临床转移淋巴结,可以代表IMLN真正的位置。本研究拟基于SPECT/CT同机融合显像的IM-SLN位置分布,探讨内乳淋巴引流区预防性照射的靶区范围。
资料与方法1.临床资料:收集2014年1月至2018年4月行术前内乳前哨淋巴结SPECT/CT显像检查的乳腺癌女性患者709例,筛选符合入组标准且临床资料完整的患者进行回顾性研究。入组条件:①病理学初次诊断为乳腺癌且未行术前新辅助治疗的患者。②术前影像学检查显示内乳淋巴结阴性。③术前行内乳区前哨淋巴结SPECT/CT显像检查且显像阳性者。共入组病例97例,年龄21~66岁(平均年龄45.9岁)。肿瘤位于左侧乳腺者48例,位于右侧乳腺者49例;位于乳腺内侧者28例,位于中央区者16例,位于外侧者53例。
2. SPECT/CT扫描与图像采集:患者于显像前3~16 h利用一点法或两点法,于原发肿瘤周围皮下注射0.3~0.5 ml99Tcm-SC显像剂(北京师宏药业公司),放射性活度为18.5~37.0 MBq。采用飞利浦Brightview XCT型SPECT仪,配低能高分辨准直器,矩阵为256×256,放大倍数为1倍。患者取仰卧位,双臂上举,分别行前位及患侧侧位显像。采集完成后采用专用后处理软件进行同机融合。将除注射点以外部位的出现放射性浓集点定义为IM-SLN显像阳性。将平面显像图像中位于注射点内侧或内上方的放射性浓集点定义为内乳前哨淋巴结阳性,在SPECT/CT同机融合图像将胸骨旁出现的放射性浓集点定义为IM-SLN核素检查显像阳性。
3. IM-SLN中心坐标点的确定及投影:选择1例保乳术后拟行放疗患者作为标准患者,行增强CT模拟定位扫描,患者取仰卧位,双臂上举,扫描层厚3 mm。将标准患者的增强CT扫描图像与所有入组患者的SPECT/CT图像传至MIM软件系统。勾画出患侧显像的IM-SLN,MIM软件系统自动定位到靶区中心坐标点并标记为IM-SLN的中心点。利用MIM系统形变配准工具将所有标记的IM-SLN中心点投影至同一保乳术后患者的增强CT模拟定位图像相应解剖位置上,获取IM-SLN中心点肋间位置分布,将肋间定义为上一肋的上缘到下一肋的上缘,位于肋骨后方的IM-SLN归于该肋的肋间隙中。基于文献报道内乳IM-SLN的平均直径为5 mm[7],将IM-SLN的中心点均匀外扩,获取直径为5 mm IM-SLN的位置分布。
4.内乳淋巴引流区靶区勾画:在已投影IM-SLN的保乳术后增强CT扫描模拟定位图像上,分别根据放射治疗肿瘤协作组(RTOG)和丹麦乳腺癌合作小组(DBCG)指南勾画内乳淋巴引流区临床靶区(clinical target volume, CTV),并分别定义为CTVRTOG和CTVDBCG。将CTVRTOG和CTVDBCG分别进行外扩,外扩范围每次递增1 mm,直至外扩靶区可以覆盖全部IM-SLN中心点及5 mm直径IM-SLN,将外扩后形成的CTVRTOG和CTVDBCG定义为CTVR中心点、CTVD中心点和CTVR5 mm、CTVD5 mm。
5.统计学处理:采用SPSS 22.0软件进行统计分析。对IM-SLN的位置分布、CTVR中心点、CTVD中心点、CTVR5 mm和CTVD5 mm等计量资料进行统计描述,经正态性检验符合正态分布,采用配对t检验的方法比较CTVR中心点、CTVD中心点、CTVR5 mm和CTVD5 mm到IM-SLN距离的差异。P<0.05为差异有统计学意义。
结果1. IM-SLN位置分布:65枚IM-SLN位于胸骨左侧,71枚位于胸骨右侧。位于第1~5肋间的IM-SLN个数分别为55(40.4%)、41(30.2%)、33(24.3%)、6(4.4%)和1(0.7%)枚,前3肋间IM-SLN数占总数的94.9%。
2.基于RTOG与DBCG指南勾画靶区与IM-SLN距离比较:CTVRTOG边缘到IM-SLN中心点及5 mm直径IM-SLN外侧缘的平均距离分别为4.10 mm(95%CI 3.54~4.65 mm)、6.40 mm (95%CI 5.81~6.98 mm)(t=-30.486,P<0.05)。CTVDBCG边缘到IM-SLN中心点及5 mm直径IM-SLN外侧缘的平均距离分别为1.60 mm (95%CI 1.16~ 2.05 mm)、3.34 mm (95%CI 2.78~ 3.89 mm)(t=-16.364,P<0.05)。CTVRTOG边缘到IM-SLN中心点及5 mm直径IM-SLN外侧缘的平均距离均明显大于CTVDBCG(t=16.640、19.815,P<0.05)。
3. CTVRTOG与IM-SLN的位置关系:基于RTOG指南勾画的CTVRTOG(沿内乳动、静脉边缘),分别包含18.4%和5.1%的IM-SLN中心点及5 mm直径IM-SLN。CTVRTOG分别外扩5、6、8和15 mm,CTVR中心点能够覆盖70%、80%、90%、100%的IM-SLN中心点。CTVRTOG分别外扩8、9、11和17 mm,CTVR5 mm能够覆盖70%、80%、90%、100%的IM-SLN。CTVRTOG与IM-SLN位置关系见图 1。
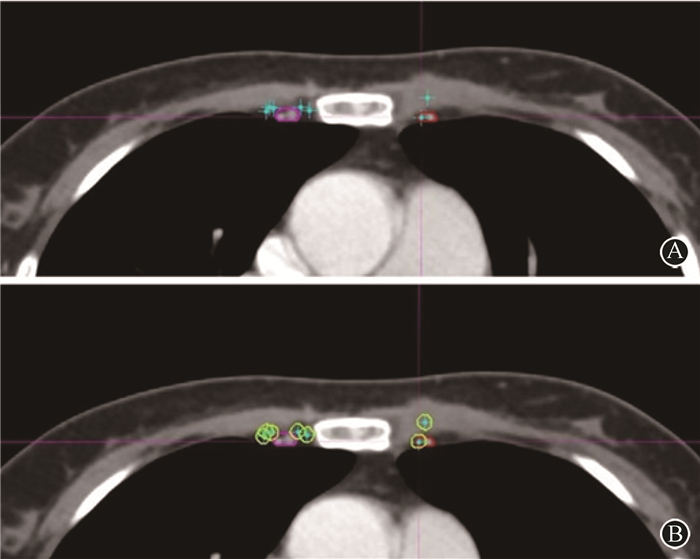
|
图 1 CTVRTOG与IM-SLN位置关系断层图 A. CTVRTOG与IM-SLN中心点位置关系;B. CTVRTOG与5 mm直径IM-SLN位置关系 Figure 1 Tomography of the position relationship between CTVRTOG and IM-SLNs A. The position relationship between CTVRTOG and center points of IM-SLNs; B. The position relationship between CTVRTOG and IM-SLNs with a diameter of 5 mm |
4. CTVDBCG与IM-SLN的位置关系:基于DBCG指南勾画的CTVDBCG(外侧界沿内乳血管脉外扩5 mm,内侧界为胸骨,前界为胸大肌后缘或胸骨后缘,后界为胸膜),对IM-SLN中心点和5 mm直径IM-SLN的覆盖率分别为60.3%和27.9%。CTVDBCG分别外扩2、3、5和13 mm时,CTVD中心点分别可以覆盖70%、80%、90%、100%的IM-SLN中心点。CTVDBCG分别外扩至5、6、7和16 mm时,CTVD5 mm分别能够覆盖70%、80%、90%、100%的5 mm直径IM-SLN。CTVDBCG与IM-SLN位置关系见图 2。
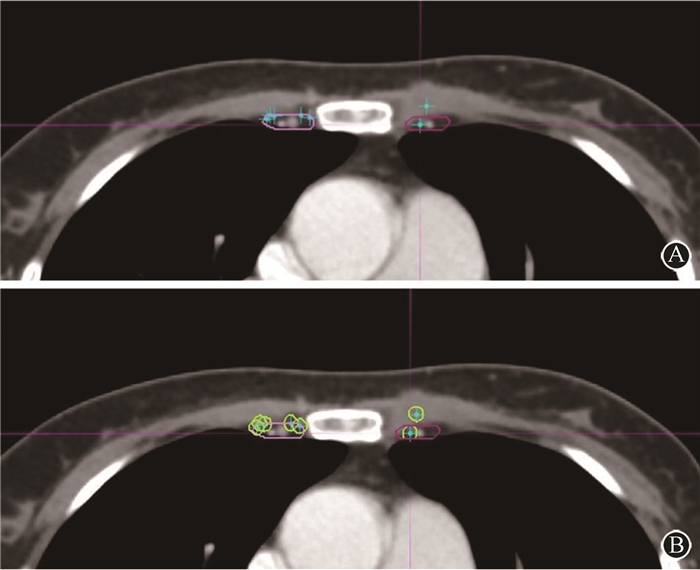
|
图 2 CTVDBCG与IM-SLN位置关系断层图 A. CTVDBCG与IM-SLN中心点位置关系;B. CTVDBCG与5 mm直径IM-SLN位置关系 Figure 2 Tomography of the position relationship between CTVDBCG and IM-SLNs A. The position relationship between CTVDBCG and center points of IM-SLNs; B. The position relationship between CTVDBCG and IM-SLNs with a diameter of 5 mm |
讨论
早年人们对乳腺癌患者IMLN照射广泛认可,原因是基于乳腺癌扩大根治术后病理发现IMLN相对高的转移率[8-10],但这种病理学IMLN转移率与实际临床IMLN复发率并不对等,再加之早年相对落后的放疗技术使得IMLN照射者的心肺不良反应发生率相对较高,致使人们在相当长的时间内对待IMLN照射较为谨慎[11],但近年来多个随机分组研究结果显示,包括IMLN在内的区域淋巴结照射可以显著提高患者的DFS[12-13],而且有研究下实IMLN照射具有显著的远期生存优势[3],因此,近年来IMLN照射又被广泛接受。尽管目前IMLN照射取舍多以腋淋巴结(ALN)状态和原发肿瘤部位为依据,但基于内乳前哨淋巴结显影状态进行IMLN照射指导似乎更为合理[4]。
靶区确定是IMLN照射的关键环节,但RTOG、DBCG、欧洲放射肿瘤学大会(ESTRO)、乳腺癌项目(PROCAB)所提出的IMLN照射靶区(CTV)并不一致[15-18],就照射肋间范围而言,DBCG提出IMLN的照射范围应当包括前4个肋间,而其余4个勾画指南则均包括前3个肋间。临床上除个例外均选择包括前3个肋间,一方面基于扩大根治术后所见,另一方面,治疗后IMLN复发位置分布也支持照射1~3肋间的选择[12]。实际上IM-SLN位置分布也支持1~3肋间作为IMLN照射范围的选择[19]。本研究中,位于第1~3肋间的IM-SLN个数分别为55、41、33枚,占IM-SLN总数的94.9%,支持IMLN照射靶区通常仅包括1~3肋间。
关于IMLN照射CTV内外侧边界,RTOG指南是基于内乳血管边缘勾画,而DBCG、ESTRO、PROCAB等指南则是基于内乳血管边缘外扩5 mm勾画。相关研究基于诊断时IMLN转移或治疗后IMLN复发位置分布进行了验证。Jethwa等[20]基于67例诊断时转移或治疗后复发患者的130个IMLN中心点进行了RTOG指南IMLN的CTV内外侧边界验证,结果显示,内外侧IMLN的中心点距内乳血管内外边缘的平均距离分别为2.2和3.6 mm,基于IM血管边界分别向内外侧各扩3、4、5、6和11 mm可以包括位于前3肋间的80%、90%、93%、95%和100%的转移或复发IMLN,因此,作者认为基于RTOG指南即内乳血管内外侧边界分别外扩4 mm构建IMLN的CTV是合理的。本研究结果显示,基于RTOG指南IMLN的CTV即CTVRTOG边缘到IM-SLN中心点及5 mm直径IM-SLN外侧缘的平均距离分别为4.10和6.40 mm,而基于DBCG指南IMLN的CTV即CTVDBCG边缘到IM-SLN中心点及5 mm直径IM-SLN外侧缘的平均距离分别为1.60和3.34 mm。CTVRTOG边缘到IM-SLN中心点及5 mm直径IM-SLN外侧缘的平均距离均明显大于CTVDBCG。因此,无论基于文献报道还是本研究结果,从内外侧外扩距离看,RTOG指南所界定的IMLN靶区内外侧界明显偏小。
从IMLN空间分布的角度,单纯内外侧界外扩并不能完全代表CTV对IMLN的覆盖度,因此,本研究进行了覆盖度与CTV外扩边界大小的比较,结果显示,基于RTOG和DBCG指南所勾画的CTVRTOG和CTVDBCG分别只能覆盖18.4%和60.3%的IM-SLN中心点,对5 mm直径IM-SLN的覆盖率分别仅为5.1%和27.9%。要覆盖90%和100%的IM-SLN中心点,需CTVRTOG分别需外扩8和15 mm,要覆盖90%和100%的5 mm直径IM-SLN,CTVRTOG分别外扩11和17 mm;要覆盖90%和100%的IM-SLN中心点,需CTVDBCG分别外扩5和13 mm时,要覆盖90%和100%的5 mm直径IM-SLN,需CTVDBCG分别外扩7和16 mm时。因此,基于本研究,如果仅考虑IMLN中心点,则IMLN的CTV需在RTOG和DBCG指南所建议的边界外扩8和5 mm,如果考虑IMLN的大小(设定为直径5 mm),则IMLN的CTV需在RTOG和DBCG指南所建议的边界外扩11和7 mm。
目前各种指南关于区域淋巴结照射的靶区范围确定方法均是基于淋巴结的分布并以血管走行结合其他解剖结构作为边界的界定,而关于指南中靶区边界界定合理性的验证研究,文献报道的方法主要是基于复发或转移淋巴结位置相对于指南中所确定的靶区位置分布[5-6, 21]。Brown等[5]基于161个锁骨上转移淋巴结位置分布对RTOG锁上靶区勾画共识方案进行验证,结果发现其中62个(39%)转移淋巴结不在RTOG勾画共识方案所界定的范围内。Jing等[3]基于50例锁骨上淋巴结转移位置分布对RTOG等4个锁骨靶区勾画共识方案进行验证,结果发现,4个勾画方案所覆盖的转移淋巴结数占比为49.2~81.3%。Davidson等[21]基于80例乳腺癌患者FDG PET-CT诊断转移的IMLN(112枚)位置分布发现,基于RTOG内乳靶区内外侧界外扩5 mm可以包括93%的转移淋巴结。从上述研究看,无论锁骨上还是内乳,RTOG等指南所界定的靶区范围均不足以覆盖相应区域转移淋巴结分布范围,这种差异,一方面提示相关指南有修改的必要,另一方面也应当考虑,转移淋巴结中心点不一定能代表正常淋巴结的位置。再者,诊断影像与定位图像的配准及淋巴结或其中心点在定位图像上的标注均可产生位置误差。虽然我们的研究是基于SPECT/CT同机融合显像的IM-SLN位置分布,而且利用MIM系统进行形变配准,但仍然不能排除图像配准及位置标注过程中的误差对靶区范围界定的影响。
综上所述,SPECT/CT同机融合显像IM-SLN的分布,内乳淋巴结预防性照射靶区范围包括第1~3肋间是合理的;依据RTOG和DBCG指南所勾画的CTVIMLN对IM-SLN的覆盖率有较大差异,且均不足以覆盖90%的IM-SLN。为更全面地覆盖IMLN,RTOG及DBCG指南均应适当扩大IMLN预防性照射靶区范围, 且不同指南扩大的范围应有所区别。
利益冲突 无作者贡献声明 王雪负责研究的具体实施和论文的撰写;王玮与李建彬参与论文选题与设计;徐敏参与指导内乳靶区勾画;霍宗伟与邱鹏飞参与资料收集与分析
| [1] |
Hassiotou F, Geddes D. Anatomy of the human mammary gland:current status of knowledge[J]. Clin Anat, 2013, 26(1): 29-48. DOI:10.1002/ca.22165 |
| [2] |
Huang O, Wang L, Shen K, et al. Breast cancer subpopulation with high risk of internal mammary lymph nodes metastasis:analysis of 2, 269 Chinese breast cancer patients treated with extended radical mastectomy[J]. Breast Cancer Res Treat, 2008, 107(3): 379-387. DOI:10.1007/s10549-007-9561-4 |
| [3] |
Thorsen LB, Offersen BV, Danø H, et al. DBCG-IMN:A population-based cohort study on the effect of internal mammary node irradiation in early node-positive breast cancer[J]. J Clin Oncol, 2016, 34(4): 314-320. DOI:10.1200/JCO.2015.63.6456 |
| [4] |
Li XA, Tai A, Arthur DW, et al. Variability of target and normal structure delineation for breast cancer radiotherapy:an RTOG multi-institutional and multiobserver study[J]. Int J Radiat Oncol Biol Phys, 2009, 73(3): 944-951. DOI:10.1016/j.ijrobp.2008.10.034 |
| [5] |
Brown LC, Diehn FE, Boughey JC, et al. Delineation of supraclavicular target volumes in breast cancer radiation therapy reply[J]. Int J Radiat Oncol Biol Phys, 2015, 93(3): 723-724. DOI:10.1016/j.ijrobp.2015.06.042 |
| [6] |
Jing H, Wang SL, Li J, et al. Mapping patterns of ipsilateral supraclavicular nodal metastases in breast cancer:rethinking the clinical target volume for high-risk patients[J]. Int J Radiat Oncol Biol Phys, 2015, 93(2): 268-276. DOI:10.1016/j.ijrobp.2015.08.022 |
| [7] |
Cong BB, Cao XS, Cao L, et al. Internal mammary lymph nodes radiotherapy of breast cancer in the era of individualized medicine[J]. Oncotarget, 2017, 8(46): 81583-81590. DOI:10.18632/oncotarget.20186 |
| [8] |
Veronesi U, Valagussa P. Inefficacy of internal mammary nodes dissection in breast cancer surgery[J]. Cancer, 1981, 47(1): 170-175. DOI:10.1002/(ISSN)1097-0142 |
| [9] |
Noguchi M, Ohta N, Thomas M, et al. Risk of internal mammary lymph node metastases and its prognostic value in breast cancer patients[J]. J Surg Oncol, 1993, 52(1): 26-30. DOI:10.1002/(ISSN)1096-9098 |
| [10] |
Huang O, Wang L, Shen K, et al. Breast cancer subpopulation with high risk of internal mammary lymph nodes metastasis:analysis of 2, 269 Chinese breast cancer patients treated with extended radical mastectomy[J]. Breast Cancer Res Treat, 2008, 107(3): 379-387. DOI:10.1007/s10549-007-9561-4 |
| [11] |
Freedman GM, Fowble BL, Nicolaou N, et al. Should internal mammary lymph nodes in breast cancer be a target for the radiation oncologist?[J]. Int J Radiat Oncol Biol Phys, 2000, 46(4): 805-814. DOI:10.1016/S0360-3016(99)00481-2 |
| [12] |
Poortmans PM, Collette S, Kirkove C, et al. Internal mammary and medial supraclavicular irradiation in breast cancer[J]. N Engl J Med, 2015, 373(4): 317-327. DOI:10.1056/NEJMoa1415369 |
| [13] |
Whelan TJ, Olivotto IA, Parulekar WR, et al. Regional nodal irradiation in early-stage breast cancer[J]. N Engl J Med, 2015, 373(4): 307-316. DOI:10.1056/NEJMoa1415340 |
| [14] |
Nikolaevich NS, Vasilevich KS. Why do we need irradiation of internal mammary lymph nodes in patients with breast cancer:Analysis of lymph flow and radiotherapy studies[J]. Rep Pract Oncol Radiother, 2017, 22(1): 37-41. DOI:10.1016/j.rpor.2016.09.012 |
| [15] |
Ma J, Li J, Xie J, et al. Post mastectomy linac IMRT irradiation of chest wall and regional nodes:dosimetry data and acute toxicities[J]. Radiat oncol (London, England), 2013, 8: 81. DOI:10.1186/1748-717X-8-81 |
| [16] |
Nielsen MH, Berg M, Pedersen AN, et al. Delineation of target volumes and organs at risk in adjuvant radiotherapy of early breast cancer:national guidelines and contouring atlas by the Danish Breast Cancer Cooperative Group[J]. Acta Oncol, 2013, 52(4): 703-710. DOI:10.3109/0284186X.2013.765064 |
| [17] |
Offersen BV, Boersma LJ, Kirkove C, et al. ESTRO consensus guideline on target volume delineation for elective radiation therapy of early stage breast cancer, version 1.1[J]. Radiother Oncol, 2016, 118(1): 205-208. DOI:10.1016/j.radonc.2015.12.027 |
| [18] |
Verhoeven K, Weltens C, Remouchamps V, et al. Vessel based delineation guidelines for the elective lymph node regions in breast cancer radiation therapy-PROCAB guidelines[J]. Radiother Oncol, 2016, 118(1): 209-210. DOI:10.1016/j.radonc.2015.12.005 |
| [19] |
Chen L, Gu Y, Leaw S, et al. Internal mammary lymph node recurrence:rare but characteristic metastasis site in breast cancer[J]. BMC cancer, 2010, 10: 479. DOI:10.1186/1471-2407-10-479 |
| [20] |
Jethwa KR, Kahila MM, Hunt KN, et al. Delineation of internal mammary nodal target volumes in breast cancer radiation therapy[J]. Int J Radiat Oncol Biol Phys, 2017, 97: 762-769. DOI:10.1016/j.ijrobp.2016.11.037 |
| [21] |
Davidson T, Ben-David M, Galper S, et al. Use of 18F-FDG PET-CT imaging to determine internal mammary lymph node location for radiation therapy treatment planning in breast cancer patients[J]. Pract Radiat Oncol, 2017, 7(6): 373-381. DOI:10.1016/j.prro.2016.11.001 |
 2019, Vol. 39
2019, Vol. 39


