食管癌是常见的消化道恶性肿瘤之一,但接受手术治疗的食管癌患者总体生存仍较差,其5年生存率一般在20%~30%[1-2],且约有63%的食管癌患者在根治术后2年内出现转移或局部复发[3]。近年来的多个研究发现,与单纯手术相比,术前新辅助治疗能够明显改善局部晚期的食管癌患者的预后[4-5]。最近的研究发现术前新辅助放疗较单纯手术组能够改善T3N0期食管癌患者的预后[6]。但是新辅助放疗与术后辅助放疗对T3N0期食管癌预后的影响尚不明确。本研究通过对美国SEEE数据库资料的分析,对SEEE数据库中接受新辅助放疗和术后辅助放疗对T3N0期食管癌患者的疗效进行了比较。
资料与方法1.临床资料:本研究的患者资料来源于美国SEER18数据库2004—2014年收录的术前或术后行放疗的食管癌根治术患者信息,占包括了美国约28%人口的肿瘤数据。本研究纳入标准:①原发部位为食管的恶性肿瘤。②诊断时间为2004—2014年。③术前接受新辅助放疗或术后接受辅助放疗的患者。④接受食管癌手术。⑤病理分期为T3N0期的患者。排除标准:①合并其他恶性肿瘤。②远处转移。③60 d内死亡。④没有接受化疗治疗的患者。这项研究是基于SEER数据库公开的临床资料,并且本组已经获准使用SEER数据库(15457-Nov2016),因此不需要知情同意。此外,本研究已经获得了淮安市第一人民院伦理委员会的批准。
2. SEER数据库中收集的患者资料:诊断时的年龄、性别、种族、病理类型、分化程度、切除淋巴结数目、放疗与手术的顺序、是否接受化疗、手术类型、随访时间及生存状态。根据放疗与手术的顺序分为新辅助放疗组和辅助放疗组。其他因素分组:根据诊断时的年龄分为>60岁与≤60岁两组;根据种族分为白人与其他种族;根据确诊时间分为2004—2009年组及2010—2014年组;根据病理类型分为腺癌、鳞癌及其他病理类型3个组;根据分化程度分期分为G1~2、G3及未分化组。其临床资料见表 1。
|
|
表 1 555例食管癌患者的一般临床资料比较 Table 1 The comparison of clinical data of 555 patients with esophageal cancer |
3.统计学处理:采用SPSS 20.0软件进行统计。χ2检验分析组间临床因素的差异,用Log-rank法分析组间及各亚组的肿瘤特性生存率及总体生存率的差异;多因素Cox回归中使用log-rank分析临床各因素与预后的关联性。P < 0.05为差异有统计学意义。除了R语言用来进行1:1倾向匹配分析外,其他分析均采用SPSS22.0统计软件完成。
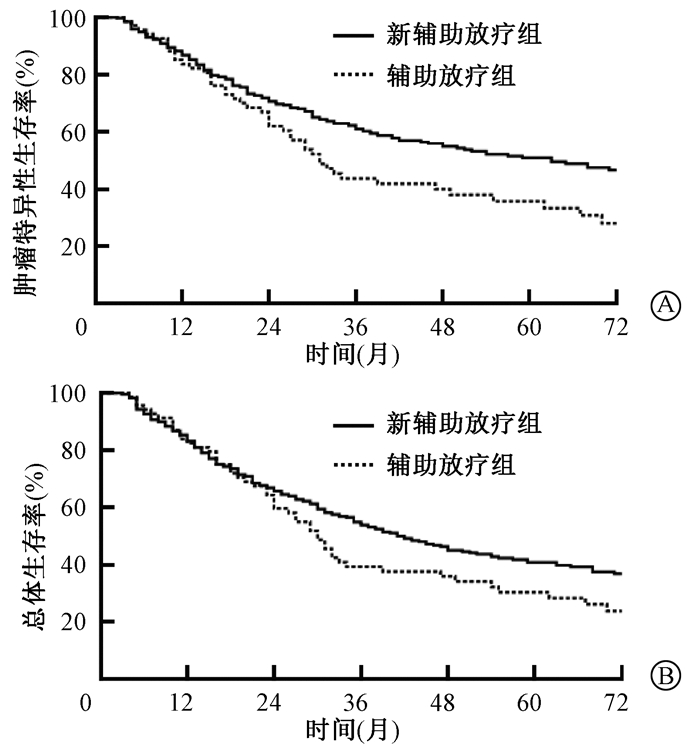
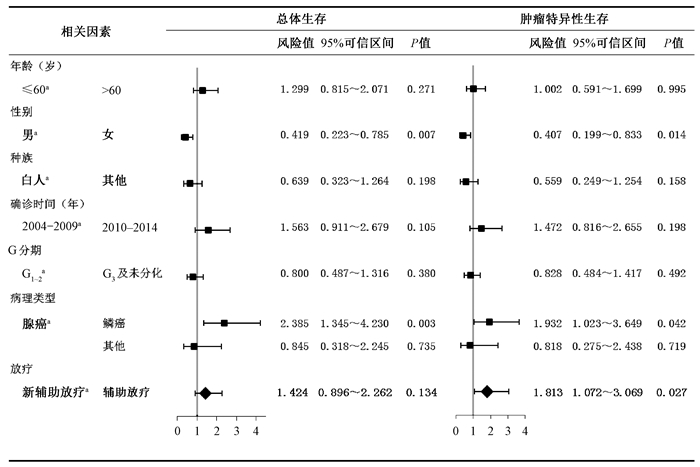
结果1.新辅助放疗与辅助放疗对食管癌患者预后的影响:新辅助放疗组食管癌患者5年肿瘤特异性生存及总体生存分别为40.8%和50.9%,辅助放疗组食管癌患者5年肿瘤特异性生存及总体生存分别为30.3%和35.7%。新辅助放疗组患者总体生存好于辅助放疗组,但差异无统计学意义(P>0.05);而新辅助放疗组肿瘤特异性生存明显优于辅助放疗组(χ2=6.030,P<0.05, 图 1)。多因素Cox回归分析提示,年龄、性别及放疗顺序是影响T3N0食管癌患者肿瘤特异性预后的重要因素(Wald值分别为10.099、10.562、4.331,P<0.05),而性别及肿瘤类型是影响T3N0食管癌患者总预后的重要因素(Wald值分别为7.361、9.195,P<0.05)。其中辅助放疗组肿瘤特异性死亡风险及总体死亡风险分别是新辅助放疗组的1.649(95%CI 1.173~2.316,P=0.004)倍、1.402(95%CI 1.020-1.928,P=0.037)倍(图 2)。
|
图 1 两组食管癌患者的肿瘤特异性生存及总体生存的对比 A.肿瘤特异性生存的对比(χ2=6.030,P < 0.05);B.总体生存的对比(P>0.05) Figure 1 Comparison of tumor specific survival (CSS) and overall survival (OS) in two groups of esophageal cancer patients A. Comparison of CSS(χ2=6.030, P < 0.05); B. Comparison of OS(P>0.05) |

|
图 2 影响T3N0期食管癌患者预后的多因素Cox回归分析a为对照参考 Figure 2 Multivariate Cox regression analysis of CSS and OS in patients with stage T3N0 esophageal cancer |
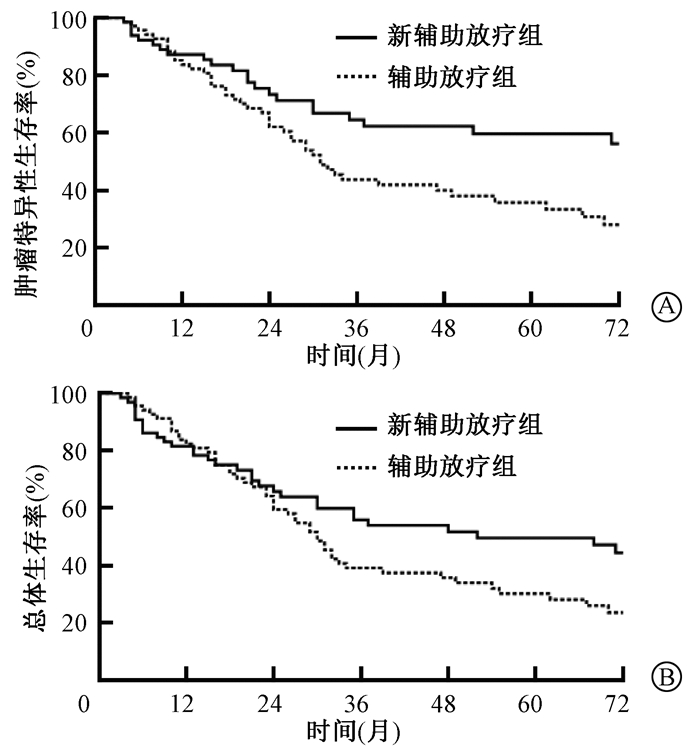
2.倾向性匹配分析放疗顺序对食管癌患者预后的影响: 1:1倾向性匹配后获得69对接受新辅助放疗和辅助放疗的食管癌患者。进一步分析发现,与匹配前类似,术前新辅助放疗组较辅助放疗组具有更好的肿瘤特异性生存(χ2=6.293,P<0.05),但在总体生存方面差异无统计学意义(P>0.05, 图 3)。多因素Cox回归分析提示辅助放疗组的肿瘤特异性死亡风险及总体死亡风险分别是新辅助放疗组的1.813 (95% CI 1.072~3.069,P=0.027)倍及1.424 (95% CI 0.896~2.262,P=0.134)倍(图 4)。
|
图 3 倾向性匹配后两组食管癌患者的肿瘤特异性生存及总体生存的对比 A.肿瘤特异性生存的对比(χ2=6.293,P < 0.05);B.总体生存的对比(P>0.05) Figure 3 Comparison of CSS and OS in two groups of esophageal cancer patients after propensity score matching A. Comparison of tumor CSS (χ2=6.293, P < 0.05); B. Comparison of OS (P>0.05) |
|
图 4 倾向性评分匹配后影响T3N0期食管癌患者预后的多因素Cox回归分析a对照参考 Figure 4 Multivariate Cox regression analysis of CSS and OS in patients with stage T3N0 esophageal cancer after propensity score matching a reference |
讨论
由于食管癌对于放射治疗具有较好的敏感性,因此放射治疗过去一般常用于晚期的不能手术的或术后淋巴结转移的患者,现在也应用于术前放化疗联合的新辅助治疗。但针对术前新辅助放疗的效果仍存有争议[7]。最近的一项荟萃研究发现术前放疗的患者生存率高于单纯手术组,但差异无统计学意义,且上述研究纳入的新辅助放疗的随机对照试验研究位于20世纪90年代[8]。众所周知,近20年来放射技术发展迅速,调强放射治疗、自适应放射治疗等放疗技术更精确地向肿瘤提供高剂量的辐射、减少周围的组织和器官免受损伤[7]。而最近的一个基于SEER数据库的研究发现,术前放疗较术后放疗可以明显改善食管癌患者的5年预后[9],尤其是对淋巴结转移的T3N+的食管癌患者[10];而另外的一个关于SEER数据库分析的研究发现,术前新辅助放疗可以明显改善T3N0期食管腺癌患者预后[6]。Zheng等[11]的最新研究发现,与新辅助化放疗相比,新辅助化疗加或不加新辅助放疗具有相同的生存益处,但术后并发症发生率低。
目前对于接受新辅助治疗的食管癌患者主要推荐是局部晚期TxN+或T3~4期的患者。由于高级别或大样本数据的支持以及对新辅助治疗效应评价的缺乏,临床实际工作中大部分cT3N0期的患者仍接受了根治性手术和术后的辅助放疗;但不可避免的是,上述部分术前评估为cT3N0期的患者术后病理证实却为伴有淋巴结转移。确定pT3N0期患者术前新辅助治疗的规范将有可能避免上述分期差错,使得部分cT3N0但是pT3N+的患者能够从新辅助治疗中获益。在本研究收集并分析了SEER数据库中接受新辅助放疗和辅助放疗联合根治术的T3N0期的食管癌患者,发现新辅助放疗较辅助放疗明显有益于食管癌患者。与辅助放疗组相比,新辅助放疗组的食管癌患者具有更好的肿瘤特异性生存率;多因素Cox回归分析也提示放疗顺序是影响T3N0期食管癌患者预后的重要因素。进一步通过对是否接受新辅助放疗倾向性评分匹配,排除了其他干预效应后发现,与匹配前相一致,新辅助放疗较术后辅助放疗有助于改善T3N0期食管癌患者的肿瘤特异性生存。既往研究也证实年龄与患者的预后密切相关[12],但由于纳入患者总数的影响及其中男性比例较高可能造成了结果的误差,性别对预后的影响仍有待商榷。
虽然采用了倾向性评分匹配方式进行干预效应分析,但本研究仍不能避免回顾性分析研究的局限。同时,SEER数据库中也缺乏关于放疗剂量、手术类型、术后并发症及其他可能影响预后的因素,如手术医师的水平差异、医院规模的差异及患者的临床表现、营养状况等。同时由于缺乏化疗相关数据,为了减少误差,本研究选择了同时进行化疗的食管癌患者。但是当前关于术前新辅助治疗的前瞻性研究还存在纳入食管癌患者较少及缺乏最新研究的问题。
总的来说,虽然对SEER数据的分析仍存在一定的局限性,但在缺乏前瞻性研究的基础上,通过大样本数据分析、倾向性评分匹配等降低了潜在的影响因素造成的误差,本研究获得的结果仍具有一定的临床参考价值。因此建议,术前新辅助放疗应当应用于术前评估为T3期的食管癌患者。
利益冲突 无作者贡献声明 田文泽负责酝酿、设计课题和文章写作;尤振兵负责收集和统计分析数据;胡忠吾负责收集和统计分析数据;徐达夫负责课题设计和指导文章写作;徐克平负责分析数据和指导文章写作
| [1] |
Moshim K, Adrienne G, Usha M, et al. Small cell carcinoma of the esophagus:a seer database analysis[J]. Ann Surg Oncol, 2013, 20(13): 4239-4244. DOI:10.1245/s10434-013-3167-3 |
| [2] |
Worni M, Castleberry AW, Gloor B, et al. Trends and outcomes in the use of surgery and radiation for the treatment of locally advanced esophageal cancer:a propensity score adjusted analysis of the surveillance, epidemiology, and end results registry from 1998 to 2008[J]. Dis Esophagus, 2014, 27(7): 662-669. DOI:10.1111/dote.12123 |
| [3] |
Lou F, Sima CS, Adusumilli PS, et al. Esophageal cancer recurrence patterns and implications for surveillance[J]. J Thorac Oncol, 2013, 8(12): 1558-1562. DOI:10.1097/01.JTO.0000437420.38972.fb |
| [4] |
Pasquali S, Yim G, Vohra RS, et al. Survival after neoadjuvant and adjuvant treatments compared to surgery alone for resectable esophageal carcinoma:a network meta-analysis[J]. Ann Surg, 2017, 265(3): 481-491. DOI:10.1097/SLA.0000000000001905 |
| [5] |
Ikebe M, Morita M, Yamamoto M, et al. Neoadjuvant therapy for advanced esophageal cancer:the impact on surgical management[J]. Gen Thorac Cardiovasc Surg, 2016, 64(7): 386-394. DOI:10.1007/s11748-016-0655-y |
| [6] |
Song Y, Tao G, Guo Q, et al. Survival benefit of surgery with radiotherapy vs surgery alone to patients with T2~3N0M0 stage esophageal adenocarcinoma[J]. Oncotarget, 2016, 7(16): 21347-21352. DOI:10.18632/oncotarget.7256 |
| [7] |
Bryan H B. Role of radiotherapy in the pre-operative management ofcarcinoma of the esophagus[J]. World J Gastrointest Oncol, 2015, 7(1): 1-5. DOI:10.4251/wjgo.v7.i1.1 |
| [8] |
Arnott SJ, Duncan W, Gignoux M, et al. Preoperative radiotherapy for esophageal carcinoma[J]. Cochrane Database Syst Rev, 2005, 4: CD001799: 1-15. DOI: 10.1002/14651858.cd001799.pub2.
|
| [9] |
Wojcieszynski A, Milby AB, Wan F, et al. The impact of radiation therapy sequencing on survival and cardiopulmonary mortality in the combined modality treatment of patients with esophageal cancer[J]. Cancer, 2013, 119(11): 1976-1984. DOI:10.1002/cncr.27970 |
| [10] |
Thumallapally N, Meshref A, Mousa M, et al. Survival benefit of neoadjuvant versus adjuvant radiotherapy in lymph node positive esophageal cancer:a population based analysis[J]. J Gastrointest Oncol, 2017, 8(5): 825-832. DOI:10.21037/jgo.2017.06.19 |
| [11] |
Zheng Y, Liu X, Zhang R, et al. Neoadjuvant chemotherapy with or without neoadjuvant radiotherapy compared with neoadjuvant chemoradiotherapy for esophageal cancer[J]. J Thorac Dis, 2018, 10(8): 4715-4723. DOI:10.21037/jtd.2018.07.124 |
| [12] |
Mcloughlin JM, Lewis JM, Meredith KL. The impact of age on morbidity and mortality following esophagectomy for esophageal cancer[J]. Cancer Control, 2013, 20(2): 144-150. DOI:10.1177/107327481302000208 |
 2019, Vol. 39
2019, Vol. 39


