2. 河南省人民医院放疗科, 郑州 450000
2. Department of Radiotherapy, Henan Provincial People's Hospital, Zhengzhou 450000, China
甲状腺髓样癌(MTC)是甲状腺癌分类中的独特一型,是源自甲状腺滤泡旁细胞(C细胞)的恶性肿瘤[1],由于该细胞不能吸收碘,对放射敏感性不高,导致放射治疗对MTC的治疗效果不理想,因此提高人髓样甲状腺癌细胞的放射敏感性对临床上治疗MTC具有重大意义。miR-129-5p在多种癌症中发挥抑癌作用,有研究表明,miR-129-5p可靶向RET原癌基因(RET)抑制MTC细胞的生长、凋亡和迁移[2]。高迁移率族蛋白B1 (HMGB1)在多种癌症中表达增强[3],是一种抗细胞凋亡的癌蛋白,有报道miR-129-2可通过靶向HMGB1在胶质瘤细胞中发挥抑癌作用,并受DNA甲基化的影响[4];HMGB1诱导甲状腺乳头状癌细胞过度表达mir-222和mir-221,进而促进细胞生长转移[5]。但miR-129-5p靶向HMGB1调控MTC细胞放射敏感性仍未阐明,因此,本研究拟通过开展miR-129-5p与HMGB1靶向关系验证及其对人髓样甲状腺癌细胞MZ-CRC-1和放射抵抗细胞MZ-CRC-1/R的放射敏感性影响的相关研究,为MTC的临床治疗提供科学依据。
材料与方法1.主要试剂及仪器:人髓样甲状腺癌细胞MZ-CRC-1为北京北纳生物公司产品;细胞培养板、脱脂奶粉为美国BD公司产品;DMEM高糖培养基为美国Hyclone公司产品;双抗[青霉素(10 000 units/ml)/链霉素(10 000 μg/ml)]胰酶、二甲基亚砜(DMSO)、噻唑蓝(MTT)和结晶紫为美国Sigma公司产品;蛋白提取试剂盒、BCA蛋白定量试剂盒、聚偏二氟乙烯(PVDF)膜、化学发光剂(ECL)为上海碧云天生物公司产品;小鼠抗人HMGB1抗体为美国Abcam公司产品;小鼠甘油醛-3-磷酸脱氢酶(GAPDH)抗体为美国Santa Cruz Biotechnology公司产品;HRP山羊抗小鼠二抗为北京中杉金桥生物技术有限公司产品;miRNeasy mini试剂、QuantiTect SYBR Green PCR试剂盒为德国Qiagen公司产品;High-Capacity cDNA Reverse Transcription Kit为美国Biosystems公司产品。miR-NC inhibitor、miR-129-5p inhibitor、miR-NC、miR-129-5p mimic、siHMGB1及无意义序列(Scrambled)、pcDNA3.0 HMGB及空载对照(Vector)为上海吉玛公司产品;lipo2000转染试剂为美国赛默飞公司产品;Annexin V-FITC/PI细胞凋亡检测试剂盒为上海碧云天生物公司产品;双荧光素酶报告基因质粒为上海汉恒生物构建;流式细胞仪为美国BD FACS Aria公司产品;X射线放疗机购自丹东市康嘉仪器有限公司。
2.细胞培养:人髓样甲状腺癌细胞MZ-CRC-1培养于含有10%胎牛血清、1%的双抗DMEM培养基中,培养条件为5% CO2、37℃恒温培养箱。
3. MZ-CRC-1/R放射抵抗细胞的建立:取对数生长的MZ-CRC-1细胞在室温下,采用X射线放疗机,6 MeV X射线垂直照射,细胞表面以1.5 cm组织等效填充物覆盖,剂量率为2.0 Gy /min,靶皮距为70 cm,照射野7 cm×7 cm,每次照射剂量为600 cGy,照射后继续培养,存活细胞用0.25%胰蛋白酶消化传代。待细胞再次达指数生长期期末时,消化细胞,将适量细胞接种传代,次日再照射相同剂量。重复以上过程,照射5次,得到抗辐射细胞株,命名为MZ-CRC-1/R。MTT法检测不同照射剂量(0、2、4、6、8 Gy)照射细胞MZ-CRC-1/R和MZ-CRC-1的细胞活力,筛选后续实验所用最佳照射剂量;MTT法检测4 Gy照射剂量下不同时间点下(0、1、2、3、4、5 d)细胞MZ-CRC-1/R和MZ-CRC-1的细胞活力。
4. qRT-PCR检测miR-129-5p在MZ-CRC-1和MZ-CRC-1/R:分别用miRNeasy mini从培养的MZ-CRC-1/R和MZ-CRC-1细胞中提取miRNA。使用High-Capacity cDNA Reverse Transcription Kit从2 μg RNA中合成cDNA。随后用QuantiTect SYBR Green PCR一式3份进行qRT-PCR。以U6为内参,计算miR-129-5p的表达水平。收集数据并使用2-ΔΔCt方法分析以定量相对miRNA表达水平。
5.抑制miR-129-5p对MZ-CRC-1细胞放射敏感性的影响:利用lipo2000转染试剂将miR-NC inhibitor、miR-129-5p inhibitor转染至对数生长期的细胞MZ-CRC-1细胞中,分别记为miR-NC inhibitor组和miR-129-5p inhibitor组,转染后24 h,利用qRT-PCR方法检测miR-129-5p的表达水平;取转染后24 h后的细胞,将其消化下来以每孔5×103个细胞接种至96孔板中,根据实验要求,同时设置5个复孔,分别在1、2、3、4、5 d加入MTT溶液,37℃继续培养4 h,加入等量二甲基亚砜(DMSO),在490 nm波长下,采用酶标仪检测吸光度(A)值,并根据miR-129-5p inhibitor组A值与miR-NC inhibitor组A值的比值计算细胞活力。取miR-NC inhibitor组和miR-129-5p inhibitor组细胞并经4 Gy X射线照射,分别记为miR-NC inhibitor+4 Gy组和miR-129-5p inhibitor+4 Gy组,同时以不作任何处理的MZ-CRC-1细胞为对照组,以4 Gy剂量照射的MZ-CRC-1细胞为4 Gy组,48 h后采用Annexin V-FITC/PI试剂盒操作步骤检测细胞凋亡情况。
6.过表达miR-129-5p对MZ-CRC-1/R细胞放射敏感性的影响:分别将miR-NC、miR-129-5p mimic转染至对数生长期的细胞MZ-CRC-1/R细胞中,分别记为miR-NC组和miR-129-5p inhibitor组,转染后24 h,参考方法4中qRT-PCR方法检测miR-129-5p的表达水平;参照方法5中MTT方法检测细胞活力。取miR-NC组和miR-129-5p组细胞并经4 Gy X射线照射,分别记为miR-NC+4 Gy组和miR-129-5p+4 Gy组,同时以不作任何处理的MZ-CRC-1/R细胞为空白对照组,以4 Gy X射线照射的MZ-CRC-1细胞为4 Gy照射组,48 h后采用Annexin V-FITC/PI检测细胞凋亡情况。
7.双荧光素酶报告基因实验:利用Tragetscan在线预测分析软件对miR-129-5p与HMGB1靶向结合位点进行分析,设计包含与miR-129-5p结合序列和突变序列的HMGB1基因片段,构建野生型(WT),两种突变型(Mut-1和Mut-2)及两种共突变型(Mut-1&2)的HMGB1双荧光素报告基因载体,分别记为HMGB1-WT、HMGB1-Mut-1、HMGB1-Mut-2和HMGB1-Mut-1 & 2。将上述HMGB1野生型和突变型双荧光素报告基因载体分别与无义序列阴性对照(miR-NC)、miR-129-5p mimic共转染至MZ-CRC-1细胞中,双荧光素酶报告基因实验检测各组细胞中荧光素酶活性变化。
8. Western blot检测miR-129-5p对HMGB1表达的影响:取对数生长的MZ-CRC-1和MZ-CRC-1/R细胞,分别将miR-NC inhibitor、miR-129-5p inhibitor转染至MZ-CRC-1细胞,分别将miR-NC、miR-129-5p mimic转染至MZ-CRC-1/R细胞,转染后48 h,裂解细胞、提取细胞蛋白,采用BCA蛋白定量试剂盒对蛋白定量;通过SDS-PAGE方法行蛋白电泳,采用湿转法将蛋白转至PVDF膜上,进行相应的一抗和二抗孵育,最后用ECL化学发光剂进行显影、曝光,以GAPDH为内参,分析HMGB1的相对蛋白表达量。
9. MiR-129-5p通过HMGB1对MTC细胞放射敏感性的影响:取对数生长期的MZ-CRC-1和MZ-CRC-1/R细胞进行转染实验,将MZ-CRC-1细胞分为4组:miR-NC-inhibitor组(转染miR-NC-inhibitor)、miR-129-5p-inhibitor组(转染miR-129-5p-inhibitor)、miR-NC-inhibitor + Scrambled组(共转染miR-NC-inhibitor和Scrambled)、miR-129-5p-inhibitor + siHMGB1组(共转染miR-129-5p-inhibitor和siHMGB1);将MZ-CRC-1/R细胞分为4组:miR-NC组(转染miR-NC)、miR-129-5p组(转染miR129-5p)、miR-129-5p+Vector组(共转染miR-129-5p和Vector)、miR-129-5p +HMGB1组(共转染miR-129-5p和HMGB1)、转染方法参照lipo2000转染试剂的说明书进行操作,48 h后根据Annexin V-FITC/PI检测各组细胞凋亡情况。
10.克隆形成实验:细胞以每孔106个细胞密度接种到6孔细胞板,于培养箱内常规培养过夜后,给予0、2、4、6和8 Gy不同剂量的X射线照射。照射结束后,更换含10%胎牛血清的完全培养基在10 cm的平皿中继续培养。12 d后,先以预冷的甲醇对形成的菌落固定15 min后,再以结晶紫染色30 min,统计有效克隆细胞数(>50个细胞的集落)。按照下列公式,计算克隆形成率(PE):PE(%)=克隆数/种植细胞数×100%。以单击多靶模拟合细胞存活曲线,计算放射增敏比(SER=对照组D0/实验组D0)。
11.统计学处理:采用SPSS 20.0软件进行分析。数据经正态性检验符合正态分布采用x±s表示。用GraphPad Prism 7进行作图。2组计量资料比较采用t检验,多组计量资料比较经方差齐性检验后采用单因素方差分析。P < 0.05为差异有统计学意义。
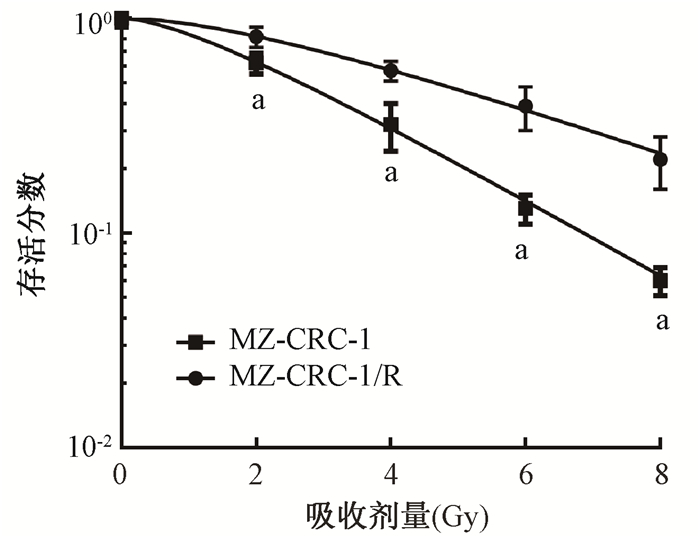
结果1.抗辐射MZ-CRC-1/R细胞株的建立:用不同剂量(0、2、4、6、8 Gy)的X射线照射MZ-CRC-1和MZ-CRC-1/R细胞后,克隆形成检测发现,MZ-CRC-1/R细胞存活分数显著高于MZ-CRC-1细胞(t=3.038、4.330、4.885、4.568,P < 0.05),放射增敏比0.617;MTT法检测细胞增殖活力,结果显示,与MZ-CRC-1细胞相比,MZ-CRC-1/R细胞增殖能力提高(t=3.637、7.734、11.896、14.522,P < 0.05,图 1和表 1),选择MZ-CRC-1增殖活力为50%的照射剂量4 Gy进行后续试验;MTT法检测4 Gy照射细胞后不同时间点(1、2、3、4、5 d)细胞增殖活力,结果显示,与MZ-CRC-1细胞相比,MZ-CRC-1/R细胞殖能力上升(t=3.118、3.464、5.436、7.206、9.037,P < 0.05,表 1),上述结果表明,与MZ-CRC-1细胞相比,MZ-CRC-1/R细胞的放射敏感性降低,本研究成功构建抗辐射MZ-CRC-1/R细胞株。
|
注:a与MZ-CRC-1比较,t=3.308、4.330、4.885、4.568, P < 0.05 图 1 MZ-CRC-1和MZ-CRC-1/R细胞的存活曲线 Figure 1 Survival curve of MZ-CRC-1 and MZ-CRC-1/R cells |
|
|
表 1 X射线照射后MZ-CRC-1和MZ-CRC-1/R的细胞活力(%, x±s) Table 1 Cell viability of MZ-CRC-1 and MZ-CRC-1/R after X-ray irradiation (%, x±s) |
2. miR-129-5p在MZ-CRC-1/R细胞中表达下调:qRT-PCR检测miR-129-5p在MZ-CRC-1和MZ-CRC-1/R细胞中的表达量,结果显示,与MZ-CRC-1细胞(1.00±0.06)相比,miR-129-5p在MZ-CRC-1/R细胞中的表达(0.26±0.03)显著下调(t=19.107,P < 0.05)。
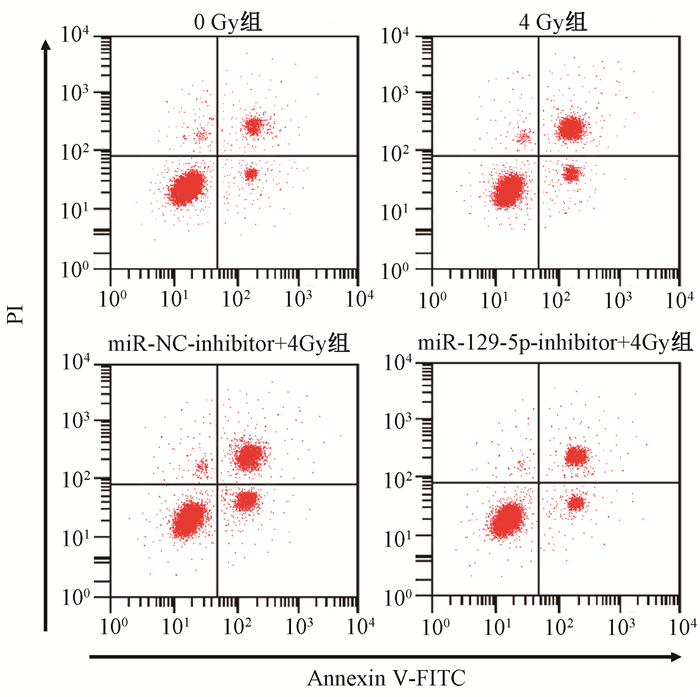
3.敲低miR-129-5p诱导MZ-CRC-1细胞放射抵抗:qRT-PCR检测miR-129-5p表达,结果显示,与miR-NC-inhibitor组细胞(1.00±0.06)相比,miR-129-5p-inhibitor组细胞中miR-129-5p表达(0.19±0.02)显著降低(t=22.183,P < 0.05);MTT法检测不同时间点(0、1、2、3、4和5 d)下的细胞活力,结果显示,与miR-NC-inhibitor组细胞(100±8、75±8、62±6、45±4、36±4、23±2)相比,miR-129-5p-inhibitor组细胞增殖能力在1 d时(103±6、89±9)差异无统计学意义(P>0.05),3、4和5 d时(69±7、61±6、53±5)显著增加(t=5.156、6.005、9.649,P < 0.05);流式细胞术检测细胞凋亡率,结果显示,与0 Gy组(4.38±0.51)%相比,4 Gy组细胞凋亡率(25.49±2.67)%显著增加(t=13.451,P < 0.05),与miR-NC-inhibitor+4 Gy组(26.32±2.71)%相比,miR-129-5p-inhibitor+4 Gy组细胞凋亡率(11.25±1.32)%显著降低(t=8.659,P < 0.05,图 2)。
|
图 2 抑制miR-129-5p并经照射后MZ-CRC-1细胞凋亡的流式细胞图 Figure 2 The flow apoptosis diagram of MZ-CRC-1 cells after inhibition of miR-129-5p and irradiation |
4.过表达miR-129-5p增加MZ-CRC-1/R细胞放射敏感性:qRT-PCR检测miR-129-5p表达,结果显示,与miR-NC组细胞(1.00±0.07)相比,miR-129-5p组细胞中miR-129-5p表达(4.67±0.45)显著上调(t=13.958,P < 0.05);MTT法检测不同时间点(0、1、2、3、4和5 d)下细胞增殖能力,结果显示,与miR-NC组细胞(100±6、93±9、82±8、74±7、64±6、56±6)相比,miR-129-5p组细胞增殖能力在0和1 d时差异无统计学意义(P>0.05),在2、3、4、5 d时(64±6、49±5、39±4、27±3)明显降低(t=3.118、5.034、6.005、7.488,P < 0.05);流式细胞术检测细胞凋亡,结果显示,与空白对照组(3.78±0.39)%相比,4 Gy照射组细胞凋亡率(12.67±1.35)%明显增加(t=10.958,P < 0.05),与miR-NC+4 Gy组(13.49±1.41)%相比,miR-129-5p+4 Gy组细胞凋亡率(24.58±2.67)%显著增加(t=6.362,P < 0.05)。
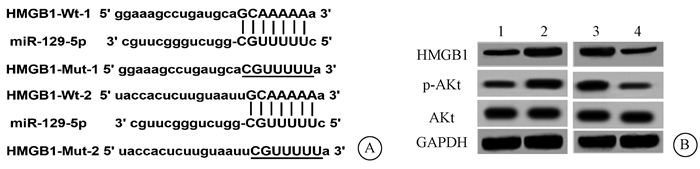
5.验证HMGB1是miR-129-5p的靶基因:通过Target scan在线预测分析软件预测到miR-129-5p与HMGB1的3′UTR存在两处结合位点(图 3),双荧光素酶报告基因实验结果显示,与miR-NC组相比,miR-129-5p组中HMGB1-WT载体、HMGB1-Mut-1载体、HMGB1-Mut-2载体的荧光素酶活性显著降低(t=11.754、5.604、4.683,P < 0.05),但却不影响HMGB1-Mut-1 & 2载体的荧光素酶活性,见表 2。转染miR-129-5p-inhibitor的MZ-CRC-1细胞中HMGB1及其下游蛋白p-AKt表达(0.71±0.07、0.61±0.05)较miR-NC-inhibitor组(0.35±0.04、0.22±0.02)明显上调(t=7.734、12.544,P < 0.05),总的AKt表达无显著变化;而转染miR-129-5p mimic的MZ-CRC-1/R细胞中HMGB1及其下游蛋白p-AKt表达(0.68±0.07、0.49±.05)较miR-NC组(0.27±0.03、0.16±0.02)显著降低(t=9.325、10.614,P < 0.05,图 3)。
|
注:1. miR-NC-inhibitor组;2. miR-129-5p-inhibitor组;3. miR-NC组;4. miR-129-5p mimic组 图 3 HMGB1是miR-129-5p的靶基因验证 A. miR-129-5p与HMGB1的结合位点;B. Western blot验证miR-129-5p对HMGB1及其下游蛋白表达的影响 Figure 3 Validation of HMGB1 as the target gene of miR-129-5p A. The binding sites between miR-129-5p and HMGB1; B. Effect of miR-129-5p on the expressions of HMGB1 and its downstream proteins was validated by Western blot assay |
|
|
表 2 两组细胞转染不同载体的荧光素酶活性(x±s) Table 2 The luciferase activity in two cell groups transfected with different vectors(x±s) |
6. MiR-129-5p通过HMGB1增加MTC细胞放射敏感性:流式细胞术检测细胞凋亡,结果显示,与miR-NC-inhibitor组(25.69±2.64)%相比,miR-129-5p-inhibitor组细胞凋亡率(11.34±1.24)%降低(t=8.522,P < 0.05),与miR-NC-inhibitor+Scrambled组相比(12.54±1.31)%,miR-NC-inhibitor+siHMGB1组细胞凋亡率(22.18±2.12)%显著升高(t=6.700,P < 0.05),表明下调miR-129-5p可诱导MZ-CRC-1细胞产生放射抵抗,而同时敲低HMGB1可增加其放射敏感性;将miR-129-5p mimic和pcDNA3.0 HMGB1共转染至MZ-CRC-1/R细胞,流式细胞术检测细胞凋亡,结果显示,与miR-NC组(12.88±1.34)%相比,miR-129-5p组细胞凋亡率(24.97±2.64)%升高(t=7.073,P < 0.05),与miR-129-5p+Vector组(23.49±2.41)%相比,miR-129-5p+HMGB1组细胞凋亡率(14.58±1.57)%降低(t=5.365,P < 0.05),表明过表达miR-129-5p可增加MZ-CRC-1/R细胞的放射敏感性,而HMGB1的额外补充可诱导其产生放射抵抗。
讨论MTC占所有甲状腺癌的5%左右,恶性程度在甲状腺癌中较高,预后差[6-7]。目前临床治疗MTC的方法主要是手术切除,但对于高风险的患者,辅助性放化疗仍然十分必要。由于MTC放疗效果仍不理想,因此如何提高其放射敏感性迫在眉睫。多项实验表明,与亲本细胞株相比,miRNAs在相应的放射抵抗肿瘤细胞中表达水平有显著差异[8-10],说明miRNAs可能与肿瘤细胞的放射敏感性密切相关,已有研究表明,调控其表达有可能增加肿瘤细胞放射敏感性[11]。有报道称,miR-129-5p可通过调控靶基因进而影响肿瘤细胞增殖、迁移侵袭和凋亡。例如,Wang和Yu[12]发现miR-129-5p在胃癌细胞中表达下调,通过MTT、克隆形成和Transwell实验检测发现miR-129-5p抑制胃癌细胞的增殖,迁移和侵袭。Zhang等[13]证实miR-129-5p通过靶向转录因子SOX4抑制Wnt/β-catenin信号通路,进一步抑制软骨肉瘤细胞增殖,迁移和促进细胞凋亡。此外,miR-129-5p上调还可通过调控信号转导和转录激活因子-3(STAT3)表达而影响喉癌细胞增殖,侵袭和迁移[14]。但关于miR-129-5p在人髓样甲状腺癌的研究仍较少。近期研究表明,miR-129-5p与化疗药物的敏感性密切相关。胡俊华等[15]研究发现,miR-129-5p可通过靶向胸苷蒜合成酶(TYMS)进而增加结肠癌磁暴对5-氟尿嘧啶(5-Fu)的敏感性。石瑛等[16]的研究表明miRNA-129-5p可提高乳腺癌细胞MCF-7对紫杉醇的敏感性。但关于miR-129-5p对肿瘤细胞放射敏感性的研究较少。本研究发现miR-129-5p在放射抵抗的人髓样甲状腺癌细胞MZ-CRC-1/R中表达降低,这提示miR-129-5p可能与MZ-CRC-1细胞放射敏感性有关。为进一步研究miR-129-5p对MZ-CRC-1细胞放射敏感性的影响机制,本研究在MZ-CRC-1/R细胞中上调miR-129-5p表达。结果发现,上调其表达则显著抑制细胞的增殖能力。而在MZ-CRC-1细胞中下调miR-129-5p表达可提高细胞的增殖活力,众所周知,细胞放射敏感性与细胞凋亡率密切相关,放射治疗主要是通过电离辐射诱导细胞发生凋亡,因此细胞凋亡率可作为评价放射敏感性的重要指标[17-18]。本研究结果显示,抑制miR-129-5p可抑制细胞的凋亡,过表达miR-129-5p则使放射抵抗细胞发生凋亡。综上所述,抑制miR-129-5p表达可诱导MZ-CRC-1细胞产生放射抵抗,而过表达miR-129-5p增加MZ-CRC-1/R细胞放射敏感性,这些研究结果表明,miR-129-5p与人髓样甲状腺癌的放射敏感性密切相关。
HMGB1是一种高迁移率族蛋白,能够参与细胞的生物学过程。有研究表明,miR-34a通过靶向急性髓系白血病细胞中的HMGB1促进细胞凋亡[19]。miR-142-3p可通过靶向HMGB1增加非小细胞肺癌的化疗敏感性[20]。HMGB1可增加乳腺癌细胞对γ射线的放射敏感性[21]。而关于HMGB1是否参与人髓样甲状腺癌的放射敏感性仍未可知。Wu等[22]发现,miR-129-5p与HMGB1存在靶向关系进而调控结肠癌的发生发展。但是miR-129-5p是否可靶向HMGB1参与人髓样甲状腺癌细胞的放射敏感性,仍有待研究。本研究通过双荧光素酶报告基因和Western blot实验证实miR-129-5p可靶向负调节HMGB1表达,这与文献结果相一致[22]。同时研究结果还发现HMGB1的敲低或过表达可部分逆转miR-129-5p下调或上调对MZ-CRC-1细胞放射敏感性的作用,这些结果提示,HMGB1参与miR-129-5p对甲状腺髓样癌细胞MZ-CRC-1放射敏感性的调控过程。然而,本研究并未单独研究HMGB1对MZ-CRC-1细胞放射敏感性的影响,同时miR-129-5p靶向HMGB1对甲状腺髓样癌放射敏感性的影响还应该在体外实验中进行验证。综上所述,本研究证实miR-129-5p可靶向抑制HMGB1增加甲状腺髓样癌细胞MZ-CRC-1放射敏感性,提示miR-129-5p也许可作为MTC基因治疗的新靶点,为MTC的临床治疗提供了理论依据。
利益冲突 无作者贡献声明 闫培和张振华负责设计和实验操作及撰写论文; 刘建波、连利霞协助实验; 丁超协助完成数据分析
| [1] |
赵佳正, 郭良, 赵坚强, 等. 甲状腺髓样癌中RET原癌基因研究进展[J]. 临床耳鼻咽喉头颈外科杂志, 2018, 32(22): 1754-1758. Zhang ZL, Guo L, Zhao JQ, et al. A review on the RET proto-oncogene mutation in medullary thyroid carcinoma[J]. J Clin Otorhinolaryngol Head Neck Surg (China), 2018, 32(22): 1754-1758. DOI:10.13201/j.issn.1001-1781.2018.22.018 |
| [2] |
Duan L, Hao X, Liu Z, et al. MiR-129-5p is down-regulated and involved in the growth, apoptosis and migration of medullary thyroid carcinoma cells through targeting RET[J]. FEBS Lett, 2014, 588(9): 1644-1651. DOI:10.1016/j.febslet.2014.03.002 |
| [3] |
肖建彪, 陈龙华, 陈斌. HMGB1在多种人体恶性肿瘤组织、癌旁组织中的表达及意义[J]. 山东医药, 2013, 53(12): 1-3. Xiao JB, Chen LH, Chen B. Expression of HMGB1 in malignant tumor tissues and adjacent normal tissues and its significance[J]. Shandong Med J, 2013, 53(12): 1-3. DOI:10.3969/j.issn.1002-266X.2013.12.001 |
| [4] |
Yang Y, Huang JQ, Zhang X, et al. MiR-129-2 functions as a tumor suppressor in glioma cells by targeting HMGB1 and is down-regulated by DNA methylation[J]. Mol Cell Biochem, 2015, 404(1-2): 229-239. DOI:10.1007/s11010-015-2382-6 |
| [5] |
Mardente S, Mari E, Consorti F, et al. HMGB1 induces the overexpression of miR-222 and miR-221 and increases growth and motility in papillary thyroid cancer cells[J]. Oncol Rep, 2012, 28(6): 2285-2289. DOI:10.3892/or.2012.2058 |
| [6] |
陈晓红. 甲状腺髓样癌的治疗策略[J]. 临床耳鼻咽喉头颈外科杂志, 2016, 30(21): 1667-1671. Chen XH. Treatment strategy of medullary thyroid carcinoma[J]. J Clin Otorhinolaryngol Head Neck Surg (China), 2016, 30(21): 1667-1671. DOI:10.13201/j.issn.1001-1781.2016.21.001 |
| [7] |
Griebeler ML, Gharib H, Thompson GB. Medullary thyroid carcinoma[J]. Endocr Pract, 2013, 19(4): 703-711. DOI:10.4158/EP12430.RA |
| [8] |
张玉虹, 李皓, 刘阳晨. miRNA在肿瘤放疗敏感性中的作用及机制[J]. 现代肿瘤医学, 2016, 24(2): 314-318. Zhang YH, Li H, Liu YC. The functionand mechanism of miRNA in tumor radiosensitivity[J]. Modern Oncol, 2016, 24(2): 314-318. DOI:10.3969/j.issn.1672-4992.2016.02.045 |
| [9] |
郑志范, 苏华芳, 邹燕, 等. microRNA在食管癌放射抵抗细胞表达谱研究[J]. 中华医学杂志, 2011, 91(9): 639-642. Zheng ZF, Su HF, Zou Y, et al. Expression profiles of microRNAs in radioresistant esophageal cell line[J]. Nat Med J China, 2011, 91(9): 639-642. DOI:10.3760/cma.j.issn.0376-2491.2011.09.018 |
| [10] |
Josson S, Sung SY, Lao K, et al. Radiation modulation of microRNA in prostate cancer cell lines[J]. Prostate, 2010, 68(15): 1599-1606. DOI:10.1002/pros.20827 |
| [11] |
Li Y, Han W, Ni TT, et al. Knockdown of microRNA-1323 restores sensitivity to radiation by suppression of PRKDC activity in radiation-resistant lung cancer cells[J]. Oncol Rep, 2015, 33(6): 2821-2828. DOI:10.3892/or.2015.3884 |
| [12] |
Wang Q, Yu J. MiR-129-5p suppresses gastric cancer cell invasion and proliferation by inhibiting COL1A1[J]. Biochem Cell Biol, 2018, 96(1): 19-25. DOI:10.1139/bcb-2016-0254 |
| [13] |
Zhang P, Li J, Song Y, et al. MiR-129-5p inhibits proliferation and invasion of chondrosarcoma cells by regulating SOX4/Wnt/β-Catenin signaling pathway[J]. Cell Physiol Biochem, 2017, 42(1): 242-253. DOI:10.1159/000477323 |
| [14] |
Shen N, Huang X, Li J. Upregulation of miR-129-5p affects laryngeal cancer cell proliferation, invasiveness, and migration by affecting STAT3 expression[J]. Tumor Biol, 2016, 37(2): 1789-1796. DOI:10.1007/s13277-015-3969-y |
| [15] |
胡俊华, 喻琴, 杨艳果, 等. MiR-129-5p通过靶定胸苷酸合成酶调节结肠癌细胞对5-氟尿嘧啶的敏感性[J]. 临床内科杂志, 2014, 31(10): 709-711. Hu JH, Yu Q, Yang YG, et al. MiR-129-5p can increase colorectal cancer cell sensitivity to 5-Fu by targeting TYMS[J]. J Clin Intern Med, 2014, 31(10): 709-711. DOI:10.3969/j.issn.1001-9057.2014.10.020 |
| [16] |
石瑛, 王云凤, 路璐, 等. 转染miRNA-129-5p对MCF-7细胞化疗敏感性及ABCB1表达的影响[J]. 郑州大学学报(医学版), 2018, 53(2): 155-159. Shi Y, Wang YF, Lu L, et al. miRNA-129-5p transfection improves Taxol sensitivity on MCF-7 cells by regulating ABCB1 expression[J]. J Zhengzhou Univ (Med Sci), 2018, 53(2): 155-159. DOI:10.13705/j.issn.1671-6825.2017.06.077 |
| [17] |
赵宝锋, 刘建香, 苏旭. 细胞凋亡信号通路调控与肿瘤辐射敏感性[J]. 中华放射医学与防护杂志, 2005, 25(4): 401-404. Zhao BF, Liu JX, Su X. Regulation of apoptosis signaling pathway and tumor radiation sensitivity[J]. Chin J Radiol Med Prot, 2005, 25(4): 401-404. DOI:10.3760/cma.j.issn.0254-5098.2005.04.049 |
| [18] |
何子毅, 孟庆勇. 电离辐射与细胞凋亡[J]. 国外医学·放射医学核医学分册, 2004, 28(2): 90-93. He ZY, Meng QY. Ionizing radiation and apoptosis[J]. Foreign Med Sci-Sec Radiat Med Nucl Med, 2004, 28(2): 90-93. DOI:10.3760/cma.j.issn.1673-4114.2004.02.012 |
| [19] |
Liu L, Ren W, Chen K. MiR-34a Promotes apoptosis and inhibits autophagy by targeting HMGB1 in acute myeloid leukemia cells[J]. Cell Physiol Biochem, 2017, 41(5): 1981-1992. DOI:10.1159/000475277 |
| [20] |
Chen Y, Zhou X, Qiao J, et al. MiR-142-3p overexpression increases chemo-sensitivity of NSCLC by inhibiting HMGB1-mediated autophagy[J]. Cell Physiol Biochem, 2017, 41(4): 1370-1382. DOI:10.1159/000467896 |
| [21] |
王传玺, 吴德华, 陈龙华. 高迁移率族蛋白B1在肿瘤中的作用[J]. 国际肿瘤学杂志, 2009, 36(5): 344-347. Wang CX, Wu DH, Chen LH. Role of high mobility group protein B1 in cancer[J]. J Int Oncol, 2009, 36(5): 344-347. DOI:10.3760/cma.j.issn.1673-422X.2009.05.007 |
| [22] |
Wu Q, Meng WY, Jie Y, et al. LncRNA MALAT1 induces colon cancer development by regulating miR-129-5p/HMGB1 axis[J]. J Cell Physiol, 2018, 233(9): 6750-6757. DOI:10.1002/jcp.26383 |
 2019, Vol. 39
2019, Vol. 39
