2. 河南省人民医院放疗科, 郑州 450003
2. Department of Cancer and Radiotherapy, Henan Province People's Hospital, Zhengzhou 450003, China
骨肉瘤具有恶性程度高、致死率高等特点,但对于肿瘤生长在骨盆、脊柱等的患者手术治疗具有很大的局限性,放射治疗是除了手术治疗之外常见的辅助疗法[1],而在放射治疗的同时肿瘤周围器官也会受到损伤,部分患者还会出现放射不敏感等现象[2]。肝癌高表达转录本(highly up-regulated in liver cancer, HULC)是一个与肿瘤有关的长链非编码RNA(long noncoding RNA, LncRNA),最早在肝癌中发现,其基因表达水平的高低与肿瘤的易感性等有关[3]。HULC与肿瘤细胞的生长调控有关,下调HULC抑制胃癌、肝癌等细胞的恶性表型,HULC可能是肿瘤治疗的潜在靶点[4-5]。目前在骨肉瘤中的研究表明,HULC高表达是骨肉瘤患者预后不良的标志之一,而对于HULC在骨肉瘤细胞放射敏感性和增殖凋亡中的作用尚不明确[6]。本研究在体外通过shRNA下调骨肉瘤细胞中HULC表达水平,明确HULC在骨肉瘤细胞放射敏感性和增殖凋亡中的作用,以期为靶向基因治疗骨肉瘤和提高骨肉瘤患者放射敏感性提供依据。
材料与方法1.主要试剂和细胞:cDNA合成试剂盒购自生工生物工程(上海)股份有限公司;HULC shRNA和阴性对照慢病毒(pLVTHM)由上海吉凯基因化学技术有限公司构建包装;引物由金斯瑞生物科技有限公司合成;PI细胞周期检测试剂盒购自上海榕柏生物技术有限公司;Annexin V-FITC/PI细胞凋亡检测试剂盒、胞浆蛋白提取试剂盒购自江苏凯基生物技术股份有限公司;81210541I1 Cyclin D1抗体、5681543 C-Caspase-3抗体、45837088 p21抗体、35170905细胞色素C(Cyt-C)抗体购自美国Cell Signaling Technology;线粒体蛋白提取试剂盒购自艾美捷科技有限公司;骨肉瘤细胞OS732购自中国科学院上海细胞库。
2.慢病毒感染和细胞分组:骨肉瘤细胞种植于12孔板内,放在37℃,5% CO2培养箱中培养,细胞密度约为35%时,吸取慢病毒液分别添加到细胞内,感染复数为20,在细胞中添加终浓度为6 mg/L的Polybrene混合后,继续培养过夜,将液体吸弃,添加细胞培养液,3 d后观察绿色荧光表达水平,感染效率高于90%用于后续实验。将感染HULC shRNA和阴性对照慢病毒的骨肉瘤细胞记为sh-HULC组和阴性对照组。将感染HULC shRNA和阴性对照慢病毒的骨肉瘤细胞用8 Gy剂量[7]照射处理后记为照射+sh-HULC组和单纯照射组。采用Senergy直线加速器6 MV X射线(瑞典医科达医疗系统公司)照射,源皮距100 cm,30 cm×30 cm照射野,剂量率300 c Gy/min。细胞在受到照射后48 h可明显影响细胞增殖、凋亡等生物学特性,均选择照射48 h以后进行相关实验[7]。
3. qRT-PCR检测干扰效果:阴性对照组、sh-HULC组细胞用TRIZOL试剂分别提取细胞中的RNA,吸取5 μl的RNA,以cDNA合成试剂盒进行反转录反应(MMLV-RT)。qRT-PCR引物为:β-肌动蛋白正向引物5′ CTACAATGAGCTGCGTGTGG 3′,反向引物5′ AAGGAAGGCTGGAAGAGTGC 3′。HULC正向引物5′ ACTCTGAAGTAAAGGCCGGA 3′,反向引物5′ TGCCAGGAAACTTCTTGCTTG 3′。PCR程序为:95℃孵育2 min;95℃孵育30 s;60℃孵育35 s;设置40个循环。β-肌动蛋白为内参,最后分别读取每个反应的Ct值,2-△△Ct方法计算HULC表达变化。
4.四甲基偶氮唑盐(MTT)方法测定细胞增殖:将阴性对照组、单纯照射组、sh-HULC组、照射+sh-HULC组细胞依次接种到96孔板内,每个孔中添加100 μl,孵育48 h以后,将培养板分别取出,每孔添加MTT溶液各20 μl,放在培养箱内继续孵育4 h,弃上清,分别添加150 μl的二甲基亚砜(DMSO),酶标仪上检测570 nm每孔的吸光度(A)值。经过空白孔调零以后,把阴性对照组细胞存活率设置为100%,分析各组细胞存活率变化。
5. PI单染检测细胞周期:阴性对照组、单纯照射组、sh-HULC组、照射+sh-HULC组细胞培养48 h后,分别收集各组细胞,添加磷酸盐缓冲液(PBS)将细胞分别洗涤2次。添加75%乙醇溶液固定,在每组样品中分别添加碘化丙啶(PI)染液,置于室温条件避光反应30 min,流式细胞仪检测,分析细胞周期比例变化。
6. Annexin V-FITC/PI双染法检测细胞凋亡:阴性对照组、单纯照射组、sh-HULC组、照射+sh-HULC组细胞培养48 h以后,添加0.25%的胰蛋白酶消化后收集细胞,每个样品收集1×106个细胞,继续添加PBS把细胞洗涤3次以后,分别加入500 μl的结合缓冲液(binding buffer)将细胞配制成单细胞悬浮液,分别添加Annexin V-FITC 5 μl和PI 5 μl,继续孵育15 min。置于流式细胞仪测定各组细胞凋亡水平。
7. Western blot检测p21、Cyclin D1、C-Caspase-3、Cyt-C蛋白表达水平:阴性对照组、单纯照射组、sh-HULC组、照射+sh-HULC组细胞培养48 h以后,收集细胞。用放射免疫沉淀(RIPA):苯甲基磺酰氟(PMSF)=100:1的蛋白提取溶液提取细胞总蛋白,同时用细胞质和线粒体提取试剂盒提取细胞质和线粒体蛋白。每组样品上样40 μg,肉眼观察溴酚蓝电泳到分离胶的底部后终止电泳。把凝胶取出,调整300 mA电流转膜。经封闭液封闭以后,再放一抗、二抗反应液中继续2 h,ECL显色,用软件Quantity One扫描灰度值,分析蛋白表达水平。线粒体中Cyt-C蛋白内参为porin,细胞总蛋白中p21、Cyclin D1、C-Caspase-3水平和细胞质中Cyt-C蛋白内参均为β-肌动蛋白。p21、Cyclin D1、C-Caspase-3抗体以1:600稀释,Cyt-C抗体以1:200稀释,β-肌动蛋白抗体以1:1 000稀释,porin抗体以1:800稀释。
8.平板克隆实验检测细胞放射敏感性:把阴性对照组、sh-HULC组细胞用胰蛋白酶消化后,分别接种到6孔细胞培养板中,给予0、2、4、6和8 Gy X射线照射处理,放在培养箱中静置培养13 d。用1%的结晶紫染色以后,在显微镜下观察细胞克隆数目。根据单击多靶模型参数值拟合存活曲线,计算细胞存活分数,方法同文献[7]。
9.统计学处理:采用SPSS 21.0统计软件进行数据分析,计量资料用x±s表示,两组数据符合正态分布采用独立样本t检验,多组差异比较经方差齐性检验采用单因素方差分析,组间比较用LSD-t检验,P < 0.05为差异有统计学意义。
结果1. HULC shRNA慢病毒下调HULC表达:阴性对照组、sh-HULC组细胞中HULC水平分别为:1.00和0.45±0.08。HULC shRNA慢病毒感染后的骨肉瘤细胞中的HULC表达水平明显降低。HULC shRNA可以明显下调骨肉瘤细胞中HULC表达。
2. HULC shRNA慢病毒协同放射抑制细胞增殖并阻滞细胞周期:HULC shRNA慢病毒感染和放射处理后的骨肉瘤细胞存活率降低,差异有统计学意义(F=28.910, P < 0.05)。G1期细胞比例升高,差异有统计学意义(F=11.591, P < 0.05),S期比例降低,差异有统计学意义(F=53.305, P < 0.05),G2期比例没有变化,差异无统计学意义(P>0.05);周期抑制因子p21蛋白表达升高,周期促进因子Cyclin D1蛋白表达水平降低,差异均有统计学意义(F=40.311、24.539,P < 0.05),并且二者联合使用后细胞存活率下降更多,差异有统计学意义(F=28.910, P < 0.05),G1期细胞比例升高更多,差异有统计学意义(F=11.591, P < 0.05),S期比例更低,差异有统计学意义(F=53.305, P < 0.05),G2期比例没有变化(P>0.05),周期抑制因子p21蛋白表达更高,周期促进因子Cyclin D1蛋白表达水平更低,差异均有统计学意义(F=40.311、24.539,P < 0.05),具有协同作用。下调HULC能够协同放射抑制骨肉瘤细胞增殖和周期进展(图 1和表 1)。
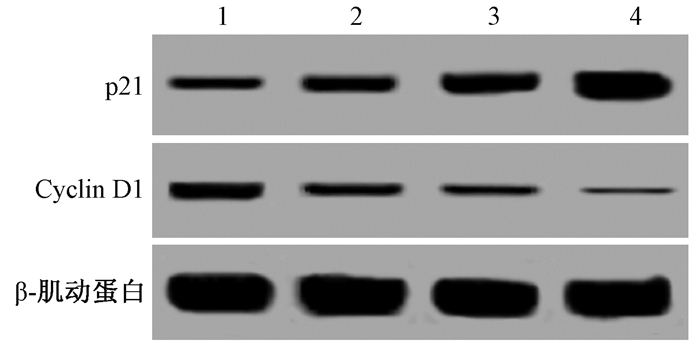
|
注:1.阴性对照组;2.sh-HULC组;3.单纯照射组;4.照射+ sh-HULC组 图 1 Western blot检测各组细胞中p21和Cyclin D1蛋白表达 Figure 1 Western blot analysis of p21 and Cyclin D1 protein expression in cells of each group |
|
|
表 1 各组p21和Cyclin D1蛋白表达及细胞存活率和周期分布(x±s) Table 1 Expression of p21 and Cyclin D1 protein cell survival rate and cell cycle distribution in each group(x±s) |
3. HULC shRNA慢病毒协同放射诱导细胞凋亡:HULC shRNA慢病毒感染和放射处理后的骨肉瘤细胞凋亡率和凋亡蛋白C-Caspase-3水平均升高,差异有统计学意义(F=79.604、97.696,P < 0.05),并且二者联合后具有协同作用,骨肉瘤细胞凋亡率和凋亡蛋白C-Caspase-3水平升高更多,差异有统计学意义(F=79.604、97.696,P < 0.05)。下调HULC能够协同放射共同促进骨肉瘤细胞凋亡(图 2和表 2)。
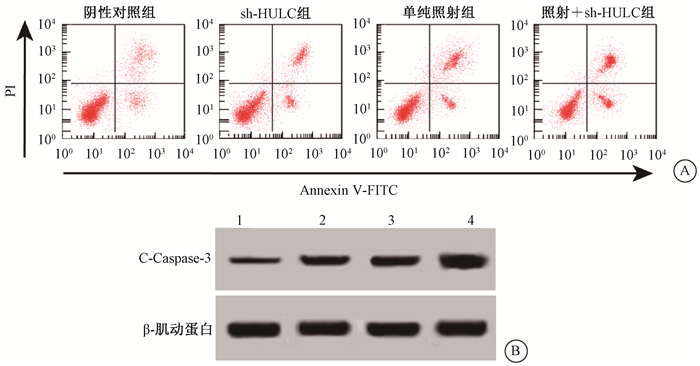
|
注:1.阴性对照组;2.sh-HULC组;3.单纯照射组;4.照射+ sh-HULC组 图 2 HULC shRNA慢病毒感染和放射后细胞凋亡率和凋亡蛋白C-Caspase-3表达变化 A.流式细胞术检测细胞凋亡;B. Western blot检测C-Caspase-3蛋白表达变化 Figure 2 Apoptotic rate and expression of apoptotic protein C-Caspase-3 after HULC shRNA lentivirus infection and irradiation A.Flow cytometry assay of apoptosis; B.Western blot assay of C\|Caspase\|3 protein expression |
|
|
表 2 各组细胞C-Caspase-3蛋白水平和凋亡率(x±s) Table 2 C-Caspase-3 protein level and apoptotic rate of cells in each group(x±s) |
4. HULC shRNA慢病毒协同放射促进细胞线粒体释放Cyt-C:HULC shRNA慢病毒感染和放射处理后的骨肉瘤细胞细胞质中Cyt-C蛋白水平升高,差异有统计学意义(F=79.546、89.913,P < 0.05),线粒体中Cyt-C蛋白水平降低,并且二者联合后,骨肉瘤细胞细胞质中Cyt-C蛋白水平升高更多,线粒体中Cyt-C蛋白水平降低更多,差异均有统计学意义(F=79.546、89.913,P < 0.05)。具有协同作用。下调HULC能够协同放射共同促进骨肉瘤细胞线粒体中Cyt-C释放(图 3和表 3)。
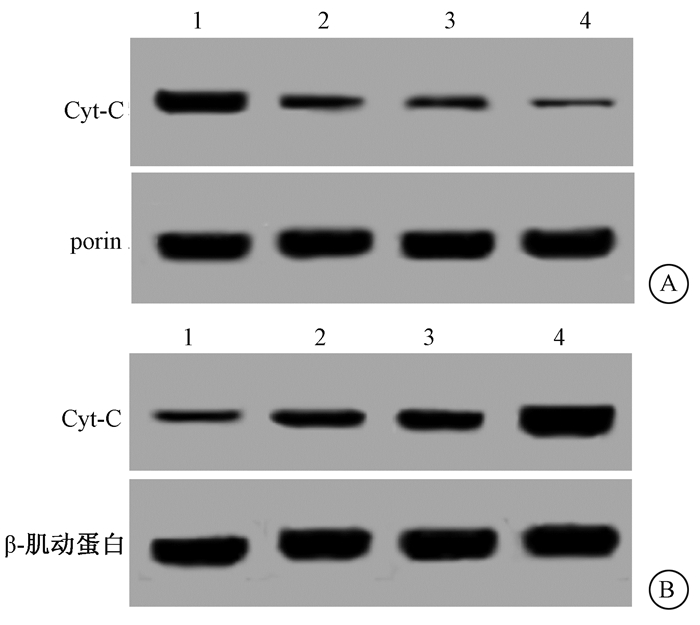
|
注:1.阴性对照组;2.sh-HULC组;3.单纯照射组;4.照射+ sh-HULC组 图 3 各组细胞胞质和线粒体中Cyt-C蛋白表达 A.线粒体;B.细胞质 Figure 3 Western blot assay of Cyt-C protein expression in cytoplasm and mitochondria of each group A. Mitochondria; B. Cytoplasm |
|
|
表 3 各组细胞胞质和线粒体中Cyt-C蛋白变化(x±s) Table 3 Cyt-C protein changes in cytoplasm and mitochondria of cells in each group(x±s) |
5. HULC shRNA慢病毒提高细胞放射敏感性:HULC shRNA慢病毒感染后的骨肉瘤细胞经过2、4、6和8 Gy X射线剂量照射处理以后,细胞存活分数降低,计算其放射增敏比为1.432,HULC shRNA可以提高骨肉瘤细胞放射敏感性,见图 4。
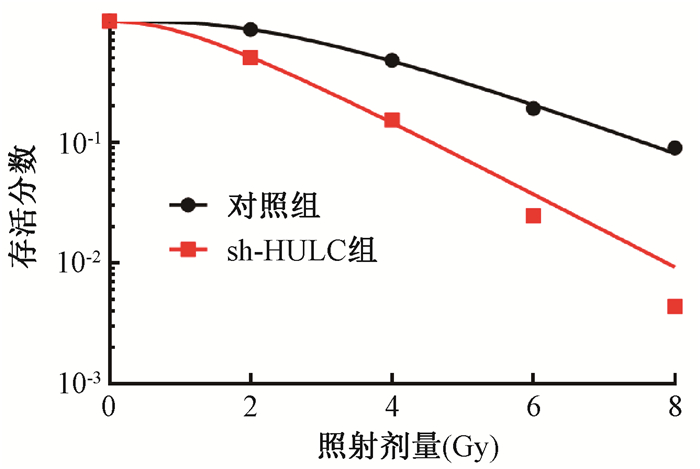
|
图 4 不同剂量照射后骨肉瘤细胞的存活曲线 Figure 4 Survival curve of osteosarcoma cells after different doses of irradiation |
讨论
LncRNA因缺乏开放阅读框而不能编码蛋白质,其通常是由RNA聚合酶Ⅱ转录形成的,LncRNA一致被认为是人类基因组的“噪音”,随着人们对LncRNA不断的研究发现人体中80%的LncRNA有生物学特性,分别在人体正常生理和病理过程中发挥作用[8-10]。HULC作为一种LncRNA与肿瘤的发生密切相关,在胰腺癌、结直肠癌、胶质瘤等肿瘤中发现HULC异常高表达与肿瘤患者的分期、预后等有关,并且干扰癌细胞中HULC表达,细胞增殖能力降低,HULC在肿瘤发生中可能发挥促进作用[11-12]。之前在骨肉瘤中的研究报道显示,HULC高表达与肿瘤的恶性进展密切相关[6]。本研究中,在体外骨肉瘤细胞中发现下调HULC可以抑制骨肉瘤细胞增殖、阻滞细胞周期并诱导细胞凋亡,这进一步证实了HULC在骨肉瘤细胞生物学特性中的作用,HULC可能是骨肉瘤恶性发现的促进因子,这与上述的研究结果相符合。
在前列腺癌细胞中发现HULC具有抗肿瘤细胞辐射的作用,HULC还与肿瘤放射敏感性有关[13]。本研究结果显示,下调HULC具有协同放射阻滞骨肉瘤细胞周期、抑制细胞增殖和诱导细胞凋亡的作用,并且下调HULC后的骨肉瘤细胞放射敏感性增加,证实了HULC在骨肉瘤细胞放射敏感性中的作用,靶向抑制HULC可能是增强骨肉瘤患者放射敏感性的途径,这与上述前列腺癌中的研究相符。
细胞生物学特性的发挥受到细胞内多种蛋白的表达调控作用。细胞周期有序进展是细胞增殖的基础,p21是细胞周期抑制因子,Cyclin D1可以促进细胞从G1期向S期转变,Cyclin D1表达减少能够将细胞周期阻滞在G1期[14-16]。Caspase-3是Caspase凋亡反应的效应因子,其活化生成C-Caspase-3是细胞凋亡进入不可逆阶段的标志[17-19]。正常情况下Cyt-C多存在于线粒体中,其在受到细胞凋亡信号刺激以后可以穿过线粒体膜进入细胞质中,细胞质中的Cyt-C可以激活Caspase凋亡反应,从而诱导细胞凋亡发生[20-22]。本研究结果证实下调HULC可以协同放射共同促进骨肉瘤细胞中C-Caspase-3、p21表达,减少细胞中Cyclin D1表达,并且下调HULC还可以诱导骨肉瘤细胞线粒体中Cyt-C进入细胞质,这提示下调HULC提高骨肉瘤细胞放射敏感性可能与调控p21、Cyclin D1阻滞细胞周期和促进线粒体释放Cyt-C诱导细胞凋亡有关。
总之,靶向下调HULC可能是提高骨肉瘤患者生存质量的潜在途径,下调HULC可以在体外阻滞细胞周期并诱导细胞凋亡,提高细胞放射敏感性,目前对于其作用机制的研究尚处于初级阶段,在以后的实验中会进行验证和探讨。本研究结果明确了HULC在骨肉瘤放射敏感性中的作用,为研究HULC在骨肉瘤中的作用机制提供了参考。
利益冲突 无作者贡献声明 丁帅负责实验设计和论文撰写;高延征负责指导论文撰写;张广泉和陈书连负责数据采集和统计分析;曹臣和李向羽负责实验操作
| [1] |
Zhang W, Tanaka M, Sugimoto Y, et al. Carbon-ion radiotherapy of spinal osteosarcoma with long-term follow[J]. Eur Spine J, 2016, 25(Suppl 1): 113-117. DOI:10.1007/s00586-015-4202-9 |
| [2] |
Mohamad O, Imai R, Kamada T, et al. Carbon ion radiotherapy for inoperable pediatric osteosarcoma[J]. Oncotarget, 2018, 9(33): 22976-22985. DOI:10.18632/oncotarget.25165 |
| [3] |
Wang J, Liu X, Wu H, et al. CREB up-regulates long non-coding RNA, HULC expression through interaction with microRNA-372 in liver cancer[J]. Nucleic Acids Res, 2010, 38(16): 5366-5383. DOI:10.1093/nar/gkq285 |
| [4] |
Jin C, Shi W, Wang F, et al. Long non-coding RNA HULC as a novel serum biomarker for diagnosis and prognosis prediction of gastric cancer[J]. Oncotarget, 2016, 7(32): 51763-51772. DOI:10.18632/oncotarget.10107 |
| [5] |
Lu Z, Xiao Z, Liu F, et al. Long non-coding RNA HULC promotes tumor angiogenesis in liver cancer by up-regulating sphingosine kinase 1(SPHK1)[J]. Oncotarget, 2016, 7(1): 241-254. DOI:10.18632/oncotarget.6280 |
| [6] |
Uzan VR, Av L, Boldrini É, et al. High expression of HULC is associated with poor prognosis in osteosarcoma patients[J]. PloS One, 2016, 11(6): e0156774. DOI:10.1371/journal.pone.0156774 |
| [7] |
Yang Z, Wa QD, Lu C, et al. miRâ328â3p enhances the radiosensitivity of osteosarcoma and regulates apoptosis and cell viability via H2AX[J]. Oncol Rep, 2018, 39(2): 545-553. DOI:10.3892/or.2017.6112 |
| [8] |
Nie W, Ge HJ, Yang XQ, et al. LncRNA-UCA1 exerts oncogenic functions in non-small cell lung cancer by targeting miR-193a-3p[J]. Cancer Lett, 2016, 371(1): 99-106. DOI:10.1016/j.canlet.2015.11.024 |
| [9] |
Sun M, Nie F, Wang Y, et al. LncRNA HOXA11-AS promotes proliferation and invasion of gastric cancer by scaffolding the chromatin modification factors PRC2, LSD1 and DNMT1[J]. Cancer Res, 2016, 76(21): 6299-6310. DOI:10.1158/0008-5472.CAN-16-0356 |
| [10] |
Pan W, Liu L, Wei J, et al. A functional lncRNA HOTAIR genetic variant contributes to gastric cancer susceptibility[J]. Mol Carcinog, 2016, 55(1): 90-96. DOI:10.1002/mc.22261 |
| [11] |
Shaker OG, Senousy MA, Elbaz EM. Association of rs6983267 at 8q24, HULC rs7763881 polymorphisms and serum lncRNAs CCAT2 and HULC with colorectal cancer in Egyptian patients[J]. Sci Rep, 2017, 7(1): 16246. DOI:10.1038/s41598-017-16500-4 |
| [12] |
Hong Y, Rui T, Min Z, et al. High expression of long noncoding RNA HULC is a poor predictor of prognosis and regulates cell proliferation in glioma[J]. Onco Targets Ther, 2017, 21(10): 113-120. DOI:10.2147/OTT.S124614 |
| [13] |
Chen C, Wang K, Wang Q, et al. LncRNA HULC mediates radioresistance via autophagy in prostate cancer cells[J]. Braz J Med Biol Res, 2018, 51(6): e7080. DOI:10.1590/1414-431x20187080 |
| [14] |
Wu W, Liu Q, Liu Y, et al. Dixdc1 targets Cyclin D1 and p21 via PI 3K pathway activation to promote Schwann cell proliferation after sciatic nerve crush[J]. Biochem Biophys Res Commun, 2016, 478(2): 956-963. DOI:10.1016/j.bbrc.2016.08.058 |
| [15] |
Ren L, Li Z, Dai C, et al. Chrysophanol inhibits proliferation and induces apoptosis through NF-κB/Cyclin D1 and NF-κB/Bcl-2 signaling cascade in breast cancer cell lines[J]. Mol Med Rep, 2018, 17(3): 4376-4382. DOI:10.3892/mmr.2018.8443 |
| [16] |
Cheng R, Liu YJ, Cui JW, et al. Aspirin regulation of c-myc and Cyclin D1 proteins to overcome tamoxifen resistance in estrogen receptor-positive breast cancer cells[J]. Oncotarget, 2017, 8(18): 30252-30264. DOI:10.18632/oncotarget.16325 |
| [17] |
Pu X, Storr SJ, Zhang Y, et al. Caspase-3 and caspase-8 expression in breast cancer:caspase-3 is associated with survival[J]. Apoptosis, 2017, 22(3): 357-368. DOI:10.1007/s10495-016-1323-5 |
| [18] |
Tokunaga T, Ando T, Suzukikarasaki M, et al. Plasma-stimulated medium kills TRAIL-resistant human malignant cells by promoting caspase-independent cell death via membrane potential and calcium dynamics modulation[J]. Int J Oncol, 2018, 52(3): 697-708. DOI:10.3892/ijo.2018.4251 |
| [19] |
Li L, Mao X, Qin X, et al. Aspirin inhibits growth of ovarian cancer by upregulating caspase-3 and downregulating bcl-2[J]. Oncol Lett, 2019, 17(5): 4742. DOI:10.3892/ol.2019.10108 |
| [20] |
Ying J, Xu J, Shen L, et al. The effect of sodium fluoride on cell apoptosis and the mechanism of human lung BEAS-2B cells in vitro[J]. Biol Trace Elem Res, 2017, 179(1): 59-69. DOI:10.1007/s12011-017-0937-y |
| [21] |
Chen H, Wang J, Liu Z, et al. Mitochondrial DNA depletion causes decreased ROS production and resistance to apoptosis[J]. Int J Mol Med, 2016, 38(4): 1039-1046. DOI:10.3892/ijmm.2016.2697 |
| [22] |
Han X, Liu C, Zhang K, et al. Calpain and JNK pathways participate in isoflurane-induced nucleus translocation of apoptosis-inducing factor in the brain of neonatal rats[J]. Toxicology Lett, 2017, 15(285): 60-73. DOI:10.1016/j.toxlet.2017.12.022 |
 2019, Vol. 39
2019, Vol. 39


