2. 辽宁省乳腺及消化肿瘤分子标志物高通量筛选及靶向药物转化重点实验室, 大连 116001
2. The Key Laboratory of Biomarker High Throughput Screening and Target Translation of Breast and Gastrointestinal Tumor, Dalian 116001, China
随着调强放疗技术的进步与广泛应用,鼻咽癌的5年局部控制率对比常规2D放疗提高了7.7%[1],但仍有5%~15%患者局部控制失败,15%~30%的患者治疗后发生远处转移[2],因此增加放射敏感性,有效控制鼻咽癌远处转移的方法是目前鼻咽癌放射治疗的难点,新型靶向药物联合放疗实现降低放疗不良反应与提高疗效是未来临床治疗的突破点。
阿帕替尼通过特异性抑制血管内皮细胞生长因子受体2(VEGFR2)磷酸化阻断下游信号通路达到抗血管生成目的,发挥抗肿瘤作用[3]。既往研究表明,阿帕替尼可以降低脐静脉内皮细胞、肝癌细胞、骨肉瘤细胞和胆管癌细胞等迁移能力[4-7],但其对鼻咽癌细胞的抑制作用鲜有报道。本研究旨在研究阿帕替尼对鼻咽癌细胞X射线照射后迁移能力的影响与机制,探讨其联合放射治疗的应用前景。
材料与方法1.主要试剂与仪器:RPMI 1640培养基和胎牛血清购自美国GIBCO公司,阿帕替尼由江苏恒瑞医药股份有限公司提供。CCK-8试剂盒购自日本同仁公司,所有一抗均购自美国CST公司,二抗购自美国Abbkine公司。酶标仪购自美国Bio-Rad公司。
2.细胞与培养:鼻咽癌细胞系CNE-1和CNE-2由大连大学附属中山医院肿瘤科保存,人永生化鼻咽上皮细胞NP69由中山大学肿瘤中心马骏教授慷慨赠送。用含10%胎牛血清的RPMI 1640培养基培养细胞于37℃、5% CO2加湿培养箱中。
3.细胞照射:采用瑞典医科达Synergy®直线加速器6 MV、4 Gy的X射线垂直照射细胞,剂量率为600 cGy/min。源靶距100 cm。
4. CCK-8细胞活性检测:CNE-1每孔3 000细胞数、CNE-2每孔4 000细胞数接种到96孔板,接种过夜后用0、5、10和15 μmol/L浓度阿帕替尼分别处理细胞,药物干预24 h后根据CCK-8检测试剂说明书进行细胞活性检测。
5.划痕实验:CNE-1每孔3.8×105细胞数、CNE-2每孔4.2×105细胞数接种到6孔板,待细胞铺满板底后,每孔划一道划痕,用磷酸盐缓冲液(PBS)清洗细胞后。加入不同浓度阿帕替尼(5、10和15 μmol/L),观察其与对照组(0 μmol/L)对鼻咽癌细胞迁移影响。将细胞分为对照组、阿帕替尼组、照射组和阿帕替尼联合照射组。划痕后在0和24 h对划道进行拍照,用ImageJ软件分析计算划痕面积,迁移面积=(0 h划痕面积-24 h划痕面积)/ 0 h划痕面积,迁移指数(mgration index)=实验组迁移面积/对照组迁移面积。
6.蛋白免疫印迹实验:将不同药物浓度干预的细胞加入含1%蛋白酶抑制剂和磷酸酶抑制剂的细胞裂解液收集蛋白质,用Bradford法蛋白定量,取等量蛋白变性。制备8%的十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)用于分离蛋白,并转移到聚偏氟乙烯(PVDF)膜上。转膜后用5%脱脂牛奶室温封闭1 h,4℃与相应的一抗孵育过夜,然后用二抗标记。样品用3(羟甲基)氨基甲烷-盐酸缓冲盐溶液(TBST)彻底清洗后用化学法对印记条带进行观察检测。
7. qPCR实验:将细胞分为对照组和阿帕替尼组(10 μmol/L),细胞经药物处理24 h后,加入RNAisoplus裂解收取RNA,根据反转录试剂盒合成cDNA,用Real-time PCR试剂盒检测ZEB-2表达水平。ACTIN正向引物为5′ TTGCCGACAGGATGCAGAA 3′,反向引物5′ GCCGATCCACACGGAGTACT 3′;ZEB-2正向引物为5′ AGCAAAGGAGAAAGTACCAGCG 3′,反向引物5′ GAGTGAAGCCTTGAGTGCTCG 3′。反应程序:95℃预变性10 min,1个循环;95℃ 15 s,60℃ 60 s,40个循环。反应结束后得到内参基因ACTIN和目的基因ZEB-2的Ct值,2-ΔΔCt法分析ZEB-2的表达水平。
8.统计学处理:所有实验重复3次,取均值。采用SPSS 20.0统计软件进行数据分析。数据符合正态分布,以x±s表示。两组间比较采用独立样本t检验。P < 0.05为差异有统计学意义。
结果1.鼻咽癌细胞与人永生化鼻咽上皮细胞迁移能力对比:NP69、CNE-1和CNE-2划痕后观察0和24 h的愈合情况,结果如图 1所示。与永生化鼻咽上皮细胞NP69相比,鼻咽癌CNE-1、CNE-2细胞划痕愈合速率更快,比较组间划痕面积,计算迁移指数,分别为1.00±0.27、3.18±0.59和4.43±0.22,差异具有统计学意义(t=-5.759、-16.578,P < 0.05)。

|
图 1 人永生化鼻咽上皮细胞和鼻咽癌细胞迁移能力×4 Figure 1 Comparison of migration ability of human immortalized nasopharyngeal epithelial cells and nasopharyngeal carcinoma cells ×4 |
2.阿帕替尼对鼻咽癌细胞增殖抑制的影响:不同浓度阿帕替尼(0、10、20、30、40、50和60 μmol/L)预处理后,鼻咽癌细胞出现不同程度的增殖抑制,并且随着药物浓度的增高,其增殖率逐渐降低。CNE-1和CNE-2增殖抑制率分别为(8.49±1.83)%~(77.08±2.60)%和(10.65±0.82)%~(88.96±2.60)%。CNE-1和CNE-2细胞用阿帕替尼作用24 h后的半数抑制浓度(IC50)分别为40.96和23.03 μmol/L。故选取0、5、10和15 μmol/L进一步检测低浓度阿帕替尼对鼻咽癌细胞增殖抑制的影响,与对照组(0 μmol/L)相比,15 μmol/L浓度阿帕替尼干预后,鼻咽癌细胞CNE-1和CNE-2细胞活性为(100.62±3.43)%和(92.91±6.34)%,无明显增殖抑制作用(P>0.05)。
3.阿帕替尼对鼻咽癌细胞迁移能力的影响:结果如图 2所示,与对照组(0 μmol/L)相比,阿帕替尼干预后鼻咽癌CNE-1和CNE-2细胞划痕愈合速率明显降低,并且具有剂量依赖性。通过比较组间划痕面积计算迁移指数,CNE-1和CNE-2细胞0、5、10、15 μmol/L组的迁移指数分别为1.00±0.18、0.69±0.03、0.50±0.11、0.34±0.08和1±0.05、0.56±0.08、0.34±0.10、0.39±0.09,与0 μmol/L比较,差异具有统计学意义(tCNE-1=2.804、3.989、5.615,P < 0.05;tCNE-2=7.835、10.399、13.362,P < 0.05),提示阿帕替尼对鼻咽癌细胞的迁移能力有明显抑制作用。

|
图 2 不同浓度阿帕替尼对鼻咽癌细胞迁移能力的影响×4 A. CNE-1;B. CNE-2 Figure 2 Effects of different concentrations of apatinib on migration ability of nasopharyngeal carcinoma cells×4 A. CNE-1;B. CNE-2 |
4.阿帕替尼对X射线照射后鼻咽癌细胞迁移能力的影响:结果如图 3所示。与对照组比较,照射组CNE-1和CNE-2细胞划痕愈合速率无明显差异,计算其迁移指数,分别为1.00±0.08、0.93±0.14和1.00±0.08、0.80±0.16,差异无统计学意义(P>0.05);但与照射组相比,阿帕替尼联合照射组细胞划痕愈合速率明显降低,其迁移指数分别为0.93±0.14、0.46±0.03和0.80±0.16、0.54±0.06,差异有统计学意义(tCNE-1=5.932,P < 0.05;tCNE-2=2.791,P < 0.05);与对照组相比,阿帕替尼联合照射组划痕愈合速率明显降低,其迁移指数分别为1.00±0.08、0.46±0.03和1.00±0.08、0.54±0.06,差异有统计学意义(tCNE-1=10.525,P < 0.05;tCNE-2=8.076,P < 0.05),进一步提示阿帕替尼能够抑制照射后细胞的迁移能力。

|
注:1.对照组;2.阿帕替尼组;3.照射组;4.阿帕替尼联合照射组 图 3 阿帕替尼及X射线照射对鼻咽癌细胞迁移能力的影响×4 A. CNE-1;B. CNE-2 Figure 3 Effect of apatinib and radiation on migration ability of nasopharyngeal carcinoma cells ×4 A. CNE-1; B. CNE-2 |
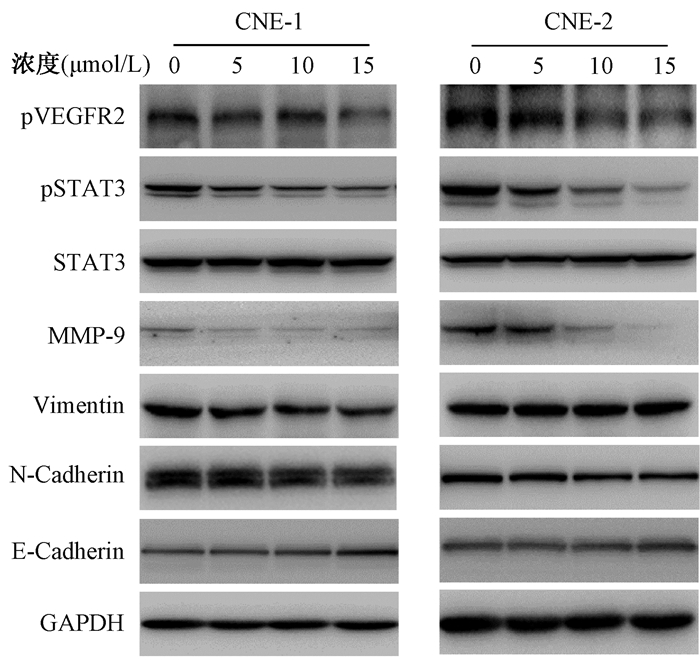
5.阿帕替尼对鼻咽癌细胞信号转导通路及EMT相关蛋白表达和活化情况的影响:阿帕替尼(10 μmol/L)干预后鼻咽癌细胞CNE-1和CNE-2的目的基因ZEB-2的mRNA表达水平分别是对照组(0 μmol/L)的(40±6)%和(54±2)%,差异有统计学意义(tCNE-1=9.954,P < 0.05;tCNE-2=5.837,P < 0.05);此外,阿帕替尼对细胞信号转导通路中VEGFR2和STAT3的磷酸化具有剂量依赖性抑制作用,同时MMP-9蛋白的表达也呈显著的剂量依赖性抑制。特别是在CNE-1细胞中,高浓度(15 μmol/L)阿帕替尼处理后,EMT相关蛋白E-Cadherin表达显著上调,Vimentin蛋白也有下降趋势,见图 4。
|
图 4 阿帕替尼对CNE-1和CNE-2 VEGFR2/STAT3/MMP-9细胞信号转导通路及EMT相关蛋白表达的影响 Figure 4 Effect of apatinib on the expression of VEGFR2/STAT3/ MMP-9 cell signal transduction pathway and EMT-related protein in CNE-1 and CNE-2 |
讨论
回顾性分析鼻咽癌患者IMRT效果显示仍然有15%~30%的患者放疗后发生远处转移[8]。IMRT后局部与区域失败模式研究结果显示复发患者中81.1%为照射野内复发,提示18.9%患者在放疗后出现转移复发的情况[9]。鼻咽癌放疗后远处转移是目前治疗失败的主要原因,也是当前治疗主要的难点,因此寻找降低鼻咽癌远处转移的方法是必要的。
由于阿帕替尼提高晚期胃癌和胃食管连接处癌无进展生存期(PFS)和总生存期(OS)[10-11],其被列入胃癌三线治疗的唯一推荐靶向药物。现有的临床研究也表明,铂耐药难治性卵巢癌对阿帕替尼和依托泊苷联合治疗客观缓解率(ORR)达到54%[12],阿帕替尼对复发及难治性非霍奇金淋巴瘤的ORR达到47.6%[13]。此外多种肿瘤动物模型也表明阿帕替尼能显著抑制肿瘤生长[14-17]。与此同时,既往研究证实,不同浓度阿帕替尼(5~ 60 μmol/L)能抑制多种肿瘤细胞的迁移[4-5, 18-19]。并有研究发现,阿帕替尼可以增加食管癌细胞的放射敏感性[20]。本研究划痕实验结果表明,与对照组相比,阿帕替尼干预24 h后,鼻咽癌细胞划痕愈合速率均明显降低,并具有一定的剂量依赖性。Zheng等[4]和Ding等[19]通过小室迁移实验表明,阿帕替尼干预后,骨肉瘤细胞和卵巢癌细胞通过小室的数量显著减少,划痕实验也表明阿帕替尼干预后,划痕愈合速率降低。作者认为这种迁移能力的降低,与阿帕替尼对肿瘤细胞STAT3的磷酸化抑制有关。
既往研究已表明STAT3的高磷酸化增强了鼻咽癌细胞的侵袭和迁移能力[21-22],提示STAT3的磷酸化水平和鼻咽癌细胞的侵袭和迁移能力密切相关。在阿帕替尼的干预下,鼻咽癌细胞的这种高迁移能力被抑制,这可能和阿帕替尼抑制鼻咽癌细胞STAT3的磷酸化有关。有研究表明,VEGF可以激活乳腺癌细胞的VEGFR2,使得VEGFR2和STAT3形成复合体,激活STAT3,启动下游的相关信号通路[23],而阿帕替尼可以抑制骨肉瘤细胞VEGFR2/STAT3/MMP-9信号通路的激活,降低骨肉瘤细胞的侵袭和迁移能力[4, 17]。此外也有相关的文献报道表明,MMP-9表达下调可以减弱血管平滑肌细胞[24]、乳腺癌细胞[25]和宫颈癌细胞[26]的迁移能力。本研究结果提示,阿帕替尼同样可以抑制鼻咽癌细胞VEGFR2的磷酸化和STAT3的磷酸化,进而下调MMP-9的表达,从而表明阿帕替尼可能通过抑制VEGFR2/STAT3/MMP-9信号通路,降低鼻咽癌细胞迁移能力。
阿帕替尼降低鼻咽癌迁移能力还可能和细胞EMT相关。目前研究认为,STAT3的活化可以促进EMT的发生,其可通过调控Twist、Snail、ZEB-2等转录因子的表达影响EMT的发生[27]。本研究中,阿帕替尼处理的鼻咽癌细胞STAT3的磷酸化被抑制,ZEB-2的RNA表达水平也降低,进而上皮型钙黏蛋白(E-cadherin)表达上调,神经型钙粘蛋白(N-cadherin)和波形蛋白(Vimentin)表达下调。本研究结果与Zheng等[4]和Ding等[19]的研究一致,在阿帕替尼的干预后,骨肉瘤细胞和卵巢癌细胞的EMT被逆转。EMT是上皮细胞获得间充质表型的关键过程,和肿瘤转移密切相关。EMT细胞可以获得入侵、抵抗凋亡和传播的能力[28],因此推测阿帕替尼能通过抑制STAT3的磷酸化抑制EMT, 进而抑制细胞的迁移能力。
本研究结果显示,单次X射线照射可能对鼻咽癌细胞迁移能力无明显影响,X射线照射后的鼻咽癌细胞愈合速率未明显降低,这与Yang等[8]的研究结果一致。但联合阿帕替尼后,X射线照射后的鼻咽癌细胞划痕愈合速度明显降低,表明阿帕替尼可显著降低X射线照射后鼻咽癌细胞迁移能力。而Su等[29]的研究发现,鼻咽癌耐辐射细胞发生EMT,其迁移能力增强。这提示在肿瘤的放射治疗后,放疗抵抗的肿瘤细胞易发生侵袭和转移,因此,阿帕替尼联合X射线照射可能有降低鼻咽癌在放疗后发生侵袭和转移的效果,进而增加鼻咽癌放疗的疗效。
本研究结果表明,阿帕替尼能通过下调VEGFR2/STAT3/MMP-9信号通路抑制鼻咽癌细胞EMT化,从而抑制X射线照射后鼻咽癌细胞的迁移。这可为阿帕替尼联合放疗,降低鼻咽癌复发转移提供一定的理论依据。
利益冲突 无作者贡献声明 毛绩伟负责实验和论文攥写;王喆、王漂、梁珊珊参与研究设计与指导,提出指导意见;鞠再双、杨亮和蔡龙玉负责数据统计;王若雨负责论文审核
| [1] |
MLK C, JTS W, Hui EP, et al. Nasopharyngeal carcinoma[J]. Lancet, 2016, 387(10022): 1012-1024. DOI:10.1016/S0140-6736(15)00055-0 |
| [2] |
Lee AW, Ma BB, Ng WT, et al. Management of nasopharyngeal carcinoma:current practice and future perspective[J]. J Clin Oncol, 2015, 33(29): 3356-3364. DOI:10.1200/JCO.2015.60.9347 |
| [3] |
Roviello G, Ravelli A, Polom K, et al. Apatinib:A novel receptor tyrosine kinase inhibitor for the treatment of gastric cancer[J]. Cancer Lett, 2016, 372(2): 187-191. DOI:10.1016/j.canlet.2016.01.014 |
| [4] |
Zheng B, Ren T, Huang Y, et al. Apatinib inhibits migration and invasion as well as PD-L1 expression in osteosarcoma by targeting STAT3[J]. Biochem Biophys Res Commun, 2018, 495(2): 1695-1701. DOI:10.1016/j.bbrc.2017.12.032 |
| [5] |
姜增凯, 叶晓歌, 陈琴华, 等. 阿帕替尼对肝癌细胞增殖和迁移能力的影响研究[J]. 中国临床药理学杂志, 2016, 32(15): 1422-1424. Jiang ZK, Ye XG, Chen QH, et al. Effect of apatinib on the proliferation and migration of liver cancer cells[J]. Chin J Clinic Phar, 2016, 32(15): 1422-1424. DOI:10.13699/j.cnki.1001-6821.2016.15.023 |
| [6] |
Yang C, Qin S. Apatinib targets both tumor and endothelial cells in hepatocellular carcinoma[J]. Cancer Med, 2018, 7(9): 4570-4583. DOI:10.1002/cam4.1664 |
| [7] |
Huang M, Huang B, Li G, et al. Apatinib affect VEGF-mediated cell proliferation, migration, invasion via blocking VEGFR2/RAF/MEK/ERK and PI3K/AKT pathways in cholangiocarcinoma cell[J]. BMC Gastroenterol, 2018, 18(1): 169. DOI:10.1186/s12876-018-0870-3 |
| [8] |
Yang S, Wu J, Zuo Y, et al. ZD6474, a small molecule tyrosine kinase inhibitor, potentiates the anti-tumor and anti-metastasis effects of radiation for human nasopharyngeal carcinoma[J]. Curr Cancer Drug Targets, 2010, 10(6): 611-622. DOI:10.2174/156800910791859506 |
| [9] |
孔芳芳, 应红梅, 黄爽, 等. 鼻咽癌IMRT后局部与区域失败模式研究[J]. 中华放射肿瘤学杂志, 2016, 25(2): 95-99. Kong FF, Ying HM, Huang S, et al. Patterns of local-regional failure after intensity-modulated radiotherapy for nasopharyngeal carcinoma[J]. Chin J Radiat Oncol, 2016, 25(2): 95-99. DOI:10.3760/cma.j.issn.1004-4221.2016.02.002 |
| [10] |
Li J, Qin S, Xu J, et al. Apatinib for chemotherapy-refractory advanced metastatic gastric cancer:results from a randomized, placebo-controlled, parallel-arm, phase Ⅱ trial[J]. J Clin Oncol, 2013, 31(26): 3219-3225. DOI:10.1200/JCO.2013.48.8585 |
| [11] |
Li J, Qin S, Xu J, et al. Randomized, double-blind, placebo-controlled phase Ⅲ trial of apatinib in patients with chemotherapy-refractory advanced or metastatic adenocarcinoma of the stomach or gastroesophageal junction[J]. J Clin Oncol, 2016, 34(13): 1448-1454. DOI:10.1200/JCO.2015.63.5995 |
| [12] |
Lan CY, Wang Y, Xiong Y, et al. Apatinib combined with oral etoposide in patients with platinum-resistant or platinum-refractory ovarian cancer (AEROC):a phase 2, single-arm, prospective study[J]. Lancet Oncol, 2018, 19(9): 1239-1246. DOI:10.1016/S1470-2045(18)30349-8 |
| [13] |
Li L, Xiao S, Zhang L, et al. An open label, single-armed, exploratory study of apatinib (a novel VEGFR-2 tyrosine kinase inhibitor) in patients with relapsed or refractory non-Hodgkin lymphoma[J]. Oncotarget, 2018, 9(22): 16213-16219. DOI:10.18632/oncotarget.23806 |
| [14] |
Tian S, Quan H, Xie C, et al. YN968D1 is a novel and selective inhibitor of vascular endothelial growth factor receptor-2 tyrosine kinase with potent activity in vitro and in vivo[J]. Cancer Sci, 2011, 102(7): 1374-1380. DOI:10.1111/j.1349-7006.2011.01939.x |
| [15] |
Cheng X, Feng H, Wu H, et al. Targeting autophagy enhances apatinib-induced apoptosis via endoplasmic reticulum stress for human colorectal cancer[J]. Cancer Lett, 2018, 431: 105-114. DOI:10.1016/j.canlet.2018.05.046 |
| [16] |
Jin Z, Cheng X, Feng H, et al. Apatinib inhibits angiogenesis via suppressing Akt/GSK3beta/ANG signaling pathway in anaplastic thyroid cancer[J]. Cell Physiol Biochem, 2017, 44(4): 1471-1484. DOI:10.1159/000485583 |
| [17] |
Liu K, Ren T, Huang Y, et al. Apatinib promotes autophagy and apoptosis through VEGFR2/STAT3/BCL-2 signaling in osteosarcoma[J]. Cell Death Dis, 2017, 8(8): e3015. DOI:10.1038/cddis.2017.422 |
| [18] |
Lu W, Ke H, Qianshan D, et al. Apatinib has anti-tumor effects and induces autophagy in colon cancer cells[J]. Iran J Basic Med Sci, 2017, 20(9): 990-995. DOI:10.22038/IJBMS.2017.9263 |
| [19] |
Ding J, Cheng XY, Liu S, et al. Apatinib exerts anti-tumour effects on ovarian cancer cells[J]. Gynecol Oncol, 2019, 153(1): 165-174. DOI:10.1016/j.ygyno.2019.01.010 |
| [20] |
Hu L, Sun F, Sun Z, et al. Apatinib enhances the radiosensitivity of the esophageal cancer cell line KYSE-150 by inducing apoptosis and cell cycle redistribution[J]. Oncol Lett, 2019, 17(2): 1609-1616. DOI:10.3892/ol.2018.9803 |
| [21] |
Lui VW, Wong EY, Ho Y, et al. STAT3 activation contributes directly to Epstein-Barr virus-mediated invasiveness of nasopharyngeal cancer cells in vitro[J]. Int J Cancer, 2009, 125(8): 1884-1893. DOI:10.1002/ijc.24567 |
| [22] |
Wang Z, Luo F, Li L, et al. STAT3 activation induced by Epstein-Barr virus latent membrane protein1 causes vascular endothelial growth factor expression and cellular invasiveness via JAK3 And ERK signaling[J]. Eur J Cancer, 2010, 46(16): 2996-3006. DOI:10.1016/j.ejca.2010.07.008 |
| [23] |
Zhao D, Pan C, Sun J, et al. VEGF drives cancer-initiating stem cells through VEGFR-2/Stat3 signaling to upregulate Myc and Sox2[J]. Oncogene, 2015, 34(24): 3107-3119. DOI:10.1038/onc.2014.257 |
| [24] |
Sun HJ, Zhao MX, Ren XS, et al. Salusin-beta promotes vascular smooth muscle cell migration and intimal hyperplasia after vascular injury via ROS/NFkappaB/MMP-9 pathway[J]. Antioxid Redox Signal, 2016, 24(18): 1045-1057. DOI:10.1089/ars.2015.6475 |
| [25] |
Conrad C, Götte M, Schlomann U, et al. ADAM8 expression in breast cancer derived brain metastases:Functional implications on MMP-9 expression and transendothelial migration in breast cancer cells[J]. Int J Cancer, 2018, 142(4): 779-791. DOI:10.1002/ijc.31090 |
| [26] |
Deng G, Zhou F, Wu Z, et al. Inhibition of cancer cell migration with CuS@mSiO2-PEG nanoparticles by repressing MMP-2/MMP-9 expression[J]. Int J Nanomedicine, 2018, 13: 103-116. DOI:10.2147/IJN.S148487 |
| [27] |
Wendt MK, Balanis N, Carlin CR, et al. STAT3 and epithelial-mesenchymal transitions in carcinomas[J]. JAKSTAT, 2014, 3(1): e28975. DOI:10.4161/jkst.28975 |
| [28] |
Hanahan D, Weinberg RA. Hallmarks of cancer:the next generation[J]. Cell, 2011, 144(5): 646-674. DOI:10.1016/j.cell.2011.02.013 |
| [29] |
Su Z, Li G, Liu C, et al. Ionizing radiation promotes advanced malignant traits in nasopharyngeal carcinoma via activation of epithelial-mesenchymal transition and the cancer stem cell phenotype[J]. Oncol Rep, 2016, 36(1): 72-78. DOI:10.3892/or.2016.4768 |
 2019, Vol. 39
2019, Vol. 39


