2. 湘南学院基础医学院生物化学教研室, 郴州 423000;
3. 南方医科大学基础医学院生物化学与分子生物学学系, 广州 510000
2. Basic Medical College, Xiangnan University, Chenzhou 423000, China;
3. Department of Biochemistry and Molecular Biology, School of Basic Medical Science, Southern Medical University, Guangzhou 510000, China
辐射依其能量的高低以及电离物质的能力分类为电离辐射和非电离辐射。电离辐射(IR)拥有较高的能量,可将电子电离,使其带正电。高能量的电离辐射所携带的能量可破坏细胞的染色体,使细胞停止生长,可用于对抗快速生长分裂的癌细胞,在临床上被广泛应用于治疗恶性肿瘤。但由于电离辐射在损害癌细胞的同时也会损害正常细胞,随着放射治疗的应用日渐增加,如何减轻放疗的副作用也逐渐成为一个亟待解决的问题。1974年,Brenner首次使用秀丽隐杆线虫(Caenorhabditis elegans)模型研究神经系统的发育,将线虫行为学与遗传学联系在一起,秀丽隐杆线虫逐渐进入人们的视野[1]。1976年,线虫模型首次应用于放射生物学研究[2]。随后,线虫多种基因突变体的获取,尤其是高辐射敏感性突变体,使得线虫模型被广泛应用于辐射研究中。这篇综述将系统介绍线虫模型在电离辐射方面的研究进展。
一、秀丽隐杆线虫作为电离辐射研究模型的特点和优势秀丽隐杆线虫是一种独立生存非寄生的线虫,呈蠕虫状,个体积小,成虫长约1 mm;线虫有雌雄同体和雄性两种性别,以雌雄同体为主。雌雄同体线虫可通过自体受精进行繁殖,这个特性使得诱发的突变体可以通过传代转化为纯合子并无限地保存下去,而不需要通过杂交获得。同时,线虫对于包括辐射在内的环境刺激特别敏感,且其体内与应激相关的基因和蛋白质与哺乳动物之间有较高的相似性。这些优点使得线虫模型广泛应用于遗传发育、行为与神经生物学、衰老与寿命、药物筛选等领域的研究。同时,线虫作为一个优良的活体动物模型,因其具有较多对辐射敏感的突变体、易于观察等特点,也被广泛应用于辐射生物学研究领域。
线虫作为一个优良的模式生物,与小鼠、果蝇等其他模式生物相比,具有独一无二的优势:①易培养,以大肠杆菌OP50等微生物为食;培养环境要求低,只需要放置于恒温培养箱即可;操作简单,占地面小;保存简单,只需要低温下加甘油保护,正常温度下化冻即可复苏。②秀丽隐杆线虫有着非常短的发育周期,在20℃下,从卵发育到成虫并产卵仅需3 d左右,极大缩减了实验耗时。③秀丽线虫全身透明,在体式显微镜下可清晰观察其内部结构以及发育过程中细胞的分裂和死亡。④线虫有着大量的高电离辐射敏感性的突变体和荧光报告品系,可以灵活用于各种实验。⑤线虫的遗传背景非常清晰,线虫基因组(9.7×107碱基)大小仅为人类基因组的1/30,染色体仅有6对,但与人的同源性却高达40%,可用于研究人类相关疾病[3]。
另外,秀丽线虫作为电离辐射模型,其辐射生物学效应观察具有一定的优势,具体表现为:①线虫的发育周期较短,可在短时间内观察到辐射诱导的线虫的死亡率、产卵数目以及寿命的改变。②辐射可诱导线虫的形态发生变化,如线虫身体变粗变短、产生畸形外阴等,而这些都可以在体式显微镜下观察到。③荧光显微镜或者电子显微镜下可观察到辐射诱导的细胞形态改变、有丝分裂细胞的数目、凋亡的细胞、DNA的损伤以及染色体的异常[3]。
二、不同时期秀丽线虫对电离辐射的敏感性由于在真核细胞中产生特定生物效应所需的电离辐射剂量与基因组的大小成反比,故秀丽隐杆线虫模型用于研究电离辐射特性时,所需的剂量远大于哺乳动物。线虫经60Co辐射后,寿命、身体弯曲运动的频率、成虫的产卵量、线虫子代的存活率呈电离辐射剂量依赖性降低,200 Gy时,线虫成虫失去产卵能力,但当辐射剂量达到1 000 Gy时,线虫幼虫仍能发育成成虫[3]。
秀丽隐杆线虫生命周期短,雌雄同体秀丽隐杆线虫产卵,20℃下,受精卵发育到幼虫大约需要13 h,胚胎发育的前期细胞分裂广泛而迅速,6 h后胚胎达到558个细胞,后期为器官和形态形成期,此期细胞分裂停止,同时身体拉长。二细胞期胚胎的37%失活率剂量是6.8 Gy(X射线),37%失活率剂量是指电离辐射使37%的线虫失活时所需的辐射剂量,该指标可用来表示线虫电离辐射的敏感性。受精后1~4 h,胚胎抗性随着胚胎发育而下降,受精后4 h时敏感性最大(37%失活率剂量是4.3 Gy),随后,辐射抗性急剧上升,受精后6 h的37%失活率剂量是184 Gy,6~10 h,辐射抗性保持不变[3]。
线虫卵经孵化后,会经历4次蜕皮,从而有4个幼虫期(L1-L4期)。同步化处理后得到线虫卵孵化12 h后进入L1期,此期幼虫对X射线的辐射抵抗性增加约40倍,但对紫外线的辐射抵抗性仅仅比胚胎大3倍。孵化24、36、48 h后分别进入L2、L3、L4期,而L4期,即使经过1 200 Gy X射线的辐射仍有>63%的线虫存活。Chen等[4]用碳离子辐射对不同时期幼虫进行处理,研究发现当辐射剂量为100 Gy时,L2期出现畸形阴部的比例最大,而L4期几乎不出现畸形阴部,这表明L2期线虫对碳离子辐射最敏感,而L4期对辐射的抵抗力最强。
当环境恶劣时,L2期末期的幼虫会进入一个特殊的时期,这个时期的幼虫会停止发育,幼虫细胞会停留在细胞周期的G1期,此时的幼虫能对抗逆境且不会老化,称为dauer幼虫。当给予食物后,dauer幼虫可直接进入L4期。dauer幼虫对电离辐射有较大的抵抗性,而Weidhaas等[5]的研究也发现细胞分裂间期,尤其是S期对于辐射的抵抗力最大,有丝分裂期对辐射的敏感性最大。
三、不同辐射剂量对线虫的影响1.高剂量辐射诱导细胞增殖阻滞和凋亡:0~50 Gy的剂量对线虫幼虫的孵化和后代数量没有影响,但当剂量超过30 Gy时,后代数量开始减少,200 Gy时,线虫失去繁殖能力;当剂量超过40 Gy时,孵化率开始下降。后代数量和孵化率的ED50分别是79.8 Gy和77.4 Gy[6]。
现有研究表明,秀丽线虫有着独特的生理结构,并且对电离辐射的反应具有一定的特殊性。电离辐射可使线虫生殖细胞有丝分裂区出现一过性的细胞周期阻滞,而减数分裂区发生凋亡,并且其机制与哺乳动物有一定的相似之处[7]。这使得秀丽线虫成为一个研究电离辐射诱导细胞周期阻滞以及凋亡的良好模型。尽管电离辐射造成生殖细胞这两种不同反应的机制已在逐步探索中揭开神秘的面纱,其详细的机制仍需进一步探索,但其机制的保守性以及线虫独特的优势,使得线虫成为一个研究电离辐射防护的模型。
线虫生殖细胞对电离辐射等环境因素敏感,且细胞增殖和细胞凋亡发生在不同区域,便于检测,这使得线虫生殖细胞成为一个较好的研究电离辐射效应的模型。线虫雌雄同体个体有一对U型的生殖腺,该生殖腺在空间上被分隔为有丝分裂区、过渡区(有丝分裂和减数分裂共存)和减数分裂区3个部分。其中,有丝分裂区位于远端,保持有丝分裂的能力,其细胞增殖受到远端体细胞的调控,受环境因素的影响后可发生细胞周期阻滞,抑制生殖细胞的增殖[7]。Gartner等[8]观察到电离辐射导致有丝分裂细胞细胞周期停滞从而抑制增值,辐射12 h内,生殖细胞核的数量未增加(正常情况下稳定增加),细胞增殖出现短暂的停滞,同时,在阻滞期间,处于有丝分裂时期的生殖细胞细胞核和胞质持续增长,体积增大。这一过程受到许多基因的调控,如细胞周期检查点基因hus-1、clk-2等,敲除这些基因,线虫生殖细胞将不再受电离辐射的影响。与哺乳动物不同的是,电离辐射诱导的细胞增殖抑制是暂时性的,由于胚胎发育过程中细胞快速增殖而没有G1和G2期,电离辐射诱导的细胞周期阻滞在胚胎细胞中很少发生[9]。同时,电离辐射可诱导有丝分裂细胞中RAD-51作用于DNA双链断裂修复,随后BRCA1同源蛋白BCR-1通过同源重组修复通路(homologous recombination repair, HR)参与其中[10];而NMD通路的顶端效应因子SMR-1通过非同源性末端连接(non-homologous end joining, NHEJ)参与辐射诱导的有丝分裂细胞的DNA双链断裂修复[11]。Bertolini等[12]发现纺锤体组装检查点的主要组成复合物BUB-3,并不影响射线诱导的细胞周期阻滞,而是作为DNA双链断裂修复因子直接影响细胞分裂后期的细胞周期时间。
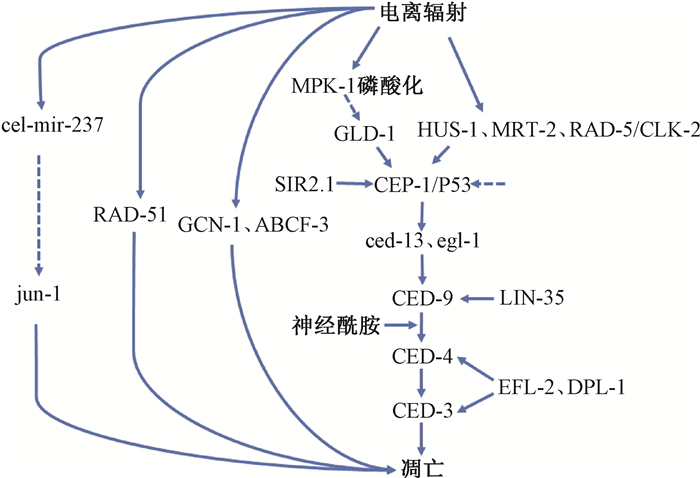
成体线虫的体细胞数目固定,成虫体细胞也不再发生分裂, 但生殖细胞保持终身分裂能力, 为维持生殖细胞的稳态,生殖细胞具有生理性细胞凋亡,正常N2野生型线虫约有一半以上的生殖细胞注定以凋亡的方式除去,在电离辐射等环境因子的影响下,线虫生殖细胞呈现出程序性死亡,而这种凋亡发生在生殖腺的减数分裂区[7]。Weidhaas等[5]发现幼虫经电离辐射后会出现阴部前驱细胞的死亡,从而导致畸形阴部表型,以突出的阴部为主,无阴部较少见,且这种表型出现的比例呈剂量依赖性,除此之外,未见其他明显的异常结构。Gartner等[13]发现电离辐射诱导DNA损伤,从而导致细胞发生凋亡,2~3 h即可观察到凋亡的细胞残体,且凋亡细胞数量呈辐射剂量依赖性增加,这种凋亡细胞形态上与生理性凋亡细胞无显著性差别,在相差显微镜下都表现为高折射性细胞残体,但辐射诱导的凋亡具有细胞特异性,既不发生在雄性个体,也不发生在体细胞,仅发生在雌雄同体线虫的粗线期生殖细胞。同生理性凋亡和体细胞凋亡一样,核心凋亡元件Apaf-1同源蛋白CED-4和Caspase同源蛋白CED-3在电离辐射诱导的凋亡过程中必不可少。不同的是,二者诱导凋亡的启动途径不同,电离辐射会激活DNA损伤检查点蛋白HUS-1、MRT-2和RAD-5/CLK-2,从而激活P53同源蛋白CEP-1,CEP-1上调基因ced-13和egl-1的表达,BH-3同源蛋白EGL-1和CED-13可将CED-4从CED-4/CED-9复合物中分离出来,进而促进CED-4激活CED-3,从而导致凋亡[14]。这个过程受到许多基因的调控:积聚于线粒体膜的神经酰胺有利于CED-4/CED-9复合物CED-4的分离[15];SIR2.1参与触发生殖细胞的凋亡,作用于cep-1调控的基因转录[16];C-Abl同源蛋白ABL-1以及Akt/PKB同源蛋白AKT-1和AKT-2作用于CEP-1的上下游和检查点蛋白,对电离辐射诱导的凋亡具有负调控作用[17];LIN-35通过抑制ced-9的转录诱导凋亡,EFL-2和DPL-1通过诱导ced-4和ced-3转录促进生殖细胞凋亡[18];电离辐射诱导粗线期生殖细胞MPK-1磷酸化,后者通过调控翻译抑制因子GLD-1的水平来调控cep-1的表达水平,从而影响生殖细胞发生DNA损伤造成凋亡[19];53BP1同源物hsr-9并不直接参与DNA双链断裂修复相关的细胞周期阻滞,反而与cep-1在同一通路中促进细胞凋亡[20]。Hirose与Horvitz[21]发现翻译调节因子GCN-1和ABCF-3主要在体细胞凋亡过程中发挥作用,在生殖细胞生理性凋亡过程中的作用微乎其微,但当线虫经受辐射后,二者独立于CED-9和上调egl-1的转录因子,通过一种新的途径参与生殖细胞的凋亡。DNA双联修复蛋白RAD-51参与辐射诱导的生殖细胞凋亡,但其机制独立于其催化的断裂DNA双链与同源DNA姐妹双链的链间转移置换[22]。同时,电离辐射可能激活cel-mir-237基因,后者下调jun-1的表达水平,从而诱导生殖细胞凋亡[23]。详见图 1。
|
注:实线箭头表示促进,虚线箭头表示抑制 图 1 电离辐射诱导的生殖细胞凋亡 Figure 1 Germ cell apoptosis induced by ionizing radiation |
2.低剂量辐射诱导适应性反应和辐射旁效应:辐射诱导适应性反应是指低剂量辐射预处理实验对象后,其可以产生对随后相对高剂量照射诱发损伤的抗性;辐射旁效应是指未受辐射的细胞表现出与受辐射的细胞相同或相似的生物学反应的现象。这两种反应是由低剂量辐射诱导产生的两种矛盾的生物学现象。近年来,秀丽隐杆线虫也开始被用于研究这两种效应。
用碳离子辐射源或者单粒子微束对线虫后食道球和生殖器官阴部进行定点辐射,在其旁区生殖细胞都可发现DNA损伤以及由此导致的细胞凋亡,不同组织对辐射的敏感性不同,阴部辐射导致的损伤更严重,辐射旁效应在系统内部更容易传递,并且生殖系统内部传导引发的损伤更严重,生殖腺的基因组不稳定性更大,更重要的是,这种旁效应可将损伤传递给后代,增加子代基因的不稳定性。但无论是系统内还是系统间的辐射旁效应,DNA损伤响应途径都参与其中,系统内和系统间的辐射旁效应都可以在辐射点上产生活性氧类(ROS),传播至全身,在旁区激活DNA损伤响应途径,后者主要作用于生殖细胞,将不能及时修复损伤或发生突变的细胞经过凋亡途径清除,从而维持基因的稳定性。在系统间的辐射旁效应需要损伤检查点蛋白HUS-1和MRT-2的作用,而系统内的则不需要[24]。同时,神经酰胺合酶功能的缺失能有效抑制辐射旁效应诱导的生殖细胞凋亡,推测神经酰胺生物合成通路也可能参与其中[15, 24],但其具体机制未明。线虫体细胞经受辐射后可通过包括ERK、JNK和p38 MAPK在内的MAPK信号通路引起旁区生殖细胞的DNA损伤,导致未受辐射的生殖细胞发生凋亡,其他平行信号通路比如CEP-1/p53依赖的信号通路也可能参与其中[25]。Peng等[26]发现经受紫外线辐射或电离辐射后,无论是线虫内部还是线虫之间诱导的辐射旁效应,组织蛋白酶B溶酶体蛋白酶同源物CPR-4都是确切无疑的辐射旁效应因子,辐射激活p53同源物cep-1从而增加cpr-4的转录,从而增加CPR-4的合成和分泌,后者通过胰岛素样生长因子受体DAF-2及其下游信号复合物PDK-1激酶,产生辐射旁效应。
与哺乳动物相比,秀丽线虫需要一个更高的辐射剂量诱导适应性反应,γ射线辐射的适应剂量是5 Gy,这个剂量并不影响线虫的生长。低剂量处理后的线虫产生适应性反应是由于低剂量辐射增加了线虫生殖细胞对辐射的抵抗性而不是通过影响细胞周期实现的[27]。线虫阴门细胞经低剂量辐射处理1.75 h后具有辐射抵抗性,且这种抵抗性只维持12~18 h。DNA损伤检查点和NHEJ以细胞非自主性的方式介导线虫的辐射诱导适应性反应。DNA损伤修复通路NHEJ在辐射诱导适应性反应中起重要作用,而HR通路不参与辐射诱导适应性反应,反而参与碳离子辐射诱导的DNA损伤[27-28]。同时,Tang等[29]发现辐射诱导的适应性反应与辐射旁效应存在一定的联系。旁细胞通过辐射旁效应激活DNA损害损伤检查点,从而对随后的高剂量辐射产生辐射诱导适应性反应。
四、电离辐射对线虫行为反应和学习能力的影响秀丽线虫神经系统的解剖结构非常简单,神经元之间的联系关系通过结构重建的方法已经了解得十分清楚。线虫仅有302个神经细胞,但其中却含有与高等动物类似的众多神经递质,能感受各种环境刺激,可通过肌肉协调运动做出各种反应,以完成趋利避害、进食、排便等行为。目前,研究线虫学习行为的方法主要有温度趋向性和化学趋向性,这是线虫的两种主要的联合型学习行为。已有研究表明,电离辐射通过特定的感觉神经元影响神经系统,改变学习行为,加强盐驱化学习。在缺乏异源三聚体G蛋白γ亚基之一GPC-1的gpc-1突变体中,电离辐射对线虫盐驱化学习行为的影响受到抑制[30]。线虫通过ASE感觉神经元感知水溶性化合物cAMP和赖氨酸,通过AWC感觉神经感知挥发性化合物苯甲醛。在线虫的联合学习过程中进行电离辐射,线虫会趋向cAMP而对苯甲醛的趋向性没有发生明显变化,表明电离辐射作用于特定的敏感部位而非整个神经系统,从而影响线虫的盐驱化学习行为[30]。
线虫经过γ射线或碳离子全身辐射后,运动能力(身体运动弯曲频率)呈剂量依赖性下降,这与cat2相关的多巴胺能途径介导的机械感受途径无关,而是由于电离辐射引起损伤并产生的ROS导致的[31-32]。Suzuki等[33]通过比较线虫经过全身和局部电离辐射后运动能力和死亡率,发现电离辐射通过包括运动神经元和体壁肌肉细胞在内的全身机制抑制运动,而不是通过中枢神经系统和应激反应影响运动控制。Sakashita等[32]发现线虫的运动频率和学习行为存在一个间接的而非直接的联系,并且这种联系随着电离辐射剂量的增加逐渐消失。电离辐射对线虫学习行为影响的研究为神经系统信号的研究提供重要的见解,而哺乳动物的研究暂时未涉及到这些。
综上所述,秀丽隐杆线虫因其独特的优势被广泛用于研究电离辐射的特性,生殖细胞因其辐射敏感性和易观察性成为良好的电离辐射模型。已有研究阐明线虫不同发育阶段以及不同细胞对电离辐射的敏感性,这有利于利用线虫进行电离辐射的相关研究,电离辐射诱导线虫生殖细胞在有丝分裂区发生细胞周期阻滞,而在减数分裂期发生细胞凋亡。低剂量辐射诱导的适应性反应和辐射旁效应更是近年来研究的热点,而线虫也可出现这两种特性,但其具体机制有待进一步阐明。
利益冲突 全体作者没有任何利益冲突,未接受任何不当的职务或财务利益作者贡献声明 刘梦宜负责起草及修改论文;陈利娜参与论文讨论与修改;张超负责指导论文写作及论文修改
| [1] |
Brenner S. The genetics of Caenorhabditis elegans[J]. Genetics, 1974, 77(1): 71-94. |
| [2] |
Herman RK, Albertson DG, Brenner S. Chromosome rearrangements in Caenorhabditis elegans[J]. Genetics, 1976, 83(1): 91-105. |
| [3] |
叶侃.辐射对秀丽线虫的生长损伤及其防护研究[D].苏州: 苏州大学, 2011. Ye K. Study on the radiation damages of growth and the protection in Caenorhabditis elegans[D]. Suzhou: Soochow University, 2011. http://cdmd.cnki.com.cn/article/cdmd-10285-1012282685.htm |
| [4] |
Chen L, Tang H, Du Y, et al. Induction of reproductive cell death in Caenorhabditis elegans across entire linear-energy-transfer range of carbon-ion irradiation[J]. DNA Repair (Amst), 2018, 63: 39-46. DOI:10.1016/j.dnarep.2018.01.009 |
| [5] |
Weidhaas JB, Eisenmann DM, Holub JM, et al. A Caenorhabditis elegans tissue model of radiation-induced reproductive cell death[J]. Proc Natl Acad Sci USA, 2006, 103(26): 9946-9951. DOI:10.1073/pnas.0603791103 |
| [6] |
Dubois C, Lecomte C, Ruys S, et al. Precoce and opposite response of proteasome activity after acute or chronic exposure of C. elegans to gamma-radiation[J]. Sci Rep, 2018, 8(1): 11349. DOI:10.1038/s41598-018-29033-1 |
| [7] |
Stergiou L, Hengartner MO. Death and more:DNA damage response pathways in the nematode C. elegans[J]. Cell Death Differ, 2004, 11(1): 21-28. DOI:10.1038/sj.cdd.4401340 |
| [8] |
Gartner A, MacQueen AJ, Villeneuve AM. Methods for analyzing checkpoint responses in Caenorhabditis elegans[J]. Methods Mol Biol, 2004, 280: 257-274. DOI:10.1385/1-59259-788-2:257 |
| [9] |
Jones CA, Hartman PS. Replication in UV-irradiated Caenorhabditis elegans embryos[J]. Photochem Photobiol, 1996, 63(2): 187-192. DOI:10.1111/php.1996.63.issue-2 |
| [10] |
Park S, Choi S, Ahn B. DNA strand breaks in mitotic germ cells of Caenorhabditis elegans evaluated by comet assay[J]. Mol Cells, 2016, 39(3): 204-210. DOI:10.14348/molcells.2016.2206 |
| [11] |
González-Huici V, Wang B, Gartner A. A role for the nonsense-mediated mRNA decay pathway in maintaining genome stability in Caenorhabditis elegans[J]. Genetics, 2017, 206(4): 1853-1864. DOI:10.1534/genetics.117.203414 |
| [12] |
Bertolini S, Wang B, Meier B, et al. Caenorhabditis elegans BUB-3 and SAN-1/MAD3 Spindle assembly checkpoint components are required for genome stability in response to treatment with ionizing radiation[J]. G3(Bethesda), 2017, 7(12): 3875-3885. DOI:10.1534/g3.117.1122 |
| [13] |
Gartner A, Milstein S, Ahmed S, et al. A conserved checkpoint pathway mediates DNA damage-induced apoptosis and cell cycle arrest in C. elegans[J]. Mol Cell, 2000, 5(3): 435-443. DOI:10.1016/S1097-2765(00)80438-4 |
| [14] |
Lant B, Derry WB. Induction of germline apoptosis in Caenorhabditis elegans[J]. Cold Spring Harb Protoc, 2014, 2014(3): 271-277. DOI:10.1101/pdb.prot080192 |
| [15] |
Rolland S, Conradt B. The role of mitochondria in apoptosis induction in Caenorhabditis elegans:more than just innocent bystanders?[J]. Cell Death Differ, 2006, 13(8): 1281-1286. DOI:10.1038/sj.cdd.4401980 |
| [16] |
Greiss S, Hall J, Ahmed S, et al. C. elegans SIR-2.1 translocation is linked to a proapoptotic pathway parallel to cep-1/p53 during DNA damage-induced apoptosis[J]. Genes Dev, 2008, 22(20): 2831-2842. DOI:10.1101/gad.482608 |
| [17] |
Quevedo C, Kaplan DR, Derry WB. AKT-1 regulates DNA-damage-induced germline apoptosis in C. elegans[J]. Curr Biol, 2007, 17(3): 286-292. DOI:10.1016/j.cub.2006.12.038 |
| [18] |
Schertel C, Conradt BC. Elegans orthologs of components of the RB tumor suppressor complex have distinct pro-apoptotic functions[J]. Development, 2007, 134(20): 3691-3701. DOI:10.1242/dev.004606 |
| [19] |
Rutkowski R, Dickinson R, Stewart G, et al. Regulation of Caenorhabditis elegans p53/CEP-1-dependent germ cell apoptosis by Ras/MAPK signaling[J]. PLoS Genet, 2011, 7(8): e1002238. DOI:10.1371/journal.pgen.1002238 |
| [20] |
Ryu JS, Kang SJ, Koo HS. The 53BP1 homolog in C. elegans influences DNA repair and promotes apoptosis in response to ionizing radiation[J]. PLoS One, 2013, 8(5): e64028. DOI:10.1371/journal.pone.0064028 |
| [21] |
Hirose T, Horvitz HR. The translational regulators GCN-1 and ABCF-3 act together to promote apoptosis in C. elegans[J]. PLoS Genet, 2014, 10(8): e1004512. DOI:10.1371/journal.pgen.1004512 |
| [22] |
Germoglio M, Adamo A. A role in apoptosis regulation for rad-51 gene of Caenorhabditis elegans[J]. Genetics, 2018, 209(4): 1017-1028. DOI:10.1534/genetics.118.301152 |
| [23] |
Metheetrairut C, Adams BD, Nallur S, et al. cel-mir-237 and its homologue, hsa-miR-125b, modulate the cellular response to ionizing radiation[J]. Oncogene, 2017, 36(4): 512-524. DOI:10.1038/onc.2016.222 |
| [24] |
黎青青.线虫辐射损伤信号空间转导与机制研究[D].合肥: 中国科学技术大学, 2017. Li QQ. The spatial function and the mechanism of damage signal transduction in Caenorhabditis elegans[D]. Hefei: University of Science and Technology of China, 2017. http://cdmd.cnki.com.cn/Article/CDMD-10358-1017071199.htm |
| [25] |
Guo X, Sun J, Bian P, et al. Radiation-induced bystander signaling from somatic cells to germ cells in Caenorhabditis elegans[J]. Radiat Res, 2013, 180(3): 268-275. DOI:10.1667/RR3218.1 |
| [26] |
Peng Y, Zhang M, Zheng L, et al. Cysteine protease cathepsin B mediates radiation-induced bystander effects[J]. Nature, 2017, 547(7664): 458-462. DOI:10.1038/nature23284 |
| [27] |
Tang H, Chen L, Liu J, et al. Radioadaptive response for reproductive cell death demonstrated in in vivo tissue model of Caenorhabditis elegans[J]. Radiat Res, 2016, 185(4): 402-410. DOI:10.1667/RR14368.1 |
| [28] |
Chen L, Tang H, Du Y, et al. Induction of reproductive cell death in Caenorhabditis elegans across entire linear-energy-transfer range of carbon-ion irradiation[J]. DNA Repair (Amst), 2018, 63: 39-46. DOI:10.1016/j.dnarep.2018.01.009 |
| [29] |
Tang H, Chen L, Chen L, et al. Interaction between radioadaptive response and radiation-induced bystander effect in Caenorhabditis elegans: a unique role of the DNA damage checkpoint[J]. Radiat Res, 2016, 186(6): 662-668. DOI:10.1667/RR14548.1 |
| [30] |
Sakashita T, Hamada N, Ikeda DD, et al. Modulatory effect of ionizing radiation on food-NaCl associative learning:the role of gamma subunit of G protein in Caenorhabditis elegans[J]. FASEB J, 2008, 22(3): 713-720. DOI:10.1096/fj.07-9259com |
| [31] |
Suzuki M, Sakashita T, Yanase S, et al. Effects of ionizing radiation on locomotory behavior and mechanosensation in Caenorhabditis elegans[J]. J Radiat Res, 2009, 50(2): 119-125. DOI:10.1269/jrr.08087 |
| [32] |
Sakashita T, Hamada N, Ikeda DD, et al. Locomotion-learning behavior relationship in Caenorhabditis elegans following gamma-ray irradiation[J]. J Radiat Res, 2008, 49(3): 285-291. DOI:10.1269/jrr.07102 |
| [33] |
Suzuki M, Hattori Y, Sakashita T, et al. Region-specific irradiation system with heavy-ion microbeam for active individuals of Caenorhabditis elegans[J]. J Radiat Res, 2017, 58(6): 881-886. DOI:10.1093/jrr/rrx043 |
 2019, Vol. 39
2019, Vol. 39


