2. 中国科学技术大学, 合肥 230026;
3. 安徽大学物质科学与信息技术研究院, 合肥 230601
2. University of Science and Technology of China, Hefei 230026, China;
3. Institutes of Physical Science and Information Technology, Anhui University, Hefei 230601, China
辐射旁效应指未受辐射细胞表现出与受辐射的细胞相同或者相似的生物学反应,主要包括DNA损伤、细胞增殖、凋亡等[1]。目前,辐射旁效应已逐渐被了解,但其在活体水平中的机制研究尚不明确[2-4]。
神经酰胺是一类构成神经鞘磷脂的脂质化合物,可作为细胞内的第二信使直接或间接地影响下游信号通路,在细胞凋亡等过程中发挥重要作用[5]。神经生长因子(NGF)、肿瘤坏死因子α(TNF-α)和电离辐射等均能诱导神经酰胺的表达并引起生物学效应[6-7]。神经酰胺及其衍生物磷酸鞘氨醇可改变线粒体外膜的渗透性,促进cyto C的释放,激活凋亡效应蛋白[8-11]。辐射可诱导神经酰胺在细胞膜表面形成脂筏结构,通过跨膜传递激活胞内的p38-MAPK通路,引发凋亡[12-13]。脂筏结构参与细胞水平的辐射旁效应,包括胞膜信号转导、诱导姐妹染色单体交换以及磷酸核糖基转移酶突变[14]。
目前对于神经酰胺参与生物过程的研究多集中于细胞水平,且其直接参与辐射旁效应的机制尚不明确。本研究以秀丽隐杆线虫为研究对象,探究神经酰胺在活体水平辐射旁效应中的作用。
材料与方法1.线虫培养及品系:实验所需线虫均以大肠杆菌尿嘧啶缺陷型菌株OP50为食物,恒温20℃避光培养在线虫生长培养基(nematode growth medium, NGM)上。线虫品系均来源于美国NIH资助的线虫种质中心(Caenorhabditis Genetics Center,CGC)。实验中涉及到的线虫品系:野生型N2 Bristol。神经酰胺合酶突变品系:VC747: lagr-1(gk327)I。RB1036: hyl-1(ok976)Ⅳ。XR3: lagr-1(gk327)I; hyl-1(ok976)Ⅳ。鞘氨醇激酶突变品系:VC916: sphk-1(ok1097)Ⅱ。非受体络氨酸激酶突变品系XR1:abl-1(ok171)X。神经酰胺合酶与非受体络氨酸激酶三突变品系:XR4: lagr-1(gk327)I; hyl-1(ok976)Ⅳ; abl-1(ok171)X。DNA损伤检验点突变品系:WS2277: hus-1(op241)I。
2.试剂
NGM的配制方法:1.7 g琼脂粉、2.5 g蛋白胨、3 g氯化钠溶于975 ml超纯水中,121℃高温灭菌后,分别加入1 ml经过灭菌的1 M氯化钙、1 M硫酸镁、5 mg/ml胆固醇(乙醇为溶剂)以及25 ml浓度为1 M的磷酸钾缓冲液(35.6 g磷酸氢二钾和108.3 g磷酸二氢钾溶于1 L超纯水中高温灭菌后使用,现配现用),上述溶液混匀后在无菌环境下倒入无菌培养板中,静置使其凝固。
M9缓冲液的配制方法:3.0 g磷酸二氢钾、6.0 g十二水合磷酸氢二钠、5.0 g氯化钠溶于1 L超纯水中121 ℃高压灭菌,灭菌后加入1 ml无菌的1 M硫酸镁,混匀分装。碱性次氯酸盐溶液:次氯酸钠及5 M氢氧化钠溶液。
琼脂粉、蛋白胨、胆固醇购买自上海生工生物工程股份有限公司,氯化钠、硫酸镁、氯化钙、磷酸氢二钾、磷酸二氢钾、十二水合磷酸氢二钠、次氯酸钠、氢氧化钠、乙醚、乙醇、氯仿、异丙醇均购买自上海国药集团化学试剂有限公司。TRIzol试剂购买自美国的Thermo Fisher公司。
3.神经酰胺基因的选择:重新合成途径中,神经酰胺合成酶CerS和神经鞘氨醇激酶SphK分别调控神经酰胺的合成与分解,代谢过程参考文献[11]。为了探究神经酰胺代谢途径在辐射旁效应中的作用,本研究以神经酰胺合成酶CerS编码基因hyl-1和lagr-1以及神经鞘氨醇激酶SphK编码基因sphk-1为研究目标(表 1),对线虫进行后食道球定点辐照。
|
|
表 1 文中神经酰胺代谢相关基因信息表 Table 1 Information of ceramide metabolism genes in this study |
4.线虫同步化处理:将处于产卵阶段的成虫用M9缓冲液冲洗至1.5 ml离心管中,待成虫沉降并反复冲洗3次后,用碱性次氯酸盐溶液裂解虫体后,离心半径6.6 cm,6 000 r/min离心1 min,去上清,反复冲洗3次后,将所得受精卵均匀分散至3 ml M9缓冲液中,20℃避光培养24 h即可得到停滞于L1期的幼虫。将上述所得幼虫接种到OP50的NGM板上,即可得到同步化生长的线虫。
5.单粒子微束定点定量辐照线虫:每个品系线虫分为照射组和对照组。本实验室自主研发的单粒子束装置(CAS-LIBB)中的离子经过加速器加速以及各功能模块的运输到达微束室后,经瞄准器系统形成单粒子束,用于定点辐射。照射组线虫经麻醉剂(乙醚:无水乙醇=1 :1)麻醉后的L4期线虫,经成像系统识别和标记线虫的后食道球,通过CAS-LIBB对后食道球进行定点照射,束斑直径5~10 μm,定位精度 < 0.2 μm。经前期研究,辐照剂量为2 000个质子时辐射旁效应最强[15],因此,本研究辐射剂量均为2 000个质子。对照组不予照射。
6.线虫生殖腺凋亡细胞的检测:线虫生殖腺凋亡细胞的测定参考文献[16]。单粒子束辐照后24 h,从NGM板上收集线虫,加入75 μmol/L的吖啶橙溶液(上海生工生物工程股份有限公司)制成200 μl的虫悬液,20℃避光染色1 h。染色结束后,将线虫转移至新的含有OP50的NGM板上恢复1 h,使肠道内及表皮上的吖啶橙排泄干净。通过Olympus IX 71荧光显微镜(日本奥林巴斯株式会社)(激发:488 nm,发射:515 nm)观察凋亡细胞,凋亡细胞呈致密浓染的亮黄色。
7.实时定量PCR分析:定点辐照6 h后的线虫用液氮迅速冷冻并研磨至虫体破碎后,加入500 μl TRIzol,室温放置10 min,随后加入200 μl氯仿,震荡混匀后,4℃离心半径6.6 cm,12 000 r/min离心15 min。取上清并加入125 μl异丙醇,震荡混匀后于-20℃中放置10 min,4℃条件下离心半径6.6 cm,12 000 r/min离心10 min,得RNA沉淀,500 μl 70%乙醇洗2次,沉淀风干后加入10 μl的不含RNase的水,60℃水浴中加热10 min,促进RNA溶解,最后用核酸定量仪Q5000(美国的Quawell公司)标定浓度。
采用TransScript One-Step gDNA Removal and cDNA Synthesis SuperMix试剂盒(法国Transgene公司),将提取的总RNA反转录为cDNA;采用表 2的引物对相应的基因进行荧光定量分析,条件为94℃ 5 min进行变性;94℃ 30 s,60℃ 45 s,72℃ 30 s 40个循环进行延伸;72℃ 10 min进行复性。所采用的荧光定量PCR仪为ABI7500(美国ABI公司)。act-1为内参基因。
|
|
表 2 实时定量PCR引物序列 Table 2 Real-time PCR primers of target genes |
8.统计学处理:数据符合正态分布,用x±s表示,采用Origin Pro 8 SR1软件进行分析。组间比较采用双边t检验。辐射后同一基因在不同品系间的表达量经方差齐性检验,采用双因素方差分析(Two-way ANOVA)进行比较。P < 0.05为差异有统计学意义。
结果1.神经酰胺重新合成途径参与辐射诱导的旁区生殖腺细胞凋亡:结果见图 1。定点辐照后食道球后,N2中旁区生殖腺的凋亡细胞数目从3.38±0.12显著增加至4.73±0.32;神经酰胺合成酶基因(hyl-1;lagr-1)单突变品系和双突变体lagr-1(gk327);hyl-1(ok976)中均未表现出辐射诱导的旁区生殖腺细胞凋亡增加的现象。而神经酰胺激酶基因sphk-1功能缺失后辐射诱导的旁区生殖腺细胞凋亡仍显著增加,从3.66±0.33升至4.94±0.06。随后,对N2进行基因表达分析,结果显示N2体内lagr-1和hyl-1表达量都上调,分别上升了(3.71±0.21)和(3.47±0.10)倍。这表明神经酰胺重新合成途径参与线虫体内辐射引起的旁区凋亡过程,而其代谢途径未参与该过程。
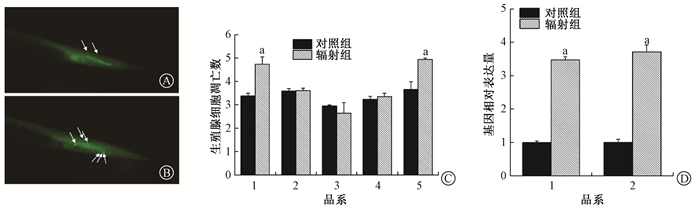
|
注:箭头所指为生殖腺中的凋亡细胞。图C:1. N2;2. VC747;3. RB1036;4. XR3;5. VC916。图D:1. hyl-1;2. lagr-1。a与该品系对照组比较,t=9.007、11.538、32.640、15.605,P < 0.05 图 1 神经酰胺代谢途径基因功能缺失后对生殖腺细胞凋亡的影响 A. N2中辐射前生殖细胞凋亡图 吖啶橙染色×200;B. N2中2 000个质子辐射后的生殖细胞凋亡图 吖啶橙染色×200;C.辐射前后N2及神经酰胺代谢途径基因功能缺失后生殖细胞凋亡;D.辐照后N2中神经酰胺合酶基因表达量变化 Figure 1 The role of deletion of genes relative to ceramide metabolic pathway in germ cell apoptosis in C. elegans A. Representative images of germ cell corpses of wide type N2 before radiation Acridine orange staining ×200; B. Representative images of germ cell corpses of wide type N2 upon radiation with 2 000 particles Acridine orange staining ×200; C. Germ cell apoptosis in N2 and deletion mutants of ceramide metabolic pathway before and after radiation; D. Expressions of ceramide synthase genes in N2 worms upon radiation |
2.神经酰胺代谢合酶基因功能缺失后对egl-1/ced-13基因表达量的影响:在定点辐射后食道球后6 h,各品系线虫体内egl-1和ced-13基因的mRNA水平变化如图 2所示,在N2和lagr-1(gk327);hyl-1(ok976)中,egl-1的基因表达分别上升到(3.77±0.56)和(3.9±0.8)倍,ced-13的表达量也分别上升到(2.27±0.38)和(2.10±0.36)倍。结果表明, 神经酰胺合酶不影响egl-1和ced-13基因的表达,神经酰胺和凋亡核心通路中的CEP-1可能平行地对辐射诱导的生殖细胞凋亡协同起作用。
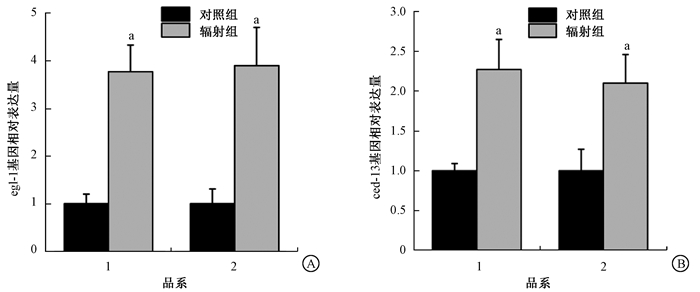
|
注:1. N2;2. XR3。a与该品系对照组比较,t=6.303、5.238、5.134、20.617,P < 0.05 图 2 神经酰胺代谢合酶基因缺失后对egl-1/ced-13基因表达量的影响 A.辐射后N2和lagr-1(gk327);hyl-1(ok976)中egl-1基因表达量变化;B.辐射后N2和lagr-1(gk327);hyl-1(ok976)中ced-13基因表达量变化 Figure 2 Deletion of genes relative to ceramide metabolic pathway does not affect gene expression of egl-1 and ced-13 A. Expressions of egl-1 in N2 and lagr-1(gk327); hyl-1(ok976)upon radiation; B. Expressions of ced-13 in N2 and lagr-1(gk327);hyl-1(ok976)upon radiation |
3.神经酰胺重新合成途径和DNA损伤响应途径在线虫辐射旁区效应中的关系:结果如图 3所示,在N2和hus-1(op241)线虫中,神经酰胺合成酶相关基因hyl-1和lagr-1的表达在辐射后均上调,分别上升到(3.09±0.52)和(3.54±1.03)倍,且在N2与HUS-1突变体中差异无统计学意义(P>0.05)。结果表明,神经酰胺重新合成途径和DNA损伤响应途径在辐射诱导的生殖细胞凋亡中可能起协同作用。
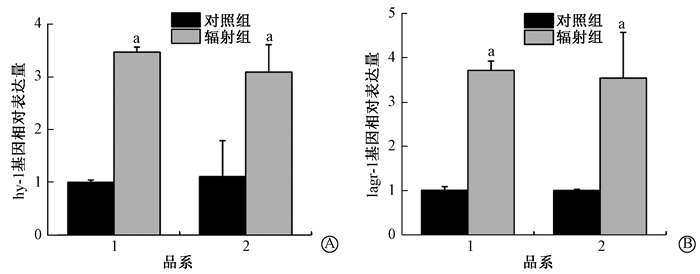
|
注:1. N2;2. WS2277。a与该品系对照组比较,t=32.640、30.237、15.605、4.371,P < 0.05 图 3 DNA损伤检验点基因hus-1缺失后对神经酰胺代谢合酶基因hyl-1/lagr-1表达量的影响 A.辐射后N2和hus-1 (op241)中hyl-1基因表达量变化;B.辐射后N2和hus-1 Figure 3 Deletion of genes relative to DNA damage checkpoint hus-1 does not affect gene expression of hyl-1 and lagr-1 A. Expressions of hyl-1 in N2 and hus-1 (op241) upon radiation; B. Expressions of lagr-1 in N2 and hus-1 (op241) upon radiation |
4.神经酰胺重新合成途径和抑凋亡基因abl-1在线虫辐射旁区效应中的关系:abl-1基因突变的线虫其生殖腺细胞凋亡水平从3.84±0.56上升至5.78±0.32,而lagr-1(gk327)、hyl-1(ok976)、abl-1(ok171)三基因突变体中,凋亡水平又回落至4.27±0.27(图 4)。这说明神经酰胺合成途径参与线虫体内不同器官间的辐射旁效应且与抑凋亡基因abl-1相互拮抗。
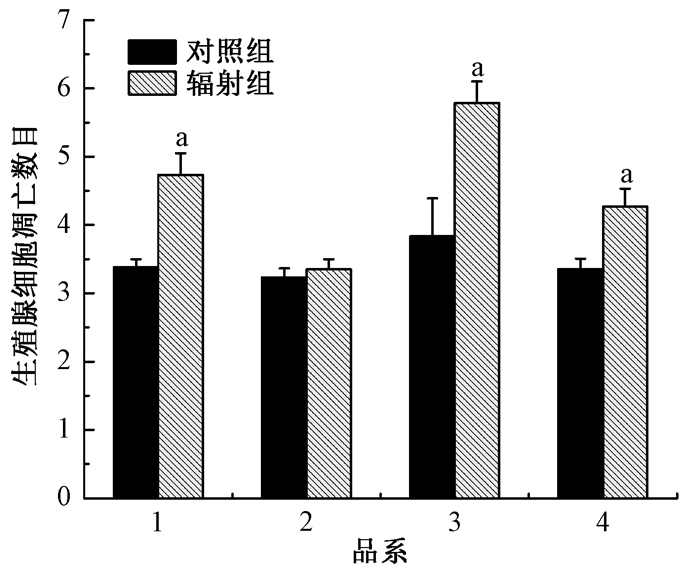
|
注:1. N2;2. XR3;3. XR1;4. XR4。a与该品系对照组进行比较,t=9.007、13.241、13.462,P < 0.05 图 4 神经酰胺代谢途径与abl-1在生殖腺细胞凋亡中的关系 Figure 4 Relationship of ceramide and abl-1(ok171) in the germ cell apoptosis of irradiated worms |
讨论
细胞内神经酰胺的水平通过神经酰胺的合成与分解来调控。重新合成途径中的神经酰胺合成酶CerS可将神经鞘氨醇经酰化作用转化成二氢硫辛酰胺,后者随后由去饱和酶转化为神经酰胺[17]。神经酰胺经神经酰胺酶去脂肪酸转化为鞘氨醇,随后鞘氨醇由鞘氨醇激酶SphK介导神经鞘氨醇转化为磷酸鞘氨醇,SphK是神经酰胺水平调节过程中重要的检验点[7]。CerS由3个基因编码:hyl-1、hyl-2、lagr-1。本研究以重新合成途径中的神经酰胺合酶CerS(对应基因hyl-1和lagr-1)以及神经酰胺清除途径中的鞘氨醇激酶SphK(对应基因sphk-1)作为研究对象,研究神经酰胺代谢过程对辐射旁效应的影响。利用基因突变体进行的生殖腺细胞凋亡和实时定量PCR结果表明定点辐射可诱导旁区生殖腺细胞凋亡增加,神经酰胺的重新合成途径参与定点辐射诱导的线虫旁区生殖腺细胞的凋亡过程,而神经酰胺分解途径不参与该过程。多种外界压力,包括热激、UV及过氧化氢,都会导致细胞内中性鞘磷脂酶nSMase1的磷酸化,诱导神经酰胺在细胞内的累积,从而诱导细胞凋亡[18]。γ射线处理线虫后,其生殖腺细胞凋亡增加,线虫生殖腺内神经酰胺的含量也升高,而神经酰胺合酶突变品系的线虫中,其生殖腺内神经酰胺含量的升高受到抑制[19]。表明神经酰胺作为一种介质直接参与细胞凋亡过程。
辐射可以诱导DNA双链断裂(DNA double-strand breaks,DSBs),DSB进而会激活DNA损伤检验点,并激活DNA损伤响应通路[20-21]。在定点辐射后,DDR通路在线虫的旁区生殖腺细胞凋亡过程中发挥作用[4, 15]。DSB损伤由MRN(Mre11-Rad50-Nbs1)复合物进行识别,DSB与MRN复合物短暂接触后招募ATM激酶,神经酰胺可调控MRN复合物-ATM依赖的凋亡过程[22]。碱性神经酰胺酶ACER2催化神经酰胺水解为神经鞘磷脂及1-磷酸-鞘磷脂导致神经酰胺水平的下降,DNA损伤诱导细胞内氧自由基的产生,上调ACER2的表达并提高细胞内神经鞘磷脂的水平,进而引发凋亡[23]。本研究以DNA损伤检验点HUS-1为研究对象探究神经酰胺重新合成途径和DNA损伤响应途径在辐射旁区效应中的关系。结果表明,虽然神经酰胺重新合成途径和DNA损伤响应途径都参与线虫的辐射旁区效应,但两通路可能独立发挥作用,对辐射诱导的生殖细胞凋亡协同起作用。
DNA损伤可激活线虫体内p53的同源蛋白cep-1,该蛋白在转录水平上正调控egl-1和ced-13,从而激活凋亡核心通路的下游功能蛋白ced-9、ced-4和ced-3蛋白,启动凋亡[24]。研究显示,神经酰胺在p53依赖的细胞凋亡中发挥重要作用。辐射可诱导神经酰胺在细胞内的积累并激活p53依赖的凋亡[25]。C16-神经酰胺可直接结合于p53的DNA结合结构域并激活p53蛋白[26]。低剂量辐射时,p53可调控ACER2的表达上升,促进细胞增殖;在高剂量辐射时,p53/ACER2途径介导细胞凋亡[27]。实时定量PCR结果表明,神经酰胺合酶突变并不影响egl-1和ced-13基因的表达,神经酰胺重新合成途径和凋亡核心通路中的cep-1可能平行地对辐射诱导的生殖细胞凋亡协同起作用,也可能是p53于神经酰胺上游发挥作用。
非受体络氨酸激酶abl-1有拮抗凋亡的作用,其突变后可导致线虫生殖腺凋亡的本底水平上升并表现出高辐射敏感性[28]。经γ射线辐照后,神经酰胺在abl-1上游发挥作用,从而促进线虫生殖腺细胞凋亡[19]。结果表明, 辐射线虫的后食道球后,abl-1突变导致的旁区凋亡上升会因为神经酰胺合成的缺陷而受到部分抑制,神经酰胺合成途径与abl-1在辐射引起的旁区凋亡过程中互为拮抗关系。
本研究对神经酰胺在活体水平辐射旁效应中的作用进行了初步的探讨,其在活体水平辐射旁效应中信号产生、传导和级联放大中的作用仍需进一步的深入研究。对衰老小鼠的研究中发现,神经酰胺可从卵丘细胞转移至邻近的卵子中诱导生殖细胞凋亡,这种转移需要细胞间隙连接以及完整的脂筏结构[29]。前期研究显示,单束辐照可诱导线虫体内氧自由基含量的上升[4]。外源ROS可诱导神经酰胺的产生并引发细胞凋亡[30]。对线虫的生殖腺注射C16-神经酰胺标准品后,引起了线虫凋亡的生殖细胞数量的增加,且有一定的剂量效应[19]。基于上述研究,推测在辐射诱导的生殖细胞旁效应中,单粒子束照射后食道球产生ROS,ROS作用于生殖腺细胞诱导细胞中神经酰胺的合成,并最终导致生殖腺细胞凋亡的发生。
利益冲突 无作者贡献声明 许光敏负责实验和数据分析,撰写论文;杨亚宁指导实验操作和统计分析;徐升敏指导论文修改;吴李君负责实验设计
| [1] |
Zhou H, Ivanov VN, Gillespie J, et al. Mechanism of radiation-induced bystander effect:role of the cyclooxygenase-2 signaling pathway[J]. Proc Natl Acad Sci USA, 2005, 102(41): 14641-14646. DOI:10.1073/pnas.0505473102 |
| [2] |
Desai S, Kobayashi A, Konishi T, et al. Damaging and protective bystander cross-talk between human lung cancer and normal cells after proton microbeam irradiation[J]. Mutat Res, 2014, 763-764: 39-44. DOI:10.1016/j.mrfmmm.2014.03.004 |
| [3] |
Peng Y, Zhang M, Zheng L, et al. Cysteine protease cathepsin B mediates radiation-induced bystander effects[J]. Nature, 2017, 547(7664): 458-462. DOI:10.1038/nature23284 |
| [4] |
Li QQ, Shi J, Chen LY, et al. Spatial function of the oxidative DNA damage response in radiation induced bystander effects in intra- and inter-system of Caenorhabditis elegans[J]. Oncotarget, 2017, 8(31): 51253-51263. DOI:10.18632/oncotarget.17229 |
| [5] |
Hannun YA, Luberto C, Argraves KM. Enzymes of sphingolipid metabolism:from modular to integrative signaling[J]. Biochemistry, 2001, 40(16): 4893-4903. DOI:10.1021/bi002836k |
| [6] |
Ruvolo PP. Intracellular signal transduction pathways activated by ceramide and its metabolites[J]. Pharmacol Res, 2003, 47(5): 383-392. DOI:10.1016/S1043-6618(03)00050-1 |
| [7] |
Aureli M, Murdica V, Loberto N, et al. Exploring the link between ceramide and ionizing radiation[J]. Glycoconj J, 2014, 31(6-7): 449-459. DOI:10.1007/s10719-014-9541-y |
| [8] |
Kumar A, Oskouian B, Fyrst H, et al. S1P lyase regulates DNA damage responses through a novel sphingolipid feedback mechanism[J]. Cell Death Dis, 2011, 2: e119. DOI:10.1038/cddis.2011.3 |
| [9] |
Lee H, Rotolo JA, Mesicek J, et al. Mitochondrial ceramide-rich macrodomains functionalize Bax upon irradiation[J]. PLoS One, 2011, 6(6): e19783. DOI:10.1371/journal.pone.0019783 |
| [10] |
Chipuk JE, McStay GP, Bharti A, et al. Sphingolipid metabolism cooperates with BAK and BAX to promote the mitochondrial pathway of apoptosis[J]. Cell, 2012, 148(5): 988-1000. DOI:10.1016/j.cell.2012.01.038 |
| [11] |
Kogot-Levin A, Saada A. Ceramide and the mitochondrial respiratory chain[J]. Biochimie, 2014, 100: 88-94. DOI:10.1016/j.biochi.2013.07.027 |
| [12] |
Niaudet C, Bonnaud S, Guillonneau M, et al. Plasma membrane reorganization links acid sphingomyelinase/ceramide to p38 MAPK pathways in endothelial cells apoptosis[J]. Cell Signal, 2017, 33: 10-21. DOI:10.1016/j.cellsig.2017.02.001 |
| [13] |
Gulbins E, Kolesnick R. Raft ceramide in molecular medicine[J]. Oncogene, 2003, 22(45): 7070-7077. DOI:10.1038/sj.onc.1207146 |
| [14] |
Nagasawa H, Cremesti A, Kolesnick R, et al. Involvement of membrane signaling in the bystander effect in irradiated cells[J]. Cancer Res, 2002, 62(9): 2531-2534. |
| [15] |
Guo X, Sun J, Bian P, et al. Radiation-induced bystander signaling from somatic cells to germ cells in Caenorhabditis elegans[J]. Radiat Res, 2013, 180(3): 268-275. DOI:10.1667/RR3218.1 |
| [16] |
Lant B, Derry WB. Fluorescent visualization of germline apoptosis in living Caenorhabditis elegans[J]. Cold Spring Harb Protoc, 2014, 2014(4): 420-427. DOI:10.1101/pdb.prot080226 |
| [17] |
Gault CR, Obeid LM, Hannun YA. An overview of sphingolipid metabolism:from synthesis to breakdown[J]. Adv Exp Med Biol, 2010, 688: 1-23. DOI:10.1007/978-1-4419-6741-1 |
| [18] |
Yabu T, Shiba H, Shibasaki Y, et al. Stress-induced ceramide generation and apoptosis via the phosphorylation and activation of nSMase1 by JNK signaling[J]. Cell Death Differ, 2015, 22(2): 258-273. DOI:10.1038/cdd.2014.128 |
| [19] |
Deng X, Yin X, Allan R, et al. Ceramide biogenesis is required for radiation-induced apoptosis in the germ line of C. elegans[J]. Science, 2008, 322(5898): 110-115. DOI:10.1126/science.1158111 |
| [20] |
Lomax ME, Folkes LK, O'Neill P. Biological consequences of radiation-induced DNA damage:relevance to radiotherapy[J]. Clin Oncol (R Coll Radiol), 2013, 25(10): 578-585. DOI:10.1016/j.clon.2013.06.007 |
| [21] |
Torgovnick A, Schumacher B. DNA repair mechanisms in cancer development and therapy[J]. Front Genet, 2015, 6: 157. DOI:10.3389/fgene.2015.00157 |
| [22] |
Carroll B, Donaldson JC, Obeid L. Sphingolipids in the DNA damage response[J]. Adv Biol Regul, 2015, 58: 38-52. DOI:10.1016/j.jbior.2014.11.001 |
| [23] |
Xu R, Wang K, Mileva I, et al. Alkaline ceramidase 2 and its bioactive product sphingosine are novel regulators of the DNA damage response[J]. Oncotarget, 2016, 7(14): 18440-18457. DOI:10.18632/oncotarget.7825 |
| [24] |
Hofmann ER, Milstein S, Boulton SJ, et al. Caenorhabditis elegans HUS-1 is a DNA damage checkpoint protein required for genome stability and EGL-1-mediated apoptosis[J]. Curr Biol, 2002, 12(22): 1908-1918. DOI:10.1016/S0960-9822(02)01262-9 |
| [25] |
Hage-Sleiman R, Bahmad H, Kobeissy H, et al. Genomic alterations during p53-dependent apoptosis induced by γ-irradiation of Molt-4 leukemia cells[J]. PLoS One, 2017, 12(12): e0190221. DOI:10.1371/journal.pone.0190221 |
| [26] |
Fekry B, Jeffries KA, Esmaeilniakooshkghazi A, et al. C16-ceramide is a natural regulatory ligand of p53 in cellular stress response[J]. Nat Commun, 2018, 9(1): 4149. DOI:10.1038/s41467-018-06650-y |
| [27] |
Xu R, Garcia-Barros M, Wen S, et al. Tumor suppressor p53 links ceramide metabolism to DNA damage response through alkaline ceramidase 2[J]. Cell Death Differ, 2018, 25(5): 841-856. DOI:10.1038/s41418-017-0018-y |
| [28] |
Deng X, Hofmann ER, Villanueva A, et al. Caenorhabditis elegans ABL-1 antagonizes p53-mediated germline apoptosis after ionizing irradiation[J]. Nat Genet, 2004, 36(8): 906-912. DOI:10.1038/ng1396 |
| [29] |
Perez GI, Jurisicova A, Matikainen T, et al. A central role for ceramide in the age-related acceleration of apoptosis in the female germline[J]. FASEB J, 2005, 19(7): 860-862. DOI:10.1096/fj.04-2903fje |
| [30] |
Rahman A, Thayyullathil F, Pallichankandy S, et al. Hydrogen peroxide/ceramide/Akt signaling axis play a critical role in the antileukemic potential of sanguinarine[J]. Free Radic Biol Med, 2016, 96: 273-289. DOI:10.1016/j.freeradbiomed.2016.05.001 |
 2019, Vol. 39
2019, Vol. 39


