海马组织血脑屏障(blood brain barrier, BBB)是一种多细胞的血管结构,它通过严格控制分子和离子的通道,根据脑内神经元的需要,及时输送营养和氧气,保护大脑免受毒素和病原体的伤害[1],使得血液和脑实质之间的细胞和分子交换更严格[2-3]。
低频脉冲磁场作为电磁辐射的组成之一,在临床中用于缓解疼痛、抑制肿瘤、治疗骨质疏松[4-5],治疗应用的剂量远远超出了安全限值。BBB功能容易受到多种生物、理化因素的影响[6]。在各种理化因素对中枢神经系统的生物学效应的研究中,微波、超声、激光、电穿孔、MRI静磁场等能引起BBB完整性的改变[7-11]。然而,目前关于低频脉冲磁场对生物安全效应的研究较少,BBB作为重要的脑部结构,低频脉冲磁场对于BBB的通透性影响研究尚少见报道。根据临床上检查和治疗所用的磁场强度,本研究以白蛋白和EB为血管示踪剂,初次探索了脉冲磁辐射对BBB通透性的影响,旨在发现中高磁场强度低频脉冲磁场的生物学效应,为脉冲磁场的安全性评价提供理论依据。
材料与方法1.实验动物与分组:SPF级健康成年雄性SD大鼠72只,体重200~250 g,购自空军军医大学实验动物中心,许可证号:XK(陕2014-002)。动物在25℃的无病原菌清洁级环境适应1周后开始实验。完全随机分组法分为假暴露对照组、阳性对照组和磁辐射组(磁场强度分别为100、400、800、1 200 mT,磁辐射组脉冲次数30个,脉冲间隔1 min),每组12只动物。此外,阳性对照组大鼠静脉注射0.1 mg/ml肾上腺素,100 μg/kg。假暴露对照组放在暴露仓内,但不加脉冲磁场,时间长短同磁辐射组。设置阳性对照组目的是为了验证实验方法的有效性。阳性对照组注射肾上腺素可以通过血压一过性升高引起BBB开放[12]。动物实验经过空军军医大学动物中心福利与伦理委员会审查。
2.试剂:组织裂解液购于美国Solarbio公司,蛋白上样缓冲液、二喹啉甲酸(BCA)试剂盒购于武汉博士德生物公司,绵羊抗大鼠白蛋白购于美国BETHYL Laboratories公司,驴抗绵羊抗体购于美国Abbkine公司,二氨基联苯胺(DAB)显色试剂盒购于北京中杉金桥生物公司,伊文斯蓝粉末购于美国MP公司,ZO-1兔多克隆抗体购于美国Novusbio公司,Occludin兔多克隆抗体、山羊抗兔抗体购于英国Abcam公司,GAPDH小鼠单克隆抗体购于美国Proteintech公司,山羊抗小鼠抗体购于美国Cell Signal Technology公司,化学发光液购于美国Millipore公司。
3.实验设备:脉冲磁辐射发生器是由中国西北核技术研究所(西安)研发,磁场强度为数mT至1 600 mT的脉冲磁场,1 T对应的线圈电流为100 kA,频率为50 Hz,脉冲宽度为5 ms。脉冲磁场发生器分为控制器、暴露仓、屏蔽室、高压磁场发生器4个部分,动物在暴露仓接受辐射。
4.大鼠海马组织HE染色:大鼠磁辐照后3 h,7%水合氯醛腹腔麻醉,4%多聚甲醛灌注,固定24 h。取出的海马组织用常规方法进行梯度脱水、透明、浸蜡和包埋,用石蜡切片机切取厚4 μm组织。组织常规脱蜡、水化后进行HE染色,中性树胶封片,显微镜观察[12]。
5.免疫组织化学(immunohistochemistry,IHC)检测大鼠大脑组织微血管周围白蛋白渗出情况及半定量分析:切好的石蜡脑组织切片常规脱蜡、水化、修复抗原、封闭后加入绵羊抗大鼠白蛋白一抗(1 :200),4℃过夜,驴抗绵羊二抗(1 :500)孵育2 h,DAB显色,苏木精复染,封片后显微镜观察。阳性结果判断标准:白蛋白位于脑微血管周围,血管周围出现棕黄色渗出判定为阳性。采用半定量分析,未出现白蛋白漏出血管的切片为阴性计为0分,出现1个白蛋白漏出微血管的切片计为1分,出现2个白蛋白漏出微血管的切片计为2分,以此类推。每只动物选择5张切片,将每只动物的5张切片得分之和计为每只动物的得分。
6. EB荧光法检测大鼠海马组织外源性示踪剂的渗出情况及半定量分析:大鼠辐射后3 h,7%水合氯醛腹腔麻醉,在尾静脉注射伊文斯兰溶液(2%,4 ml/kg),循环30 min后,200 ml生理盐水快速灌注,200 ml 4%多聚甲醛快速固定。取出脑组织用最佳切割温度(OCT)包埋剂包埋,冰冻切片机切30 μm脑组织,贴片后荧光显微镜观察。结果判断:荧光显微镜下观察,EB荧光点数(未发现EB荧光记为0,荧光点≤1记为1,荧光点≤2记为2,荧光点≤3记为3,荧光点>3记为4);EB荧光强度(未发现EB荧光记为0,弱荧光强度记为1,中等强度记为2,强强度记为3);EB荧光面积(未发现EB荧光记为0,荧光面积小者记为1,中等面积记为2,荧光面积较大者记为3);每张切片的总得分=EB荧光点数+ EB荧光强度+ EB荧光面积;每只动物4张切片得分的平均值为每只动物得分。
7. Western blot检测大鼠海马组织BBB相关蛋白Occludin和ZO-1:大鼠辐射后3 h,颈椎脱臼处死,取出脑组织。按照RIPA蛋白裂解液说明提取脑组织总蛋白,BCA法测定蛋白浓度。每孔蛋白上样量20 μg,行十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳,湿转法将凝胶中的蛋白转移至聚偏二氟乙烯(PVDF)膜上,5%脱脂奶粉封闭,兔抗Occlucin抗体(1 :1 000稀释),兔抗ZO-1抗体(1 :1 000稀释),小鼠抗GAPDH抗体(1 :1 000稀释) 4℃与PVDF膜杂交过夜,3遍洗膜后辣根过氧化物酶(HRP)标记抗兔IgG (1 :5 000稀释)、HRP标记抗小鼠IgG (1 :5 000稀释)室温结合2 h,洗膜后化学发光法发光。发光结果行灰度扫描,Image J软件分析,以GAPDH为内参,分析Occludin和ZO-1的蛋白表达水平。
8.统计学处理:采用SPSS 17.0软件进行分析。数据符合正态分布,用x±s表示。用GraphPad Prism 7.00软件作图。两组间均数比较经正态性检验采用两独立样本t检验。P<0.05为差异有统计学意义。
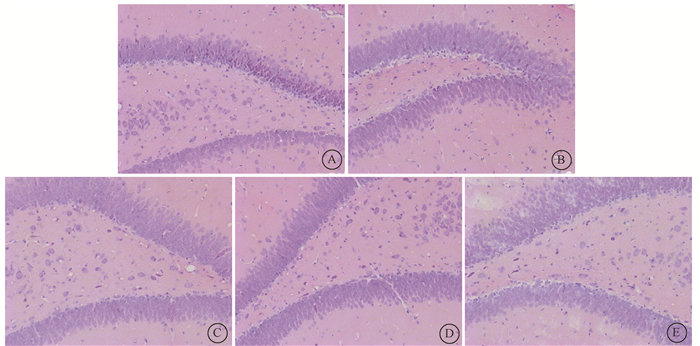
结果1.大鼠海马组织形态变化:HE染色结果显示,磁辐射组和假暴露对照组海马区神经元细胞形态规则,细胞体饱满,锥体细胞排列整齐有序,细胞核形态规则,染色均匀,核仁明显。均未出现神经元丢失,胞体空染,排列紊乱的情况(图 1)。
|
图 1 不同强度磁场暴露后大鼠海马组织结构 HE染色×200 A.假暴露对照组;B. 100 mT磁辐射组;C. 400 mT磁辐射组;D. 800 mT磁辐射组;E. 1 200 mT磁辐射组 Figure 1 The structure of rat hippocampus in different groups HE staining ×200 A. Sham group; B. 100 mT group; C. 400 mT group; D. 800 mT group; E. 1 200 mT group |
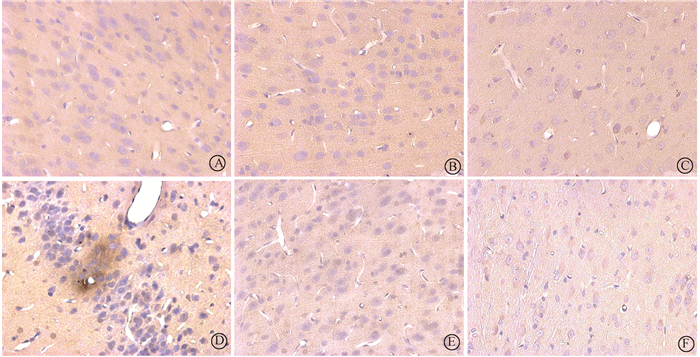
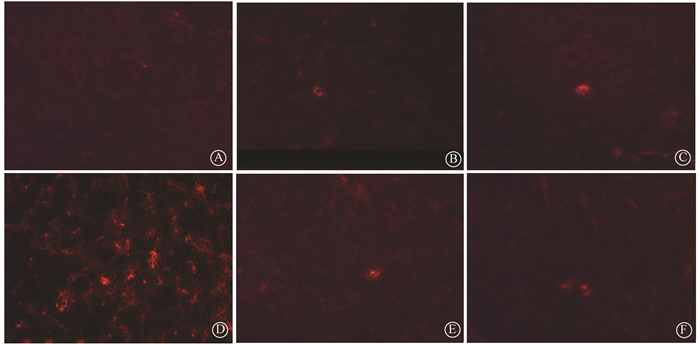
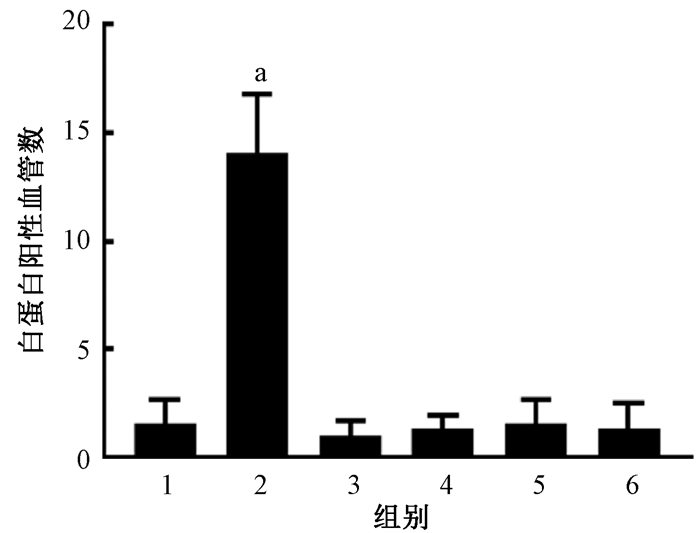
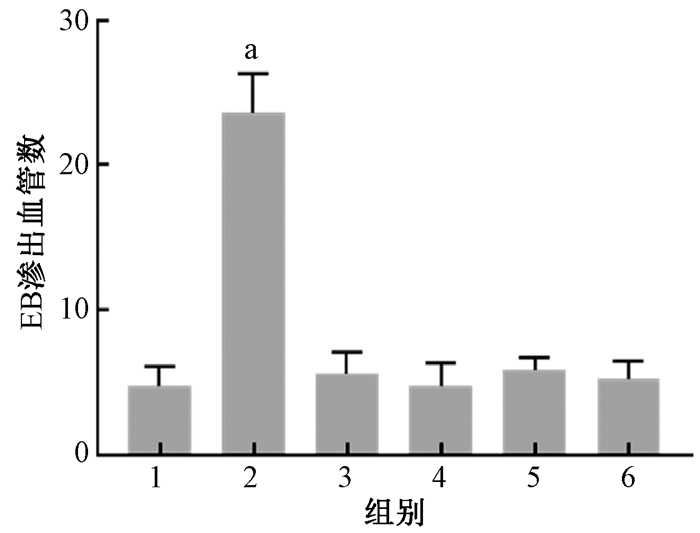
2.大鼠海马微血管周围白蛋白和伊文斯蓝渗出变化:白蛋白免疫组织化学结果显示,阳性对照组的血管周围可观察到明显的阳性白蛋白渗出(图 2)。与空白对照组相比,不同磁场强度的脉冲磁场辐射后,大鼠海马组织微血管周围未见有明显的白蛋白渗出灶,伊文斯蓝荧光结果与白蛋白检测结果一致(图 3)。通过对白蛋白免疫组织化学和伊文斯蓝荧光法的结果进行半定量分析显示,4个不同辐射强度组与阳性对照组相比,差异无统计学意义(P>0.05),见图 4,5。
|
图 2 不同强度磁场暴露后大脑微血管周围白蛋白渗出情况 免疫组织化学染色×400 A.假暴露对照组;B.100 mT磁辐射组;C.400 mT磁辐射组;D.阳性对照组;E.800 mT磁辐射组;F.1 200 mT磁辐射组 Figure 2 The immunohistochemical images of extravasation of albumin around cerebral microvessels after exposure to different intensity magnetic field ×400 A. Sham group; B.100 mT group; C. 400 mT group; D. Positive control group; E. 800 mT group; F. 1 200 mT group |
|
图 3 不同强度磁场暴露后大鼠海马EB荧光渗出情况 EB荧光示踪×200 A.假暴露对照组;B. 100 mT磁辐射组;C. 400 mT磁辐射组;D.阳性对照组;E. 800 mT磁辐射组;F. 1 200 mT磁辐射组 Figure 3 The extravasation of EB around cerebral microvessels after exposure to different intensity magnetic field ×200 A. Sham group; B. 100 mT group; C. 400 mT group; D. Positive control group; E. 800 mT group; F. 1 200 mT group |
|
注:1.假暴露对照组;2.阳性对照组;3.100 mT磁辐射组;4.400 mT磁辐射组;5.800 mT磁辐射组;6.1 200 mT磁辐射组。a与假暴露对照组比较,t=9.35,P<0.05 图 4 不同强度磁场暴露后大鼠海马组织白蛋白渗出情况的半定量分析结果 Figure 4 Semi-quantitative analysis of albumin extravasation after exposure to different intensity of magnetic field |
|
注:1.假暴露对照组;2.阳性对照组;3.100 mT磁辐射组;4.400 mT磁辐射组;5.800 mT磁辐射组;6.1 200 mT磁辐射组。a与假暴露对照组比较,t=14.01,P<0.05 图 5 不同强度磁场暴露后大鼠海马组织EB渗出情况的半定量结果 Figure 5 Semi-quantitative analysis of EB extravasation after exposure to different intensity of magnetic field |
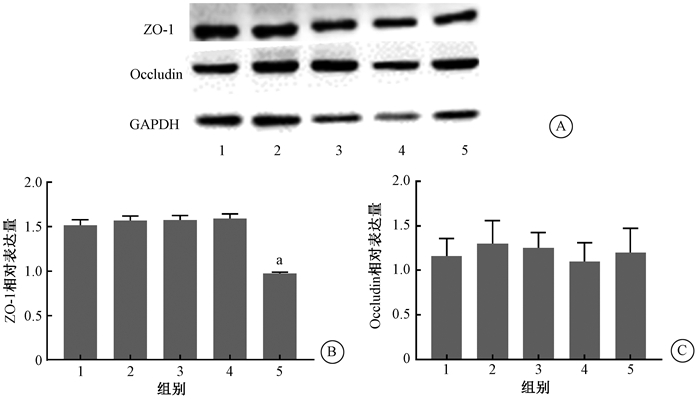
3.脉冲磁场辐射后大鼠BBBTJ相关蛋白表达改变:Western blot结果显示,与假暴露对照组相比,1 200 mT组ZO-1的表达水平显著降低(t=14.26,P<0.05),而其他辐射组的表达水平未见显著变化(P>0.05);与对照组相比,4个不同强度辐射组的Occludin表达水平均未见明显变化(P>0.05)(图 6)。
|
注:1.假暴露对照组;2. 100 mT磁辐射组;3. 400 mT磁辐射组;4. 800 mT磁辐射组;5. 1 200 mT磁辐射组。a与假暴露对照组比较,t=14.26,P<0.05 图 6 不同强度磁场暴露后大鼠海马组织紧密连接相关蛋白的表达情况 A. Western blot检测大鼠海马组织中ZO-1和Occludin表达;B.海马组织的Occludin相对表达量;C.海马组织的ZO-1相对表达量 Figure 6 Expression of TJs related proteins after exposure to different intensity of magnetic radiation A. Western blot assay of the protein ZO-1 and occludin in hippocampus of rats; B. The relative expression level of occludin in hippocampus; C. The relative expression level of ZO-1 in hippocampus |
讨论
BBB作为大脑功能的“守卫”,极易受到各种理化因素的攻击,从而导致中枢系统内环境的失调。多种急性和慢性的中枢神经系统疾病都有BBB破环的现象出现,说明BBB的破坏对大脑功能有潜在的损害性效应[3]。
现代社会的电器普及使得电磁辐射无处不在,电磁辐射对神经系统的生物学效应在近年来受到了广泛关注。国际非电离辐射委员会(ICNIRP)对于低频50~60 Hz的电磁辐射限值规定为,职业人群0.5 mT/24 h,公众群体0.1 mT/24 h。在生物电磁研究领域,微波辐射、射频辐射、电磁脉冲等不同频段的电磁辐射都能引起大鼠BBB对大分子物质的通透性增加[13-14]。近年来,磁场的生物学效应受到广泛关注,然而对于脉冲磁场的生物学效应主要集中在临床应用领域。Prato[15]阐述了低频脉冲磁场对大鼠有类似吗啡的镇痛作用,且在人体有良好的应用前景;Ma等[16]研究表明,低频的脉冲磁场对大鼠缺血再灌注的心肌具有保护作用;有研究发现,不同频率和幅值的低频脉冲磁场对U87细胞有不同程度的杀伤作用[17]。尽管,脉冲磁场的应用研究是康复治疗领域的研究热点。然而,有关脉冲磁场对神经系统的安全性评价研究较少。
BBB作为神经功能的重要防线,研究低频脉冲磁场对BBB的影响具有重要意义。另一方面,BBB作为中枢疾病药物递送的重要靶点,探索性地研究脉冲磁场对BBB通透性的影响,有望发现物理治疗的新策略。因此,本研究设置了不同的中高磁场强度,将BBB通透性作为评价指标,以探讨脉冲磁场临床应用的新策略及评价脉冲磁场对神经系统的效应。
因此,基于本实验室前期的实验手段,以及本实验室脉冲磁场发生器的设备,利用白蛋白免疫组织化学法和EB荧光法初次探索了脉冲磁辐射对BBB通透性的影响。内源性的白蛋白是相对分子量为69 000,完整的BBB能够阻止白蛋白进入脑组织内,当完整的BBB结构破坏后,会导致内源性的白蛋白进入脑组织。同理,外源性的EB在外周给药后,与白蛋白结合无法透过完整的BBB,EB在脑微血管周围渗出指示BBB通透性改变[18-19]。BBB的绝大部分特性表现在组成血管壁的内皮细胞及其紧密连接。TJ的相关蛋白有两个重要功能,一是显著减少极性溶质和离子从血液到大脑的渗透,反之亦然;二是帮助维持细胞的极性[20]。Occludin是构成TJ的主要结构蛋白,在脑血管内皮细胞的表达水平明显高于其他组织血管内皮细胞。ZO-1是一种胞质附着蛋白,可以使TJ蛋白Occludin、Claudin-5等连接到细胞骨架上[3]。TJ蛋白ZO-1、Occludin等蛋白量的降低,提示BBB的完整性受到破坏[21]。
本实验结果表明,单次中高磁场强度的脉冲磁场30个脉冲辐射后对BBB通透性不能产生显著的影响。首先,辐射后脑组织的HE结果表明大体形态结构没有产生显著的改变;其次,不同磁场强度的脉冲磁场作用后,并未引起内源性白蛋白透过BBB,同时也未导致外源性荧光示踪剂EB进入脑组织,阳性对照出现了内源性白蛋白和外源性EB的渗出,排除了实验操作的误差;最后,对脉冲磁场作用后的脑组织进行TJ相关蛋白ZO-1、Occludin进行Western blot蛋白定量分析,发现在1 200 mT磁场强度下会引起ZO-1的显著降低,其他实验组均未发现差异有统计学意义。
石向群等[22]研究发现脑组织的ZO-1表达水平和BBB对EB通透性均可反映BBB的损伤水平。Reinhold和Rittner[23]也阐述了在脑损伤条件下的BBB损伤伴随着TJ相关蛋白ZO-1的表达水平降低。因此,实验结果提示,在较高磁场强度作用下会对BBB的ZO-1蛋白表达水平产生影响,提示发生了BBB的损伤,然而单一的ZO-1表达水平的降低未引起BBB对内源性白蛋白和外源性示踪剂EB通透性的改变,提示目前磁场强度条件下引起的BBB完整性的损伤不会引起在光镜水平下的通透性变化。
本实验探索了在100、400、800、1 200 mT 4个磁场强度条件下的脉冲磁辐射对BBB的影响,发现30个脉冲的不同强度磁辐射单次暴露,BBB对白蛋白的通透性没有明显影响,在较高磁场强度时(1 200 mT),可以引起ZO-1表达水平降低。尽管在光镜下未见BBB通透性的变化,紧密连接蛋白ZO-1的表达降低提示BBB完整性的损坏。本实验说明了脉冲磁场存在使BBB结构发生损伤的风险,因此临床上使用较高强度的脉冲磁场应考虑其对中枢神经功能的负面影响。关于更高磁场强度、更长暴露时间的脉冲磁辐射对BBB的影响,需要进一步探讨。
利益冲突 无作者贡献声明 陈琴负责实验和论文撰写;高鹏协助完成实验;胡俊锋负责数据统计;丁桂荣、郭国祯参与研究设计与指导,提出修改意见
| [1] |
Obermeier B, Daneman R, Ransohoff RM. Development, maintenance and disruption of the blood-brain barrier[J]. Nat Med, 2013, 19(12): 1584-1596. DOI:10.1038/nm.3407 |
| [2] |
Begley DJ, Brightman MW. Structural and functional aspects of the blood-brain barrier[J]. Prog Drug Res, 2003, 61: 39-78. |
| [3] |
Keaney J, Campbell M. The dynamic blood-brain barrier[J]. FEBS J, 2015, 282(21): 4067-4079. DOI:10.1111/febs.13412 |
| [4] |
潘伟, 潘卫东, 许静静, 等. 用于糖尿病并发症研究的极低频脉冲磁场设计与实现[J]. 电工电能新技术, 2017, 36(12): 65-70. Pan W, Pan WD, Xu JJ, et al. Design and implementation of an extremely low frequency pulsed electromagnetic field system for diabetic complications[J]. Adv Technol Electr Eng Energy, 2017, 36(12): 65-70. DOI:10.12067/ATEEE1609021 |
| [5] |
杜迅, 郝建凤. 低频脉冲磁场对绝经后骨质疏松症患者骨代谢标志物水平的影响[J]. 中国临床研究, 2016, 29(9): 1216-1218. Du X, Hao JF. Effects of low-frequency pulsed magnetic field on bone metabolism markers in postmenopausal osteoporosis patients[J]. Chin J Clin Res, 2016, 29(9): 1216-1218. |
| [6] |
Daneman R. The blood-brain barrier in health and disease[J]. Ann Neurol, 2012, 72(5): 648-672. DOI:10.1002/ana.23648 |
| [7] |
Nakagawa M, Matsumoto K, Higashi H, et al. Acute effects of interstitial hyperthermia on normal monkey brain-magnetic resonance imaging appearance and effects on blood-brain barrier[J]. Neurol Med Chir (Tokyo), 1994, 34(10): 668-675. DOI:10.2176/nmc.34.668 |
| [8] |
Hjouj M, Last D, Guez D, et al. MRI study on reversible and irreversible electroporation induced blood brain barrier disruption[J]. PLoS One, 2012, 7(8): e42817. DOI:10.1371/journal.pone.0042817 |
| [9] |
Moriyama E, Salcman M, Broadwell RD. Blood-brain barrier alteration after microwave-induced hyperthermia is purely a thermal effect:Ⅰ. Temperature and power measurements[J]. Surg Neurol, 1991, 35(3): 177-182. DOI:10.1016/0090-3019(91)90068-K |
| [10] |
Jalali S, Huang Y, Dumont DJ, et al. Focused ultrasound-mediated BBB disruption is associated with an increase in activation of AKT:experimental study in rats[J]. BMC Neurol, 2010, 10: 114. DOI:10.1186/1471-2377-10-114 |
| [11] |
Prato FS, Wills JM, Roger J, et al. Blood-brain barrier permeability in rats is altered by exposure to magnetic fields associated with magnetic resonance imaging at 1.5 T[J]. Microsc Res Tech, 1994, 27(6): 528-534. DOI:10.1002/jemt.1070270607 |
| [12] |
刘源香, 杨继国. 督脉灸疗法对阿尔茨海默病模型小鼠学习记忆能力及海马CA1、CA3区HE染色的影响[J]. 山东中医杂志, 2017, 36(12): 1059-1062. Liu YX, Yang JG. Effect of du-mai-moxibustion on learning and memory ability and HE staining in hippocampus CA1 and CA3 of alzheimer's disease model mice[J]. Shandong J Trad Chin Med, 2017, 36(12): 1059-1062. |
| [13] |
高鹏, 张克英, 周艳, 等. 1840 MHz射频辐射对大鼠血脑屏障通透性的影响[J]. 现代生物医学进展, 2017, 17(30): 5827-5831. Gao P, Zhang KY, Zhou Y, et al. Effects of 1840 MHz radiofrequency radiation on BBB permeability in rats[J]. Prog Modern Biomed, 2017, 17(30): 5827-5831. |
| [14] |
高亚兵, 李翔, 王水明, 等. 伊文思蓝灌注染色技术在微波辐射致大鼠血脑屏障通透性改变中的应用[J]. 军事医学, 2011, 35(5): 391-393. Gao YB, Li X, Wang SM, et al. Application of Evans blue dye to the detection of permeability of BBB after microwave radiation[J]. Mil Med Sci, 2011, 35(5): 391-393. DOI:10.3969/j.issn.1674-9960.2011.05.017 |
| [15] |
Prato FS. Non-thermal extremely low frequency magnetic field effects on opioid related behaviors:Snails to humans, mechanisms to therapy[J]. Bioelectromagnetics, 2015, 36(5): 333-348. DOI:10.1002/bem.21918 |
| [16] |
Ma S, Zhang Z, Yi F, et al. Protective effects of low-frequency magnetic fields on cardiomyocytes from ischemia reperfusion injury via ROS and NO/ONOO-[J]. Oxid Med Cell Longev, 2013, 2013: 529173. DOI:10.1155/2013/529173 |
| [17] |
Akbarnejad Z, Eskandary H, Vergallo C, et al. Effects of extremely low-frequency pulsed electromagnetic fields (ELF-PEMFs) on glioblastoma cells (U87)[J]. Electromagn Biol Med, 2017, 36(3): 238-247. DOI:10.1080/15368378.2016.1251452 |
| [18] |
Kaya M, Ahishali B. Assessment of permeability in barrier type of endothelium in brain using tracers:Evans blue, sodium fluorescein, and horseradish peroxidase[J]. Methods Mol Biol, 2011, 763: 369-382. DOI:10.1007/978-1-61779-191-8_25 |
| [19] |
Blanchette M, Michaud K, Fortin D. A new method of quantitatively assessing the opening of the blood-brain barrier in murine animal models[J]. J Neurosci Methods, 2012, 207(2): 125-129. DOI:10.1016/j.jneumeth.2012.03.012 |
| [20] |
Greene C, Campbell M. Tight junction modulation of the blood brain barrier:CNS delivery of small molecules[J]. Tissue Barriers, 2016, 4(1): e1138017. DOI:10.1080/21688370.2015.1138017 |
| [21] |
Zlokovic BV. The blood-brain barrier in health and chronic neurodegenerative disorders[J]. Neuron, 2008, 57(2): 178-201. DOI:10.1016/j.neuron.2008.01.003 |
| [22] |
石向群, 杨金升, 石莉, 等. 伊文思蓝、ZO-1评估血脑屏障损伤的应用研究[J]. 西北国防医学杂志, 2004, 25(5): 329-332. Shi XQ, Yang JS, Shi L, et al. Application of Evans Blue and ZO-1 to inspect blood-brain barrier injury in rats[J]. Med J Nat Defending Forces Northwest Chin, 2004, 25(5): 329-332. DOI:10.3969/j.issn.1007-8622.2004.05.003 |
| [23] |
Reinhold AK, Rittner HL. Barrier function in the peripheral and central nervous system-a review[J]. Pflugers Arch, 2017, 469(1): 123-134. DOI:10.1007/s00424-016-1920-8 |
 2019, Vol. 39
2019, Vol. 39


