2. 美国纽约质子中心, 纽约州 10035;
3. 美国威斯康星医学院放疗中心, 密尔沃基 53226
2. New York Proton Center, New York NY 10035, United States of America;
3. Department of Radiation Oncology, Medical College of Wisconsin, Milwaukee 53226, United States of America
口干症是头颈部肿瘤放疗后严重的并发症,主要原因是放疗对唾液腺的损伤,尤其是对腮腺的损伤[1-3]。文献报道,放疗后6个月唾液腺分泌减少40%~60%,12个月减少20%~30%[1]。近年来对腮腺放疗剂量和体积与口干关系的研究报道较多,Eisbruch等[4]首次报道腮腺放疗剂量和口干有明显关系。研究显示,放疗过程中腮腺体积平均缩小30%,会引起长期口干症。但是在腮腺照射剂量许可的范围内仍然有重度口干发生,说明腮腺的纹理特征存在差异[5-7]。纹理分析是近年来医学影像分析领域的新兴工具,一些纹理指标能够区分CT图像上的相近纹理及特征变化,用于肿瘤的诊断及侵袭和转移的相关分析。Feng等[8]报道在头颈部鳞癌放疗过程中,肿瘤和脊髓的纹理特征变化与放疗反应有关。那么腮腺纹理特征的变化是否与口干症有关,目前报道甚少。本研究通过分析23例患者在放疗过程中腮腺纹理特征的变化,研究其与口干症的关系,为预测口干严重程度提供理论依据。
资料与方法1.患者资料:选择2016年2月到2017年10月收治的23例Ⅱ~Ⅳ期的头颈部肿瘤患者,其中鼻咽癌17例,口咽癌6例。所有患者均接受调强放疗,85%的患者接受了以顺铂为主的化疗。放疗期间每周观察口干严重程度,并根据放射治疗肿瘤协作组(RTOG)[9]分级(G0~G4级)进行临床实际口干程度分级。并从放疗计划中获取每位患者双侧腮腺照射的平均剂量。患者一般资料列于表 1。
|
|
表 1 23例头颈部肿瘤患者一般资料 Table 1 General information of 23 patients with head and neck cancer |
2.临床口干评价:放疗过程中,每周对患者口干程度进行评价,并根据RTOG分级:G0,基线无变化;G1,轻度口腔干燥,轻微唾液黏厚,可能有轻微味道变化,对刺激有反应;G2,中度口干,中度唾液黏厚,味道明显改变(即需要大量的水或其他润滑剂),对刺激反应差;G3,严重口干,无刺激,夜间经常需要醒来,饮用水;G4,急性唾液腺坏死。并将患者分为两组,轻度口干组为G0~G1;重度口干组为G2~G4。
3.放疗技术:采用德国西门子公司CTVision图像引导放疗(CTVision IGRT),静态调强,6~10个照射野,50~54个子野。系统中自带kV级滑轨CT(CT on rail)进行图像验证,每次扫描参数相同:35 mA,120 kV,层厚1.2 mm,验证图像包括全部腮腺组织。放疗剂量:原发灶GTV 68~70 Gy/30~35次,转移淋巴结GTVnd 60~68 Gy/30~35次,CTV1 60 Gy/30次,CTV2 50.4 Gy/30次。
4.化学治疗:同期化疗方案为顺铂60~80 mg/m2第1天+氟尿嘧啶750 mg/m2第1~5天,中位疗程数为2个疗程(疗程数范围2~3个疗程)。
5.数据采集:患者每日的CT验证图像传至MIM系统,选择每周1次,共7~8次CT图像,由同一名医生勾画出腮腺的轮廓,统一选取窗宽/窗位:50/250 HU。用MATLAB(R2013a版)创建内部分析软件,从CT图像中获取以下变量的数据:平均CT值(MCTN)、标准差(STD)、偏斜度(skewness)、峰度(kurtosis)、熵(entropy)和体积,并分析每周的变化。
6.利用MATLAB(R2013a)编写内部程序,将腮腺体积和平均CT值的变化作为变量,采用非线性逻辑分类方法建模,该模型假定口干的严重程度是由体积和平均CT值的变化来确定的,并利用K-Near Neighbour (KNN)方法[10]对所建模型进行优化,预测口干级别。并与临床实际口干级别对比,计算准确率。
7.统计学处理:使用GraphPad Prism 7统计软件进行数据分析。用Pearson相关检验对平均CT值、体积与口干程度进行相关性分析。影像组数据每周的变化经正态性检验符合正态分布用t检验。P < 0.0为差异有统计学意义。
结果1.腮腺CT纹理特征的变化
(1) 腮腺体积及平均CT值的变化:腮腺体积随着放疗时间明显缩小,平均缩小46.8%±18.7%(图 1)。从第1周到最后1周,腮腺的平均CT值减少18.5 HU,相应的体积减少40.1%,偏斜度、峰度、标准差和熵变化不明显(图 2)。
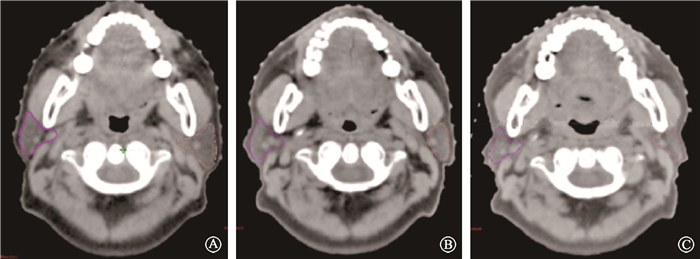
|
图 1 腮腺在治疗过程中CT轴位的变化 A、B、C分别为第1、15、30次 Figure 1 Changes of parotid glands in CT axial position A, B and C are the 1st, 15th and 30th times, respectively |
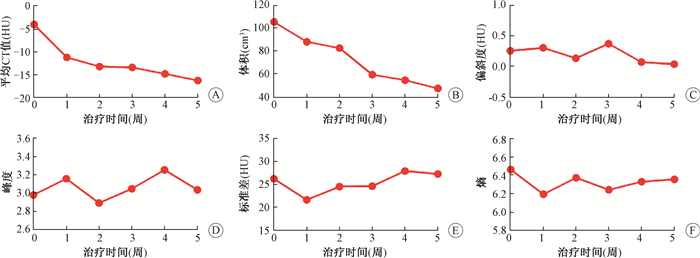
|
图 2 腮腺在放疗过程中CT纹理特征的变化 A.平均CT值;B.体积;C.偏斜度;D.峰度;E.标准差;F.熵 Figure 2 Change of radiomic features A.MCTN; B.Volume; C.Skewness; D. Kurtosis; E.STD; F.Entropy from the first to the last week for the PG |
(2) 双侧腮腺平均CT值的变化:从第1次到最后1次双侧腮腺平均CT值发生了变化,23例中有22例平均CT值减少,范围1.6~26.6 HU,平均值为(10.2±6.3)HU,仅1例患者明显增加13.4 HU(图 3)。

|
图 3 23例患者放疗中同侧和对侧腮腺平均CT值的变化 Figure 3 Change of MCTN in ipsilateral and contralateral PG of 23 patients |
(3) 双侧腮腺体积变化:两者变化是相似的,从放疗开始(第1次验证CT图像)到最后1次,同侧腮腺和对侧腮腺体积分别下降45.7%±17.0%和47.9%±21.1%(ρ=0.84, P < 0.001,图 4)。
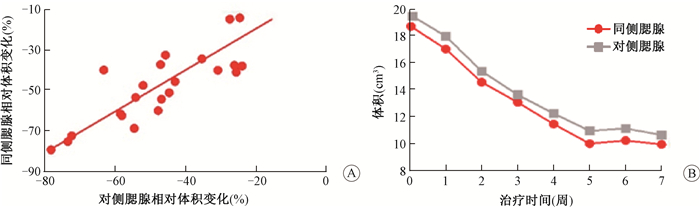
|
图 4 双侧腮腺在放疗过程中体积的变化 A.双侧腮腺相对体积变化的关系;B.双侧腮腺体积的变化 Figure 4 Volume changes of bilateral parotid glands during radiotherapy A.Relationship between relative volume changes of bilateral parotid glands; B.Change of volume in ipsilateral and contralateral PG |
(4) 其他纹理特征变化:标准差、偏斜度和峰度都有不同的变化。标准差和偏斜度呈增加趋势,但双侧存在差异;峰度呈降低趋势,但最后1周呈升高趋势(图 5)。
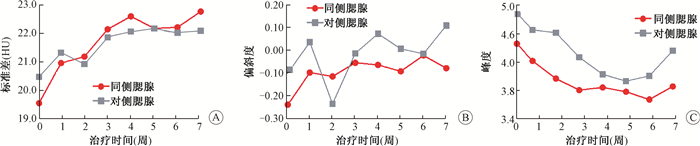
|
图 5 双侧腮腺CT纹理特征的变化 A.标准差;B.偏斜度;C.峰度 Figure 5 Changes of bilateral PG radiomic features A. STD; B. Skewness; C.Kurtosis |
2.患者临床口干评价:23例患者全部完成放射治疗,放疗结束口干程度评价:GR0:6例,GR1:9例,GR2:6例,GR3:2例。根据临床反应分为两组:轻度口干(G0+G1)和重度口干(G2+G3),轻度口干一般不需要干预,可以恢复正常;重度口干不容易恢复,需要尽早干预。治疗结束轻度口干15例(65.2%),重度口干8例(34.8%)。
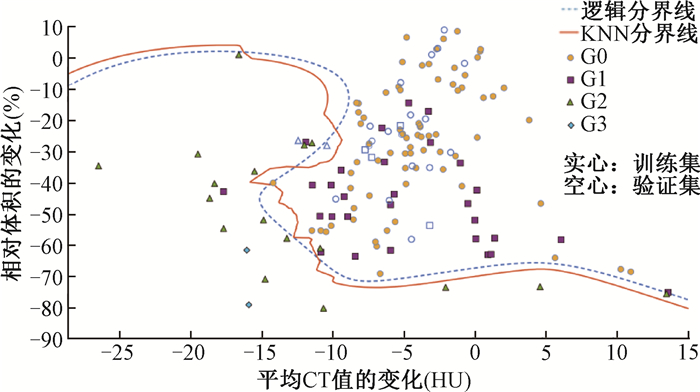
3.建立口干预测模型:该模型假定口干的严重程度(GR)是由平均CT值和体积的变化来确定的。在放疗过程中,分别对平均CT值与体积的变化进行分析,结果显示两者均与口干级别无明显相关性(P>0.05)。采用非线性逻辑分类方法建模,再利用KNN方法进行优化模型,得出模型的分类界线,公式如下:
| $ \begin{array}{l} f\left( {HU, \frac{V}{V}} \right) = {\left( {HU + 9.{\rm{ }}33\frac{V}{V} + 11.{\rm{ }}80} \right)^5} + H{U^3}\left( {24.{\rm{ }}45HU + } \right.\\ \left. {660.{\rm{ }}15} \right) - 57\;199HU - \frac{V}{V}\left( {2\;151.{\rm{ }}5H{U^3}30\;776H{U^2}\frac{V}{V} + } \right.\\ 37\;393H{U^2} + 191\;499HU{\frac{V}{V}^2} + 363\;482HU\frac{V}{V} + 304\;810HU + \\ \left. {446\;537{{\frac{V}{V}}^3} + 1129\;660{{\frac{V}{V}}^2} + 1\;429\;405{{\frac{V}{V}}^2} + 90\;458} \right) = 0 \end{array} $ | (1) |
| $ GR\left( {\Delta HU, \frac{{\Delta V}}{V}} \right) = \left\{ \begin{array}{l} 轻度口干:当f\left( {\Delta HU, \frac{{\Delta V}}{V}} \right) \ge 0\\ 重度口干:当f\left( {\Delta HU, \frac{{\Delta V}}{V}} \right) < 0 \end{array} \right. $ | (2) |
式中,GR为预测的当周口干级别;ΔHU为预测时间(当周)腮腺的平均CT值和第1周平均CT值的差值,HU;ΔV为预测当周腮腺的平均体积和第1周体积的差值,cm3;V为第1次放疗时腮腺的平均体积,cm3。
4.验证预测模型的精准度和有效性:用随机10例放疗结束后3个月的头颈部肿瘤患者作为验证集,数据采集同建模的23例患者:从放疗过程中每周腮腺验证CT图像中获取平均CT值、体积。将数据分析,预测的每周口干级别GR和临床实际评价相比,准确率为99%(图 6)。
|
图 6 口干分级预测模型的建立及模型精度的验证 Figure 6 Establishment of a predicted model of classification of Xerostomia grade and verification accuracy |
讨论
头颈部肿瘤预后较好,尤其是鼻咽癌经过标准方案治疗后5年生存率达80%以上,所以减轻放疗不良反应,提高生活质量是目前头颈部肿瘤放疗研究的重点课题。放射性口干症是头颈部肿瘤患者放疗后最常见的并发症,重度口干严重影响患者的生活质量。尽管调强放疗在靶区精度及降低腮腺照射剂量方面有很大的提高,但仍然有部分患者在放疗后出现重度口干,这可能与腮腺组织的个体差异有很大关系。从影像学角度考虑,可能与腮腺影像的纹理特征照射后发生变化有关。
有报道头颈部鳞癌在放疗过程中,腮腺影像的纹理特征发生变化[8, 11]。本研究显示,双侧腮腺平均CT值平均减少(10.2±6.3) HU,这和Feng等[8]的研究相符合。另外,本研究还发现腮腺平均CT值的变化和临床口干的严重程度(级别)有关,6例重度口干患者平均CT值的变化>15 HU,且每周减少>3.5 HU。提示双侧腮腺MCTN减少越多,口干程度越重,该结果和Belli等[12]的报道相似。
上述研究仅仅从单因素(腮腺的平均CT值或体积变化)定性分析与口干程度的关系,没有进行量化评估和预测[7, 12]。虽然有报道多变量分析与口干症的关系,但是没有直接的量化公式[13]。本研究报道了平均CT值和体积变化反应了不同方面的放射影响。目前纹理分析已用于肿瘤对放疗反应的评估和预测患者生存[14-15]。但放疗引起CT纹理特征变化的机制尚不完全清楚。体积变化可能由于脂肪组织和腺泡细胞的损伤引起[14]。平均CT值的变化可能是腮腺组织成分和密度变化的直接结果,主要是由于腺泡细胞和脂肪组织受辐射的改变[16-17]。有研究报道纹理特征的变化也可能是由于内部变异性,因此对纹理分析进行协调和标准化至关重要[18]。
建立模型,在独立变量选择上,考虑到不同变量的数据波动范围影响模型的表达效率。平均CT值和体积的变化较其他参量有更大的数据涨落,标准差、偏斜度和峰度的变化没有明显的涨落幅度,因此选择这两个变量更容易提升模型精准度。另外,建模方法选择非线性逻辑分类法比文献[19]报道的线性建模方法更具有可信度。再之,建立预测模型选择头颈部肿瘤患者(17例鼻咽癌,6例口咽癌),而没有选择单一的鼻咽癌,就是考虑建模应用的普遍性。由于选择的变量是腮腺的MCTN的变化和腮腺的体积变化,而不是剂量,这样不需要考虑靶区范围带来的干扰。
在头颈部肿瘤放疗过程中,每周临床医生根据患者主诉、体检和体征评价的口干分级存在一定的主观性和不确定性,RG模型的评估避免了主观因素,可信度高。本研究勾画腮腺轮廓时统一选取35 mA、120 kV、窗宽/窗位:50/250 HU,在此条件下腮腺结构显示清晰。Feng等[20]的研究表明,即使对于不同人,腮腺轮廓的勾画,误差也是有限的,平均体积的误差只有1/33,重叠比例系数(fractional overlap)为0.9。同一个勾画者误差更小,符合RTOG对危及器官(OAR)勾画的要求。
当然,颌下腺和口腔小的涎腺也会影响唾液的产生,但在模拟条件下腮腺产生大部分唾液[1, 12]。特别是口干分级,会受很多不明的因素影响,化疗药物也会影响涎腺的损伤。
尽管本研究选择患者在放射治疗过程中腮腺体积的变化和平均CT值的变化作为变量建立口干分级预测模型目前得出99%的精准度,但由于建模的样本量只有23例患者影像组学数据,验证模型也只有10例患者数据分析,存在局限性。该预测模型还需要大量的数据进一步验证,并且需要多中心数据验证可信度。再之,本研究CT图像的采集及分析需要很强的放射物理团队给与支持和帮助,并且需要放疗设备支持,所以在临床应用及推广方面存在一定的局限性。
利益冲突 无作者贡献声明 闫朱敏负责数据整理分析和论文撰写;Zhang Jingqiao和Chen Xiaojian负责影像组数据处理及建模;海龙和孙学明负责靶区勾画和临床资料采集;吴慧提供研究思路和论文审校
| [1] |
Tribius S, Sommer J, Prosch C, et al. Xerostomia after radiotherapy. What matters——mean total dose or dose to each parotid gland?[J]. Strahlenther Onkol, 2013, 189(3): 216-222. DOI:10.1007/s00066-012-0257-2 |
| [2] |
Deasy JO, Moiseenko V, Marks L, et al. Radiotherapy dose-volume effects on salivary gland function[J]. Int J Radiat Oncol Biol Phys, 2010, 76(3 Suppl): S58-63. DOI:10.1016/j.ijrobp.2009.06.090 |
| [3] |
Bjordal K, Kaasa S, Mastekaasa A. Quality of life in patients treated for head and neck cancer:a follow-up study 7 to 11 years after radiotherapy[J]. Int J Radiat Oncol Biol Phys, 1994, 28(4): 847-856. DOI:10.1016/0360-3016(94)90104-X |
| [4] |
Eisbruch A, Ten Haken RK, Kim HM, et al. Dose, volume, and function relationships in parotid salivary glands following conformal and intensity-modulated irradiation of head and neck cancer[J]. Int J Radiat Oncol Biol Phys, 1999, 45(3): 577-587. DOI:10.1016/S0360-3016(99)00247-3 |
| [5] |
Sanguineti G, Ricchetti F, Thomas O, et al. Pattern and predictors of volumetric change of parotid glands during intensity modulated radiotherapy[J]. Br J Radiol, 2013, 86(1031): 20130363. DOI:10.1259/bjr.20130363 |
| [6] |
Sanguineti G, Ricchetti F, Wu B, et al. Parotid gland shrinkage during IMRT predicts the time to Xerostomia resolution[J]. Radiat Oncol, 2015, 10: 19. DOI:10.1186/s13014-015-0331-x |
| [7] |
Wu VW, Ying MT, Kwong DL. Evaluation of radiation-induced changes to parotid glands following conventional radiotherapy in patients with nasopharygneal carcinoma[J]. Br J Radiol, 2011, 84(1005): 843-849. DOI:10.1259/bjr/55873561 |
| [8] |
Feng M, Yang C, Chen X, et al. Computed tomography number changes observed during computed tomography-guided radiation therapy for head and neck cancer[J]. Int J Radiat Oncol Biol Phys, 2015, 91(5): 1041-1047. DOI:10.1016/j.ijrobp.2014.12.057 |
| [9] |
Cox JD, Stetz J, Pajak TF. Toxicity criteria of the Radiation Therapy Oncology Group (RTOG) and the European Organization for Research and Treatment of Cancer (EORTC)[J]. Int J Radiat Oncol Biol Phys, 1995, 31(5): 1341-1346. DOI:10.1016/0360-3016(95)00060-C |
| [10] |
周志华. 机器学习[M]. 北京: 清华大学出版社, 2016: 60-63.225-240. Zhou ZH. Machine learning[M]. Beijing: Tsinghua University Press, 2016: 60-63.225-240. |
| [11] |
Pota M, Scalco E, Sanguineti G, et al. Early prediction of radiotherapy-induced parotid shrinkage and toxicity based on CT radiomics and fuzzy classification[J]. Artif Intell Med, 2017, 81: 41-53. DOI:10.1016/j.artmed.2017.03.004 |
| [12] |
Belli ML, Scalco E, Sanguineti G, et al. Early changes of parotid density and volume predict modifications at the end of therapy and intensity of acute xerostomia[J]. Strahlenther Onkol, 2014, 190(11): 1001-1007. DOI:10.1007/s00066-014-0669-2 |
| [13] |
van Dijk LV, Brouwer CL, van der Schaaf A, et al. CT image biomarkers to improve patient-specific prediction of radiation-induced xerostomia and sticky saliva[J]. Radiother Oncol, 2017, 122(2): 185-191. DOI:10.1016/j.radonc.2016.07.007 |
| [14] |
Mayer R, Stanton K, Kleinberg L, et al. CT number distribution and its association with local control and as a marker of lung tumor response to radiation[J]. Radiat Oncol Invest, 2015, 6(6): 281-288. DOI:10.1002/(SICI)1520-6823(1998)6:6<281::AID-ROI6>3.0.CO;2-H |
| [15] |
Paul J, Yang C, Wu H, et al. Early Assessment of radiothrapy sensitivitys during radiation therapy for lung cancer using quantitative analysis of daily computed tomography[J]. Int J Radiat Oncol Biol Phys, 2017, 98(2): 463. DOI:10.1016/j.ijrobp.2017.02.032 |
| [16] |
Teshima K, Murakami R, Yoshida R, et al. Histopathological changes in parotid and submandibular glands of patients treated with preoperative chemoradiation therapy for oral cancer[J]. J Radiat Res, 2012, 53(3): 492-496. |
| [17] |
Scalco E, Fiorino C, Cattaneo GM, et al. Texture analysis for the assessment of structural changes in parotid glands induced by radiotherapy[J]. Radiother Oncol, 2013, 109(3): 384-387. DOI:10.1016/j.radonc.2013.09.019 |
| [18] |
Caramella C, Allorant A, Orlhac F, et al. Can we trust the calculation of texture indices of CT images? A phantom study[J]. Med Phys, 2018, 45(4): 1529. DOI:10.1002/mp.12809 |
| [19] |
Wu H, Chen X, Yang X, et al. Early prediction of acute xerostomia during radiation therapy for head and neck cancer based on texture analysis of daily CT[J]. Int J Radiat Oncol Biol Phys, 2018, 102(4): 1308-1318. DOI:10.1016/j.ijrobp.2018.04.059 |
| [20] |
Feng M, Demiroz C, Vineberg KA, et al. Normal tissue anatomy for oropharyngeal cancer:contouring variability and its impact on optimization[J]. Int J Radiat Oncol Biol Phys, 2012, 84(2): e245-249. DOI:10.1016/j.ijrobp.2012.03.031 |
 2019, Vol. 39
2019, Vol. 39


