Ⅳ期肿瘤早年的标准治疗是以姑息为目的的全身治疗。1995年,Hellman与Weichselbaum提出了“寡转移”的概念[1]。寡转移是处于局限期与转移性肿瘤之间的一种状态,被公认为具有5个或5个以下的转移灶[2],这类患者病情进展较慢,能从局部治疗中获益[3]。相应的回顾性研究显示,转移至肝、肺的寡转移灶的患者可通过手术切除获得20%~47%的5年生存率[4-5]。
立体定向放疗(stereotactic body radiation therapy, SBRT)早期应用于Ⅰ期非小细胞肺癌(NSCLC)患者的根治性治疗[6]。多项研究显示,SBRT给这类因年龄或者合并症不能手术的Ⅰ期NSCLC患者带来了84%~98%的局部控制率[7-8]。由于SBRT在NSCLC原发灶的治疗中显示了较好的局部控制率与可控的不良反应,近年来也开始逐渐应用于晚期肿瘤的肺寡转移灶的治疗,虽然有相应的前瞻性研究开始探讨SBRT在Ⅳ期肿瘤寡转移灶治疗中的地位[9-10],但这些临床试验目前尚未到达研究终点。大多数报道病例数较少且为回顾性研究。因此,本研究在前期51例SBRT报道的基础上[11],进一步更新SBRT应用于肺寡转移灶的局部控制率、总生存、不良反应及预后相关因素。
资料与方法1.入组标准:连续收集武汉大学中南医院放化疗科2012年5月至2018年6月接受SBRT治疗的共111例肺寡转移患者,去掉其中7例转移灶>5个的患者,纳入分析的104例患者满足以下条件:PS评分0~2分;原发肿瘤控制较好;转移灶≤5个;肺外转移灶,尤其是脑及肝转移灶,控制稳定或无活动征象;全身治疗后病灶稳定或全身治疗后病灶局部进展;所有患者肺转移灶均经多次胸部增强CT或PET-CT检查,影像学专家和临床专家共同确诊。
2.临床资料:104例肺寡转移患者,共135个肺转移结节得到SBRT治疗,原发肺癌71例,肺外来源肿瘤33例。单程治疗患者90例(1个结节85例、2个结节2例、3个结节3例),2程治疗10例患者(1个结节9例、2个结节1例),3程治疗2例(均为单个结节),4程治疗2例(均为单个结节)。≥2个结节或多程治疗患者以直径最大结节进行生存分析。104例患者中,SBRT前无任何全身治疗的为30例,经历分子靶向治疗(NSCLC)18例,SBRT前行化疗的56例。所有未经历全身治疗直接行SBRT的患者,肿瘤负荷相对较小,SBRT治疗后病情进展的患者有5例,这5例患者均未接受全身治疗;而先经历全身治疗后再行SBRT的患者,其肺部转移灶在化疗或者靶向治疗后病情稳定或出现病灶局部进展后再行SBRT,SBRT治疗后有22例患者接受继续原方案全身治疗,直至出现进展,包括局部进展或远处转移后再换方案。以上排除了全身治疗对SBRT客观缓解率与局部控制率的影响。具体临床特征详见表 1。
|
|
表 1 患者的临床基线与治疗资料 Table 1 Characteristics of clinical baseline and treatment data |
3.治疗方法:定位与放疗计划:患者仰卧位,SBRT体架固定,采用腹压板限制呼吸,CT模拟机3 mm层厚扫描(若行4DCT,采集不同时相CT图像)。图像传至Eclipse或Varian计划系统进行靶区勾画,有4DCT的在各个时相勾画肿瘤靶体积(GTV)合成内靶区(ITV),在各个方向外放5 mm生成计划靶体积(PTV);无4DCT的GTV头脚方向外放10 mm,其余方向外放5 mm生成PTV。处方剂量覆盖95%PTV。2015年12月以前的患者采用IMRT-SBRT,2015年12月以后的患者采用HT-SBRT。正常组织的剂量限制以放射治疗肿瘤协作组(RTOG)0618为标准。分割方式为3~10次,具体为50 Gy分5次(65例),50 Gy分10次(11例),40 Gy分4次(5例),70 Gy分10次(3例),60 Gy分3次(3例),40 Gy分5次(3例),30 Gy分3次(3例),70 Gy分7次(2例),42 Gy分6次(2例),50 Gy分4次(1例),48 Gy分4次(1例),35 Gy分10次(2例),60 Gy分8次(1例),32 Gy分4次(1例),54 Gy分3次(1例)。治疗时间不超过14 d。每次SBRT进行图像校正,确保治疗精确性。
4.疗效评价:疗效采用RECIST 1.1评价,完全缓解(complete remission, CR),部分缓解(partial remission, PR),疾病稳定(stable disease, SD),疾病进展(progressive disease, PD);客观缓解率(objective response rate, ORR)采用PR+CR计算,疾病控制率(disease control rate, DCR)采用CR+PR+SD计算,急性放疗不良反应及晚期损伤采用美国国立癌症研究所(NCI)常见不良反应事件评价标准(CTCAE)V4.0评价。所有患者在SBRT结束1个月后行胸部CT或PET-CT评价疗效。此后2年内每3个月复查1次,2年后每半年复查1次。连续变量采用均数/中位数显示,分类变量采用频率显示。总生存(overall survival, OS)定义为肺寡转移SBRT结束后至肿瘤相关死亡的时间。局部控制(local control, LC)定义为肺寡转移SBRT结束后PTV内或边缘没有新的或者原病灶复发。无进展生存期(progression-free survival, PFS)定义为肺寡转移SBRT结束后第一次发生疾病进展或任何原因死亡的时间。
5.统计学处理:采用SPSS 22.0统计软件行Kaplan-Meier进行生存分析,Cox模型进行单因素与多因素分析。P<0.05为差异具有统计学意义。
结果1.临床疗效:总体的中位随访时间为19.6个月(95%CI 10.7~28.4个月)。如图 1所示,中位OS为26.6个月(95%CI 11.8~41.4个月),1年、2年、3年的生存率分别为75.9%、53.2%、43.53%。其中,胃肠道肿瘤的1年与2年生存率分别为84.6%与55.5%,肺癌的1年与2年生存率分别为75.4%与55.3%,而妇科肿瘤与泌尿系统肿瘤的1年与2年生存率分别为72.9%与37.5%。
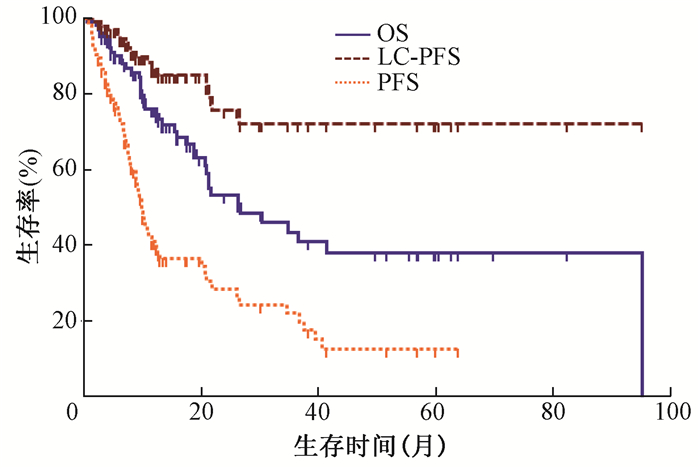
|
注:OS.总生存;LC-PFS.局部控制无进展生存;PFS.无进展生存 图 1 SBRT患者的OS、LC-PFS及PFS的生存曲线 Figure 1 Survival curves of OS, LC-PFS and PFS in all patients treated with SBRT |
根据实体瘤RECIST 1.1疗效评估,随访期间12位(11.5%)患者肺寡转移灶CR,48位(46.2%)患者肺寡转移灶PR,28位(26.9%)患者肺寡转移灶SD,16位(15.4%)患者肺寡转移灶PD。1、2和3年的局部控制率分别为86.6%、75.9%和72.3%。
随访期间共出现了71名(68.3%)患者的病情进展,中位PFS时间为9.9个月(95%CI 8.5~11.3个月),1、2和3年的PFS分别为40.9%、28.4%和22.1%。主要进展模式包括:远处转移;胸腔内转移(包括胸膜转移以及SBRT照射野外肺转移);局部复发。其中,41名患者出现远处转移,14名患者出现胸腔内转移,16名患者为局部复发。进展模式以远处转移及胸腔内其他转移为主。
2.单因素分析:OS的Cox单因素分析结果示于表 2。OS明显与SBRT后进展的方式有关(χ2=34.559,P < 0.05)。而患者的性别、年龄、吸烟、SBRT前全身治疗的方式、SBRT后全身治疗的方式等因素对OS没有显著影响。
|
|
表 2 SBRT患者的OS与LC单因素分析 Table 2 Univariate analyses for OS and LC in all patients treated with SBRT |
肺部寡转移灶LC与原发肿瘤的病理类型相关,消化道肿瘤的LC相比于肺腺癌风险比为5.166(χ2=14.359,P < 0.05)。长期随访后,HT-SBRT对比IMRT-SBRT肺转移灶的LC差异无统计学意义(P=0.925)。同时,两者的OS差异也无统计学意义(P=0.297)。
3.多因素分析:OS进行Cox多因素分析,结果示于表 3,再次验证了SBRT后进展的方式为OS的独立预后因素(χ2=40.01,P < 0.05)。但原发肿瘤的病理类型对OS无显著影响,该结果可能与样本量较小有关。
|
|
表 3 SBRT患者的OS与LC多因素分析 Table 3 Multivariate analyses for OS and LC in all patients treated with SBRT |
同样地,LC进行Cox多因素分析,结果示于表 3,原发肿瘤的病理类型对LC有显著影响,相比于肺腺癌,消化道肿瘤的HR为5.250(χ2=28.66,P < 0.05)。生物等效剂量(BED)对LC仍然没有显著影响(P=0.176),该结果说明在该研究中所使用的剂量达到了有效的局部控制。肺部结节SBRT的体积被验证为LC的独立预后因素(χ2=28.66,P < 0.05)。另外,通过ROC曲线对CEA取截断值为9.08 ng/ml,将其分组纳入Cox分析,结果提示SBRT治疗前≤9.08 ng/ml对比癌胚抗原(CEA)> 9.08 ng/ml的HR=0.061(χ2=28.66,P < 0.05)。
4.不良反应:SBRT主要不良反应为放射性肺炎,除外可见4例放疗后食欲下降,4例放疗后骨髓抑制(2级以下),2例放疗后6个月后气管塌陷,未见胸壁疼痛,肋骨骨折等。所有患者中发生放射性肺炎共25例(24.04%),根据CTCAE 4.0标准,以1级放射性肺炎为主(18例,3.8%),2级以上放射性肺炎的发生率不超过7%(2级4例,3.8%;3级3例,3.8%),没有4级的放射性肺炎发生。通过logistic回归分析,将患者的临床特征与放疗变量纳入模型分析,发现性别、年龄、PS评分、原发肿瘤的病理类型、放射治疗部位、分次剂量、总剂量、GTV体积、结节直径等参数对放射性肺炎的发生均无显著影响。另外,卡方检验证实,HT-SBRT与IMRT-SBRT两种不同放疗方式2级及以上的放射性肺炎的发生率差异无统计学意义(P=0.234)。
讨论近年来,SBRT广泛应用于肿瘤的寡转移灶,多项回顾性的研究显示肺寡转移灶的2年局部控制率77.9%~89.0%,2年总生存率53.7%~73.0%[11-13]。科罗拉多大学的一项回顾性研究发现,转移性肿瘤一线化疗后首次进展部位以原发肿瘤以及既往所在的转移部位为主[14]。因此,患者在一线治疗后接受巩固放疗可延长PFS。本研究中,共104例患者的2年局部控制率为75.9%,2年的总生存率为53.2%,与既往研究报道以及本研究的前期报道一致。进一步分析治疗失败模式,行SBRT后改变了患者原发病灶或既往转移灶更易首次进展的模式,疾病的进展以远处转移与野外转移为主(占所有进展人数的77.5%),并且,SBRT前的全身治疗方式与治疗后首次进展方式无明显相关性(P=0.568),提示SBRT能显著降低患者的肿瘤负荷,延长患者的局部控制时间,从而延长患者的PFS。本研究中,SBRT治疗后的中位PFS时间为9.9个月,该PFS不包括前期一线治疗的时间,明显延长了Ⅳ期肿瘤一线治疗的PFS时间。
本院2012—2015年共51例SBRT的回顾性分析报道,肺转移结节数≤2、PFI及ECGO评分≤2分为OS独立预后因素,治疗后主要不良反应为放射性肺炎[11]。本研究中,更新病例数为104例,并延长了前期51例患者的随访时间后,进行预后分析发现,以上因素对OS无显著影响,SBRT治疗后进展的方式为OS独立预后因素(χ2=40.01,P < 0.05),考虑与前期报道的样本量较小有关。LC进行Cox多因素分析后,BED≤100 Gy与BED>100 Gy对LC无显著影响。Shintani等[15]研究血清CEA对接受立体定向放射治疗的非小细胞肺癌患者的预后意义,总共分析了129名Ⅰ期NSCLC患者并将其分成两组:CEA-High(CEA> 5 ng/ml)和CEA-Low(CEA≤5 ng/ml),并得出结论:CEA-High Ⅰ期NSCLC患者发生局部或全身复发的风险较高,应谨慎随访。根据该研究结论,本研究将原发肿瘤类型及肺部结节的体积分别纳入LC预后因素分析中的同时,将SBRT治疗前CEA水平也纳入LC预后因素分析中,原发肿瘤的病理类型、肺部结节的体积、SBRT治疗前CEA水平均为LC的独立预后因素(χ2=28.66,P < 0.05)。可以考虑为CEA水平可能在一定程度上反映肿瘤的负荷。肺寡转移灶的体积越大,局部控制率越低,与既往报道一致,但BED与局部控制率无关与既往报道不一致,可能与大部分患者均接受了50 Gy,5次(BED=100 Gy,62.5%)的治疗有关,而且为了控制不良反应的发生率,对于体积更大的肿瘤也并没有采用更高的剂量。因此,对于肺转移结节较大的,来自于消化道、妇科、泌尿系统肿瘤,以及CEA> 9.08 ng/ml的患者,在正常组织限量的前提下,可提高这部分肺寡转移灶的剂量来提高局部控制。
SBRT的技术主要有调强放疗(IMRT)、容积旋转调强放疗(VMAT)和螺旋断层放疗(HT),不同的放疗技术各有其优缺点。HT可通过每日MV级CT进行图像引导,监测肿瘤体积变化,使放疗位置更精确。与其他SBRT放疗技术相比,HT治疗时间更短,并且具有同时治疗多个转移灶的优势,但由于其低剂量覆盖区较大,应用于SBRT仍具有一定争议[16-17]。目前已有多项剂量学研究提示,HT-SBRT比IMRT-SBRT靶区适形性更好,危及器官的剂量相对更低。对于肺SBRT,比较了三维适形放疗、调强放射治疗及螺旋断层放疗的剂量学,提示调强放射治疗及螺旋断层放疗在保证PTV靶区剂量均匀度和适形度的同时,可以有效保护重要危及器官,螺旋断层放疗更具有剂量学优势[18]。但以上研究缺乏HT-SBRT的LC、OS及不良反应的随访结果。本研究中,将HT-SBRT及IMRT-SBRT放疗方式作为一个分层因素进行分析发现,HT-SBRT与IMRT-SBRT相比,其LC与OS均差异无统计学意义;两者2级及以上的放射性肺损伤的发生率差异也无统计学意义。因此,本研究从长期随访的角度验证了TOMO应用于SBRT是安全有效的。
总之,对于寡转移的患者,在一线治疗时或者诱导治疗后行局部治疗能有效降低肿瘤负荷,延长患者的PFS。SBRT应用于肺寡转移灶的治疗局部控制率高,不良反应小。肺转移结节体积,原发肿瘤的病理类型及治疗前CEA是LC的独立预后因素,对于高危因素的患者应在正常组织耐受的前提下提高SBRT的剂量。而SBRT治疗后的进展方式是OS的独立预后因素,以远处转移为主,因此,SBRT治疗的同时还需加强有效的全身治疗。最后,本研究从长期随访的角度验证了HT-SBRT与IMRT-SBRT的疗效相当,不良反应差异无统计学意义,可广泛应用于临床。当然,由于本研究是回顾性的分析,还需要更大样本的前瞻性研究的验证。
利益冲突 无作者贡献声明 书阿克·努尔江负责资料收集、数据的整理和分析、论文的撰写和修改;欧阳雯协助整理数据、修改论文;李智军、张俊红、周福祥及钟亚华负责提供数据,协助修改论文;谢丛华提出研究设计思路,指导论文修改
| [1] |
Hellman S, Weichselbaum RR. Oligometastases[J]. J Clin Oncol, 1995, 13(1): 8-10. DOI:10.1200/JCO.1995.13.1.8 |
| [2] |
Milano MT, Katz AW, Zhang H, et al. Oligometastases treated with stereotactic body radiotherapy:long-term follow-up of prospective study[J]. Int J Radiat Oncol Biol Phys, 2012, 83(3): 878-886. DOI:10.1016/j.ijrobp.2011.08.036 |
| [3] |
Ashworth A, Rodrigues G, Boldt G, et al. Is there an oligometastatic state in non-small cell lung cancer? A systematic review of the literature[J]. Lung Cancer, 2013, 82(2): 197-203. DOI:10.1016/j.lungcan.2013.07.026 |
| [4] |
Casiraghi M, De Pas T, Maisonneuve P, et al. A 10-year single-center experience on 708 lung metastasectomies:the evidence of the ″international registry of lung metastases″[J]. J Thorac Oncol, 2011, 6(8): 1373-1378. DOI:10.1097/JTO.0b013e3182208e58 |
| [5] |
House MG, Ito H, Gönen M, et al. Survival after hepatic resection for metastatic colorectal cancer:trends in outcomes for 1, 600 patients during two decades at a single institution[J]. J Am Coll Surg, 2010, 210(5): 744-752, 752-755. DOI:10.1016/j.jamcollsurg.2009.12.040 |
| [6] |
Guckenberger M, Allgäuer M, Appold S, et al. Safety and efficacy of stereotactic body radiotherapy for stage 1 non-small-cell lung cancer in routine clinical practice:a patterns-of-care and outcome analysis[J]. J Thorac Oncol, 2013, 8(8): 1050-1058. DOI:10.1097/JTO.0b013e318293dc45 |
| [7] |
Boda-Heggemann J, Frauenfeld A, Weiss C, et al. Clinical outcome of hypofractionated breath-hold image-guided SABR of primary lung tumors and lung metastases[J]. Radiat Oncol, 2014, 9: 10. DOI:10.1186/1748-717X-9-10 |
| [8] |
Baumann P, Nyman J, Hoyer M, et al. Outcome in a prospective phase Ⅱ trial of medically inoperable stage Ⅰ non-small-cell lung cancer patients treated with stereotactic body radiotherapy[J]. J Clin Oncol, 2009, 27(20): 3290-3296. DOI:10.1200/JCO.2008.21.5681 |
| [9] |
Corbin KS, Hellman S, Weichselbaum RR. Extracranial oligometastases:a subset of metastases curable with stereotactic radiotherapy[J]. J Clin Oncol, 2013, 31(11): 1384-1390. DOI:10.1200/JCO.2012.45.9651 |
| [10] |
Salama JK, Chmura SJ. Surgery or ablative radiotherapy for breast cancer oligometastases[J]. Am Soc Clin Oncol Educ Book, 2015, e8-15. DOI:10.14694/EdBook_AM.2015.35.e8 |
| [11] |
李智军, 李春阳, 张俊红, 等. 肺寡转移瘤SBRT疗效及预后因素分析[J]. 中华放射肿瘤学杂志, 2017, 26(12): 1381-1384. Li ZJ, Li CY, Zhang JH, et al. Clinical efficacy and prognostic factors of stereotactic body radiotherapy for pulmonary oligometastases[J]. Chin J Radiat Oncol, 2017, 26(12): 1381-1384. DOI:10.3760/cma.j.issn.1004-4221.2017.12.005 |
| [12] |
Ricardi U, Filippi AR, Guarneri A, et al. Stereotactic body radiation therapy for lung metastases[J]. Lung Cancer, 2012, 75(1): 77-81. DOI:10.1016/j.lungcan.2011.04.021 |
| [13] |
Sharma A, Duijm M, Oomen-de Hoop E, et al. Factors affecting local control of pulmonary oligometastases treated with stereotactic body radiotherapy[J]. Acta Oncol, 2018, 57(8): 1031-1037. DOI:10.1080/0284186X.2018.1445285 |
| [14] |
Rusthoven KE, Hammerman SF, Kavanagh BD, et al. Is there a role for consolidative stereotactic body radiation therapy following first-line systemic therapy for metastatic lung cancer? A patterns-of-failure analysis[J]. Acta Oncol, 2009, 48(4): 578-583. DOI:10.1080/02841860802662722 |
| [15] |
Shintani T, Matsuo Y, Iizuka Y, et al. Prognostic significance of serum CEA for non-small cell lung cancer patients receiving stereotactic body radiotherapy[J]. Anticancer Res, 2017, 37(9): 5161-5167. DOI:10.21873/anticanres.11937 |
| [16] |
Hodge W, Tomé WA, Jaradat HA, et al. Feasibility report of image guided stereotactic body radiotherapy (IG-SBRT) with tomotherapy for early stage medically inoperable lung cancer using extreme hypofractionation[J]. Acta Oncol, 2006, 45(7): 890-896. DOI:10.1080/02841860600907329 |
| [17] |
Kim JY, Kay CS, Kim YS, et al. Helical tomotherapy for simultaneous multitarget radiotherapy for pulmonary metastasis[J]. Int J Radiat Oncol Biol Phys, 2009, 75(3): 703-710. DOI:10.1016/j.ijrobp.2008.11.065 |
| [18] |
Kinhikar RA, Ghadi YG, Sahoo P, et al. Dosimetric comparison of three-dimensional conformal radiotherapy, intensity modulated radiotherapy, and helical tomotherapy for lung stereotactic body radiotherapy[J]. J Med Phys, 2015, 40(4): 190-197. DOI:10.4103/0971-6203.170792 |
 2019, Vol. 39
2019, Vol. 39


