胰腺癌是常见的消化道恶性肿瘤,其发病率呈逐年上升趋势,居我国恶性肿瘤第10位;胰腺癌经确诊后,5年存活率低于8%,是预后效果最差的恶性肿瘤之一[1-2]。在胰腺癌的临床治疗中,虽然手术切除提高了其总生存率,但术后感染及由于胰腺癌转移引起的术后复发较多;且晚期胰腺癌已无法经手术切除进行治疗,此时,放射治疗成为备受关注的治疗手段[3-4]。然而,患者在治疗过程中出现的放射敏感性降低影响了放疗效果,故提高胰腺癌放射敏感性是改善胰腺癌治疗现状的重要问题。
长链非编码RNA(long non-coding RNA,lncRNA)为超过200个核苷酸序列组成的非编码RNA[5]。研究表明,LncRNA可作为一种竞争性的内源性RNA,与非编码miRNA交互作用,共同参与靶向基因的调控,对肿瘤的发生与发展过程产生重要影响[6]。多项研究表明,lncRNA能够调控肿瘤细胞增殖、凋亡及耐药性和放射敏感性[7-9]。结肠癌相关转录因子1(colon cancer associated transeript1, CCAT1)是近年新发现的一种lncRNA,其在胃癌、肺癌等多种肿瘤组织中高表达,参与肿瘤的发生发展[10],但在肿瘤放射敏感性方面的研究较少。目前,关于CCAT1及其下游靶miRNA对胰腺癌放射敏感性的研究尚未报道,本研究通过检测胰腺癌组织及其细胞系中CCAT1表达,射线照射后沉默CCAT1表达对PANC-1细胞凋亡及Caspase 3活性的影响,探讨CCAT1对胰腺癌放射敏感性的作用及其潜在机制。
材料与方法1.细胞来源:收集2014年7月至2017年8月就诊于本院并确诊为胰腺癌的患者56例。参考RSI模型[11], 设置放射抗性组和放射敏感组。放射抗性组为原发肿瘤或发生转移不完全消退>3个月的患者及放射治疗后12个月内原发病灶或转移病灶两者均有局部复发的患者;放射敏感组为3个月内或局部复发性疾病结束放疗后12个月内未出现局部残留病变的患者。两组患者均于放疗后行手术切除,其中,放射敏感组32例,放射抵抗组24例。
hTERT-HPNE正常人胰腺导管上皮细胞和BxPC-3、AsPC-1、PANC-1人胰腺癌细胞系均购自中国科学院上海细胞库。
2.主要试剂及仪器:RPMI 1640培养基、胎牛血清、胰蛋白酶购自美国Hyclone公司;细胞培养箱购自美国Thermo公司;实时荧光定量PCR仪购自美国Life Technologies公司;Precise Clinac EX Primus直线加速器购自瑞典Elekta公司;Nanodrop ND-2000超微量核酸蛋白测定仪购自上海创萌生物科技有限公司;TRIzol总RNA提取试剂盒、Lipofectamine 2000转染试剂购自美国Invitrogen公司;Annexin V-FITC/PI细胞凋亡检测试剂盒购自上海翊圣生物科技有限公司;Caspase 3活性检测试剂盒购自上海纪宁实业有限公司;荧光酶标仪购自上海艾研生物科技有限公司;RNA结合蛋白免疫沉淀实验检测试剂盒(RNA-binding protein immunoprecipitation kit)购自广州赛诚生物科技有限公司;CCAT1野生型及突变型载体购自北京本元正阳基因有限公司;所用引物由华大基因合成。
3.细胞培养与照射:hTERT-HPNE正常人胰腺导管上皮细胞和BxPC-3、AsPC-1、PANC-1人胰腺癌细胞系使用含5%胎牛血清的RPMI 1640培养液于5% CO2、37℃条件下培养,每隔3天传代1次。待PANC-1细胞生长至汇合度约85%,加入适量胰酶消化并重悬细胞,以3×105/孔接种于96孔培养板,常规培养12 h。使用Siemens Primus直线加速器6 MV X射线室温照射,吸收剂量率为3 Gy/min,以0、2、4、6、8 Gy垂直照射,射野10 cm×10 cm,源靶距30 cm,在照射后0、12、24、48 h分别检测细胞的存活分数。
4.细胞转染与分组:将PANC-1细胞以适量密度接种于6孔板,常规培养24 h,按照Lipofectamine 2000转染试剂说明书转染,将PANC-1细胞随机分为空白对照组(未作任何处理),阴性对照组(转染si-RNA),si-CCAT1-1(转染25 nmol/L量的si-CCAT1-1)、si-CCAT1-2组(转染50 nmol/L量的si-CCAT1-2),过表达对照组(转染pcDNA),过表达CCAT1组(转染pcDNA-CCAT1),抑制miR-NC组(转染miR-NC),抑制miR-130b-3p组(转染miR-130b-3p-inhibitor),沉默CCAT1+抑制miR-NC组(共转染si-CCAT1-2和miR-NC),沉默CCAT1+抑制miR-130b-3p组(共转染si-CCAT1-2和miR-130b-3p-inhibitor);其中,阴性对照组、沉默CCAT1-2组、沉默CCAT1-2+抑制miR-NC组、沉默CCAT1-2+抑制miR-130b-3p组的部分PANC-1细胞,经2 Gy照射后培养48 h。
5. Real-time PCR检测CCAT1和miR-130b-3p表达:适量组织或细胞充分研磨,TRIzol法提取总RNA,使用Nanodrop ND-2000超微量核酸蛋白测定仪检测RNA浓度和纯度。调整RNA样品浓度,按照反转录试剂盒(日本TaKaRa公司)说明书,将RNA反转录为cDNA,使用实时荧光定量试剂盒(日本TaKaRa公司)配制反应体系,进行PCR扩增。以GAPDH为内参,2-△△Ct法分析相对表达量,每个RNA样品重复3次,所用引物及序列见表 1。
|
|
表 1 各种序列、载体的基本信息以及来源 Table 1 Basic information and sources of various sequences and vectors |
6.克隆形成实验:将转染后的PANC-1细胞分别以0、2、4、6、8 Gy照射后培养48 h,更换新鲜培养液,继续培养至肉眼可见克隆形成,吸除培养液。磷酸盐缓冲液(PBS)洗涤后加入适量甲醇固定20 min,0.2%结晶紫染色10 min,计数≥50个细胞的克隆数。克隆形成率(%)=(克隆数/接种细胞数)×100%;细胞存活分数(SF2)=实验组克隆形成率/对照组克隆形成率;放射增敏比=沉默前细胞存活分数/沉默后细胞存活分数。使用GraphPad Prism 7软件进行单击多靶模型曲线拟合,计算准阈剂量(Dq)、平均致死剂量(D0)、存活分数(SF2)、放射增敏比(SER)。
7.细胞凋亡及Caspase 3活性检测:收集转染后2 Gy照射或未照射的各组PANC-1细胞,PBS洗涤并重悬细胞,加入5 μl Annexin V-FITC和10 μl PI溶液混匀,避光孵育15 min,立即用流式细胞检测。在各组PANC-1细胞中加入蛋白裂解液提取总蛋白,按照Caspase 3活性检测试剂盒加入适量Ac-DEVD-pNA,37℃避光反应2 h,荧光酶标仪检测400 nm处荧光度值。
8.生物信息学分析:通过starBase v2.0在线预测网站预测CCAT1与miR-130b-3p是否存在靶向结合位点。
9.双荧光素酶报告基因检测实验分析:取PANC-1细胞,按照Lipofectamine 2000转染试剂说明书分别将CCAT1-3′UTR野生型质粒和mimics NC或miR-130b-3p mimics共转染,将CCAT1-3′UTR突变型质粒和mimics NC或miR-130b-3p mimics共转染,培养48 h后加入裂解液裂解。4℃,12 000 r/min,离心直径420 mm,离心10 min,取上清,检测荧光素酶活性。
10. RNA结合蛋白免疫沉淀实验(RIP):收集2×107个PANC-1细胞,加入等体积的RIP裂解液裂解细胞,离心12 000 r/min,离心直径420 mm,离心10 min,取上清。按照RIPTM RNA结合蛋白免疫沉淀反应试剂盒使用说明书,在含磁珠的EP管中加入900 μl RIP免疫沉淀缓冲液(含RNase抑制剂、蛋白酶抑制剂、DNase)和100 μl细胞裂解液,加入IgG抗体或Ago2抗体,4℃孵育过夜,离心12 000 r/min,离心直径420 mm,离心10 min,弃上清,500 μl RIP Wash Buffer洗涤6次后立即进行RNA纯化,15 μl DEPC水溶解纯化RNA,-80℃保存。未加抗体的为阳性对照(Input)组,加入IgG抗体的为阴性对照(anti-IgG)组,加入Ago2抗体的为实验(anti-Ago2)组。
11.统计学处理:使用GraphPad Prism 7和SPSS 22.0统计软件进行数据分析。实验数据符合正态分布,以x±s表示。多组间数据比较经方差齐性检验,采用单因素方差分析,组间两两比较采用SNK-q检验,两组间比较采用独立样本t检验。P < 0.05为差异具有统计学意义。
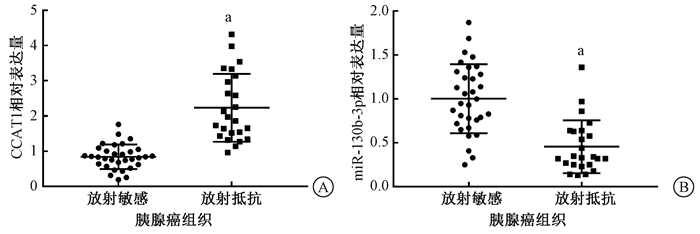
结果1.放射抵抗的胰腺癌组织中CCAT1与miR-130b-3p的表达:对比放射敏感的胰腺癌组织,放射抵抗的胰腺癌组织中CCAT1表达显著上调(t=6.748,P < 0.05),miR-130b-3p表达显著下调(t=5.898,P < 0.05),见图 1。
|
注:aCCAT1与miR-130b-3p在两种组织中比较,t=6.748、5.898,P < 0.05 图 1 CCAT1(A)和miR-130b-3p(B)在放射敏感和放射抵抗的胰腺癌组织中的表达 Figure 1 Expression of CCAT1 (A) and miR-130b-3p (B) in radiation-sensitive and radiation-resistant pancreatic cancer tissues |
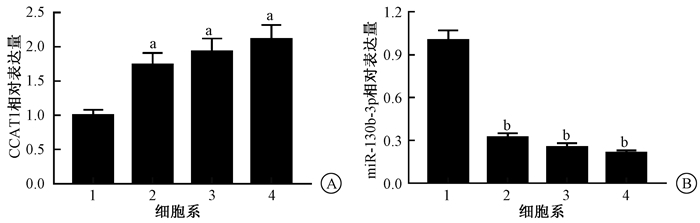
2.不同胰腺癌细胞系中CCAT1与miR-130b-3p的表达:结果示于图 4。由图 4可见,与hTERT-HPNE人胰腺导管细胞相比,人胰腺癌细胞系BxPC-3、AsPC-1、PANC-1细胞中CCAT1表达上调(t=6.822、7.814、8.555,P < 0.05),PANC-1细胞中CCAT1相对表达水平最高,miR-130b-3p表达下调(t=15.465、17.057、18.795,P < 0.05),PANC-1细胞中miR-130b-3p相对表达水平最低,见图 2。

|
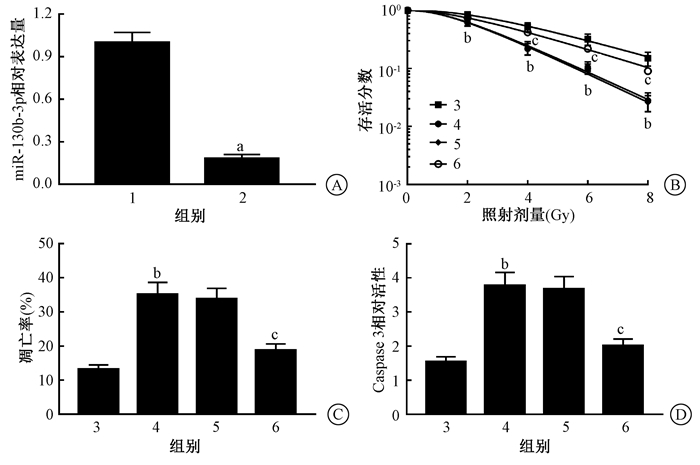
注:1.阴性对照组;2.沉默CCAT1-1组;3.沉默CCAT1-2组;4.阴性对照+照射组;5.沉默CCAT1-2+照射组。a与阴性对照组比较,t=15.465、18.082、2.929、5.047、5.234、5.125、13.033、10.440、14.578、6.561、5.233、11.775,P < 0.05;b与阴性对照+照射组比较,t=9.704、8.661,P < 0.05 图 4 沉默CCAT1增加PANC-1细胞的放射敏感性 A.沉默CCAT1后PANC-1细胞中CCAT1的表达;B.不同剂量照射后PANC-1细胞存活曲线;C.照射沉默CCAT1后PANC-1细胞的凋亡率;D.照射沉默CCAT1后PANC-1细胞中Caspase 3的活性 Figure 4 Silencing CCAT1 increases radiosensitivity of PANC-1 cells A. CCAT1 expression in PANC-1 cells after silencing CCAT1; B. PANC-1 cell survival curve after different doses of irradiation; C. Irradiation-induced apoptosis of PANC-1 cells after silencing CCAT1; D. Irradiation-induced activity of caspase 3 in PANC-1 cells after silencing CCAT1 |
|
注:1.hTERT-HPNE; 2.BxPC-3;3.AsPC-1;4.PANC-1。与hTERT-HPNE细胞比较,at=6.822、7.814、8.555,P < 0.05;bt=15.465、17.057、18.795,P < 0.05 图 2 CCAT1(A)和miR-130b-3p(B)在不同胰腺癌细胞系中的相对表达水平 Figure 2 Relative expression levels of CCAT1 (A) and miR-130b-3p (B) in different pancreatic cancer cell lines |
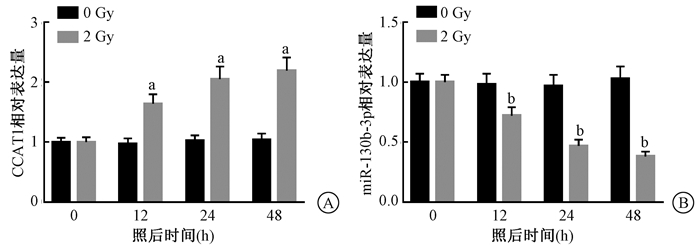
3.照射PANC-1细胞后CCAT1表达上调miR-130b-3p表达下调:分别检测照射后0、12、24、48 h PANC-1细胞CCAT1和miR-130b-3p相对表达水平,发现与0 Gy比较,2 Gy照射后CCAT1表达上调(t=6.322、7.808、8.242,P < 0.05),miR-130b-3p表达下调(t=3.950、8.412、10.453,P < 0.05),且均呈时间依赖性,见图 3。
|
注:与0 Gy比较,at=6.322、7.808、8.242,P < 0.05;bt=3.950、8.412、10.453,P < 0.05 图 3 X射线照射后不同时间CCAT1(A)和miR-130b-3p(B)的表达 Figure 3 Expression of CCAT1 (A) and miR-130b-3p (B) at different times after X-ray irradiation |
4.沉默CCAT1表达可增加PANC-1细胞放射敏感性:对比Scrambled组,转染si-CCAT1-1和si-CCAT1-2的PANC-1细胞中CCAT1表达下调(t=15.465、18.082,P < 0.05),且si-CCAT1-2组低于si-CCAT1-1组,因此,选取si-CCAT1-2进行后续实验。以不同剂量(0、2、4、6、8 Gy)照射转染Scrambled siRNA和si-CCAT1-2的PANC-1细胞,细胞存活分数减小,呈剂量依赖性,且si-CCAT1-2组低于Scrambled组(t=2.929、5.047、5.234、5.125,P < 0.05)。2 Gy照射PANC-1细胞48 h后,细胞凋亡率增加(t=9.704,P < 0.05),细胞中Caspase 3活性升高(t=8.661,P < 0.05)。
单击多靶模型参数列于表 2,沉默CCAT1表达可增强PANC-1细胞放射敏感性。
|
|
表 2 PANC-1细胞辐射敏感性相关参数 Table 2 Radiation sensitivity related parameters of PANC-1 cell survival curves |
5. CCAT1可负调控miR-130b-3p表达:结果示于图 5。由图 5可见,starBase v2.0在线预测结果显示,CCAT1与miR-130b-3p存在结合位点。对比miR-NC组,转染miR-130b-3p模拟物的CCTA1-WT载体荧光酶活性降低(t=9.665, P < 0.05),而CCTA1-Mut载体荧光酶活性无明显变化。RIP实验结果如图 5C所示,对比anti-lgG组,anti-Ago2组和Input组都有CCAT1和miR-130b-3p富集(t=25.843, P < 0.05),且Input组高于anti-Ago2组(t=29.390, P < 0.05)。进一步检测CCAT1与miR-130b-3p表达的相关性,发现沉默CCAT1,miR-130b-3p表达上调(t=9.393, P < 0.05),过表达CCAT1,则miR-130b-3p表达下调(t=9.649, P < 0.05),CCAT1可负调控miR-130b-3p表达。

|
注:1.空白对照组;2.阴性对照组;3.沉默CCAT1-2组;4.过表达对照组;5.过表达CCAT1组。a与过表达miR-NC组比较,t=9.665,P < 0.05;b与抗IgG组比较,t=25.843、29.390,P < 0.05;c与阴性对照组比较,t=9.393,P < 0.05;d与过表达对照组比较,t=9.649,P < 0.05 图 5 CCAT1可负调控miR-130b-3p表达 A.互补序列;B.双荧光素酶报告基因检测实验结果;C.RIP实验结果;D.CCAT1对PANC-1细胞中miR-130b-3p表达的影响 Figure 5 CCAT1 can negatively regulate miR-130b-3p expression A. Complementary sequence; B. Double luciferase reporter gene test; C. RIP test; D. Effect of CCAT1 on the expression of miR-130b-3p in PANC-1 cells |
6. CCAT1通过miR-130b-3p调控胰腺癌细胞的放射敏感性:结果示于图 6。由图 6可见,转染miR-130b-3p抑制剂,miR-130b-3p-inhibitor组中miR-130b-3p表达低于miR-NC-inhibitor组(t=18.649, P < 0.05)。MTT法检测细胞存活率,发现不同剂量(0、2、4、6、8 Gy)照射PANC-1细胞,各组细胞存活率剂量依赖性降低(t=2.929、5.047、5.234、5.125, P < 0.05);对比Scrambled组,si-CCAT1-2+miR-130b-3p-inhibitor组细胞存活率无明显变化(P>0.05),而si-CCAT1-2组和si-CCAT1-2+miR-NC-inhibitor组细胞存活率显著减小(t=6.953, P < 0.05)。2 Gy照射48后,各组细胞凋亡率较未照射的Scrambled组升高,Caspase 3活性升高;而照射的各组细胞中,沉默CCAT1表达后细胞凋亡率和Caspase 3活性高于Scrambled组(t=10.132、9.497, P < 0.05),沉默CCAT1表达并抑制miR-130b-3p表达则细胞凋亡率和Caspase 3活性降低(t=6.953、6.836, P < 0.05)(图 6C、6D)。
|
注:1.抑制miR-NC组;2.抑制miR-130b-3p组;3.阴性对照组;4.沉默CCAT1-2组;5.沉默CCAT1-2+抑制miR-NC组;6.沉默CCAT1-2+抑制miR-130b-3p组。a与抑制miR-NC组比较,t=18.649,P < 0.05;b与阴性对照组比较,t=2.929、5.047、5.234、5.125、10.132、9.497,P < 0.05;c与沉默CCAT1-2+抑制miR-NC组比较,t=4.564、6.736、8.656、6.953、6.836,P < 0.05 图 6 CCAT1调控miR-130b-3p影响胰腺癌细胞的放射敏感性 A.抑制miR-130b-3p后PANC-1细胞中miR-130b-3p的表达;B.抑制miR-130b-3p照射后PANC-1细胞存活曲线;C.抑制miR-130b-3p 2 Gy X射线照射后PANC-1细胞的凋亡率;D.抑制miR-130b-3p 2 Gy X射线照射后PANC-1细胞中Caspase 3的活性 Figure 6 CCAT1 regulates the radiosensitivity of miR-130b-3p in pancreatic cancer cells A. Expression of miR-130b-3p in PANC-1 cells after miR-130b-3p silence; B. Cell survival curve of PANC-1 cells after miR-130b-3p silence; C. Radiation-induced apoptosis of PANC-1 cells after miR- 130b-3p; D. Radiation-induced activity of Caspase 3 in PANC-1 cells after miR-130b-3p |
讨论
放射治疗是胰腺癌重要的治疗手段,能明显缓解患者的病痛,对于局部晚期胰腺癌患者尤其重要,可大大增加其生存率[12]。放射敏感性是胰腺癌放疗中的限制性因素,增加胰腺癌放射敏感性能有效改善其放疗效果,对胰腺癌的临床治疗具有重要意义。lncRNA发现之初被认为无生物学功能,随着学者的不断研究,发现lncRNA广泛参与细胞周期、细胞迁移、机体胁迫应答及肿瘤发生发展等十分重要的生理过程[13]。已有多项研究表明,lncRNA与肿瘤细胞放射敏感性有关,可用于肿瘤的诊断及治疗[14-15]。
CCAT1在结肠癌中首次被发现,其表达显著高于正常癌旁组织,过表达CCAT1可促进结肠癌细胞增殖和侵袭,诱导结肠癌的发生和转移[16-17]。在咽喉鳞状细胞癌组织中,CCAT1过表达可诱导N-钙黏蛋白和波形蛋白表达并抑制E-钙粘蛋白表达,促进癌细胞增殖和迁移,有助于咽喉鳞状细胞癌浸润和转移[18]。在肿瘤放射敏感性的研究中,已有研究表明,CCAT1可负调控miR-148b表达降低乳腺癌细胞存活率和Caspase 3活性,提高乳腺癌细胞的放射敏感性[19];下调CCAT1表达能够抑制宫颈癌细胞增殖,增强肿瘤放射敏感性[20]。但CCAT1在胰腺癌放射敏感性中的作用及其潜在机制,尚少见文献报道。本研究检测了放射敏感和放射抵抗的胰腺癌组织中CCAT1表达,结果显示,CCAT1在放射抵抗的胰腺癌组织中表达显著上调;对比人胰腺导管细胞,CCAT1在人胰腺癌细胞系中表达上调。为进一步研究CCAT1与PANC-1人胰腺癌细胞放射敏感性的关系,以2 Gy照射PANC-1细胞后培养分别培养0、12、24、48 h并检测CCAT1在其中的相对表达水平,发现CCAT1的表达呈时间依赖性上调。以PANC-1细胞为研究对象,沉默CCAT1表达并给予2 Gy辐射照射后,细胞凋亡率增加,Caspase 3活性增强;单击多靶模型参数显示SER放射增敏比为1.641,表明沉默CCAT1表达可增强PANC-1细胞放射敏感性。
微小RNA(microRNA,miRNA)能够与靶mRNA互补结合,调控靶基因表达,参与细胞凋亡、分化、个体发育等生物过程[21],并且与肿瘤放射敏感性密切相关。多项研究表明,miRNA可通过调节下游靶基因影响肿瘤放射敏感性[22-24]。miR-130b-3p是miR-130家族的一员,在膀胱癌组织中高表达,可通过抑制PI3K-AKT和整合素β1/ FAK信号通路,抑制癌细胞增殖、迁移和侵袭,并诱导凋亡,对膀胱癌的发生发展有抑制作用[25];在乳腺癌中,miR-130b-3p可靶向调节Notch配体Delta-like 1,从而抑制癌细胞迁移和侵袭,是人乳腺癌转移的潜在靶标[26]。然而,关于miR-130b-3p对肿瘤放射敏感性的影响及其在胰腺癌中的作用,目前仍未报道。本研究通过starBase v2.0在线预测,发现miR-130b-3p 3′-UTR上存在CCAT1的结合位点,采用荧光素酶报告基因及RIP实验进一步验证,表明CCAT1可负调控miR-130b-3p表达。Real-time PCR实验结果显示,miR-130b-3p在放射抵抗胰腺癌组织及胰腺癌细胞系中表达下调;抑制miR-130b-3p可逆转下调CCAT1促进PANC-1细胞凋亡、增强Caspase 3活性及细胞放射敏感性的作用。
基于以上报道及本文研究,表明沉默CCAT1能够促进miR-130b-3p表达,促进PANC-1人胰腺癌细胞凋亡,降低细胞存活分数,增强Caspase 3活性,从而使PANC-1人胰腺癌细胞放射敏感性提高。以上研究结果可能为胰腺癌的放射治疗提供新靶点。
利益冲突 无作者贡献声明 宋锐撰写论文;袁金金负责数据分析;杨军、柴婷负责实验操作;陈晓娟、刘宗文负责实验设计;侯歌、王成提供研究所用新试剂及分析工具
| [1] |
Chen WQ, Zheng RS, Zhang SW, et al. Cancer incidence and mortality in China in 2013:an analysis based on urbanization level[J]. Chin J Cancer Res, 2017, 29(1): 1-10. DOI:10.1016/j.canlet.2017.04.018 |
| [2] |
Falconi M, Tamburrino D, Buzzetti E, et al. Pancreatic cancer[J]. Recenti Prog Med, 2016, 107(6): 337-340. DOI:10.1056/NEJMra0901557 |
| [3] |
Hackert T, Sachsenmaier M, Hinz U, et al. Locally advanced pancreatic cancer:neoadjuvant therapy with folfirinox results in resectability in 60% of the patients[J]. Ann Surg, 2016, 264(3): 457-463. DOI:10.1097/SLA.0000000000001850 |
| [4] |
Verma V, Li J, Lin C. Neoadjuvant therapy for pancreatic cancer:systematic review of postoperative morbidity, mortality, and complications[J]. Am J Clin Oncol, 2016, 39(3): 302-313. DOI:10.1097/COC.0000000000000278 |
| [5] |
Dhamija S, Diederichs S. From junk to master regulators of invasion:lncRNA functions in migration, EMT and metastasis[J]. Int J Cancer, 2016, 139(2): 269-280. DOI:10.1002/ijc.30039 |
| [6] |
Militello G, Weirick T, John D, et al. Screening and validation of lncRNAs and circRNAs as miRNA sponges[J]. Brief Bioinform, 2017, 18(5): 780-788. DOI:10.1093/bib/bbw053 |
| [7] |
Gong WJ, Yin JY, Li XP, et al. Association of well-characterized lung cancer lncRNA polymorphisms with lung cancer susceptibility and platinum-based chemotherapy response[J]. Tumour Biol, 2016, 37(6): 8349-8358. DOI:10.1007/s13277-015-4497-5 |
| [8] |
Xia H, Chen Q, Chen Y, et al. The lncRNA MALAT1 is a novel biomarker for gastric cancer metastasis[J]. Oncotarget, 2016, 7(35): 56209-56218. DOI:10.18632/oncotarget.10941 |
| [9] |
Hu X, Jiang H, Jiang X. Downregulation of lncRNA ANRIL inhibits proliferation, induces apoptosis, and enhances radiosensitivity in nasopharyngeal carcinoma cells through regulating miR-125a[J]. Cancer Biol Ther, 2017, 18(5): 331-338. DOI:10.1080/15384047.2017.1310348 |
| [10] |
Guo X, Hua Y. CCAT1:an oncogenic long noncoding RNA in human cancers[J]. J Cancer Res Clin Oncol, 2017, 143(4): 555-562. DOI:10.1007/s00432-016-2268-3 |
| [11] |
Eschrich SA, Pramana J, Zhang H, et al. A gene expression model of intrinsic tumor radiosensitivity:prediction of response and prognosis after chemoradiation[J]. Int J Radiat Oncol Biol Phys, 2009, 75(2): 489-496. DOI:10.1016/j.ijrobp.2009.06.014 |
| [12] |
王希海, 赵相轩, 卢再鸣, 等. 放射治疗局部进展胰腺癌的研究进展[J]. 临床肝胆病杂志, 2017, 33(11): 2251-2255. Wang XH, Zhao XX, Lu ZM, et al. Research advances in radiotherapy for locally advanced pancreatic cancer[J]. J Clin Hepatol, 2017, 33(11): 2251-2255. DOI:10.3969/j.issn.1001-5256.2017.11.045 |
| [13] |
Perron U, Provero P, Molineris I. In silico prediction of lncRNA function using tissue specific and evolutionary conserved expression[J]. BMC Bioinformatics, 2017, 18(Suppl 5): 144. DOI:10.1186/s12859-017-1535-x |
| [14] |
Xue Y, Ni T, Jiang Y, et al. Long noncoding RNA GAS5 inhibits tumorigenesis and enhances radiosensitivity by suppressing miR-135b expression in non-small cell lung cancer[J]. Oncol Res, 2017, 25(8): 1305-1316. DOI:10.3727/096504017X14850182723737 |
| [15] |
Wu D, Li Y, Zhang H, et al. Knockdown of Lncrna PVT1 enhances radiosensitivity in non-small cell lung cancer by sponging mir-195[J]. Cell Physiol Biochem, 2017, 42(6): 2453-2466. DOI:10.1159/000480209 |
| [16] |
Ye ZY, Zhou M, Tian B, et al. Expression of lncRNA-CCAT1, E-cadherin and N-cadherin in colorectal cancer and its clinical significance[J]. Int J Clin Exp Med, 2015, 8(3): 3707-3715. DOI:10.1214/10-AOP569 |
| [17] |
He X, Tan X, Wang X, et al. C-Myc-activated long noncoding RNA CCAT1 promotes colon cancer cell proliferation and invasion[J]. Tumour Biol, 2014, 35(12): 12181-12188. DOI:10.1007/s13277-014-2526-4 |
| [18] |
Zhuang K, Wu Q, Jiang S, et al. CCAT1 promotes laryngeal squamous cell carcinoma cell proliferation and invasion[J]. Am J Transl Res, 2016, 8(10): 4338-4345. |
| [19] |
Lai Y, Chen Y, Lin Y, et al. Down-regulation of LncRNA CCAT1 enhances radiosensitivity via regulating miR-148b in breast cancer[J]. Cell Biol Int, 2018, 42(2): 227-236. DOI:10.1002/cbin.10890 |
| [20] |
高金苹, 张绍菊, 罗志红, 等. 长链非编码RNA CCAT1对人宫颈癌XB1702细胞裸鼠移植瘤放射敏感性的影响[J]. 中国医药生物技术, 2017, 12(1): 40-44. Gao JP, Zhang SJ, Luo ZH, et al. Impact of long non-coding RNA CCAT1 on the tumor sensitivity to radiotherapy in nude mice transplanted with human cervical cancer cells XB1702[J]. Chin Med Biothech, 2017, 12(1): 40-44. DOI:10.3969/cmba.j.issn.1673-713X.2017.01.008 |
| [21] |
Rupaimoole R, Calin GA, Lopez-Berestein G, et al. miRNA deregulation in cancer cells and the tumor microenvironment[J]. Cancer Discov, 2016, 6(3): 235-246. DOI:10.1158/2159-8290.CD-15-0893 |
| [22] |
Gu H, Liu M, Ding C, et al. Hypoxia-responsive miR-124 and miR-144 reduce hypoxia-induced autophagy and enhance radiosensitivity of prostate cancer cells via suppressing PIM1[J]. Cancer Med, 2016, 5(6): 1174-1182. DOI:10.1002/cam4.664 |
| [23] |
Song L, Liu S, Zhang L, et al. MiR-21 modulates radiosensitivity of cervical cancer through inhibiting autophagy via the PTEN/Akt/HIF-1α feedback loop and the Akt-mTOR signaling pathway[J]. Tumour Biol, 2016, 37(9): 12161-12168. DOI:10.1007/s13277-016-5073-3 |
| [24] |
Zheng L, Chen J, Zhou Z, et al. miR-195 enhances the radiosensitivity of colorectal cancer cells by suppressing CARM1[J]. Onco Targets Ther, 2017, 10: 1027-1038. DOI:10.2147/OTT.S125067 |
| [25] |
吕梦欣, 陈俊霞. 抑制miR-130b-3p通过上调PTEN和灭活PI3K-AKT及整合素β1/FAK信号通路抑制膀胱癌细胞增殖[J]. 中国生物化学与分子生物学报, 2017, 33(2): 150-159. Lv MX, Chen JX. Inhibition of miR-130b-3p suppresses proliferation of bladder cancer through up-regulating PTEN and inactivating PI3K-AKT and integrin β1/FAK signals[J]. Chin J Biochem Mol Biol, 2017, 33(2): 150-159. DOI:10.13865/j.cnki.cjbmb.2017.02.08 |
| [26] |
Shui Y, Yu X, Duan R, et al. miR-130b-3p inhibits cell invasion and migration by targeting the Notch ligand Delta-like 1 in breast carcinoma[J]. Gene, 2017, 609: 80-87. DOI:10.1016/j.gene.2017.01.036 |
 2019, Vol. 39
2019, Vol. 39


