颅脑放疗是治疗各种中枢神经系统恶性肿瘤的有效方法之一。放疗提高了患者的生存期,但部分患者在全脑放疗后出现放射性认知功能障碍[1]。海马神经发生抑制是放射性认知功能障碍发生的重要原因。电离辐射不仅抑制新生神经元的产生,而且会改变海马内微环境。海马内微环境在支持海马内神经发生中起重要作用。其中,神经营养因子及小胶质细胞是海马内微环境的重要组成部分。进行海马内神经干细胞移植,有望改善放射性认知功能障碍的症状。但是其能否改善海马内神经营养因子水平及小胶质细胞活化情况,仍不清楚。
脑源性神经营养因子(BDNF)在海马齿状回颗粒层神经元细胞分布明显多于大脑其他部位神经元,对神经元的存活、分化、迁移、新生神经元轴突树突的发育以及突触形成都起着重要作用[2]。本研究选用绿色荧光蛋白(GFP)-BDNF-慢病毒感染标记神经干细胞,探讨过表达BDNF的神经干细胞(NSCs)移植入放射性脑损伤的大鼠海马后对海马内神经营养因子水平及小胶质细胞活化情况的影响。
材料与方法1.主要试剂及仪器:DMEM/F12、B27、Accutase酶(美国GIBCO公司),碱性成纤维细胞生长因子(bFGF, 20 ng/ml,美国R & D Systems公司),表皮生长因子(EGF, 20 ng/ml,美国Sigma公司),兔抗BDNF、兔抗胶质源性神经营养因子(GDNF)、兔抗神经生长因子(NGF)、兔抗CD-68和小鼠抗Nestin(英国Abcam公司),GFP-慢病毒、GFP-BDNF-慢病毒(武汉枢密脑科学技术有限公司),医用直线加速器(瑞典医科达公司),脑立体定位仪(深圳瑞沃德公司),激光共聚焦扫描显微镜(德国Leica公司,TCS-SP2型)。
2.实验动物与细胞:48只1月龄SPF级健康雄性SD大鼠,体重(100±10) g(苏州大学动物实验中心), 合格证号:No.201613197。按照随机数表法,分为4组:健康对照组、单纯照射组(R组)、照射后GFP修饰的神经干细胞移植组(R+NSCs组)、照射后GFP-BDNF修饰的神经干细胞移植组(R+BDNF-NSCs组),每组12只。1只孕15 d SPF级SD大鼠(苏州大学动物实验中心)。从胎鼠(E15)脑中分离海马神经干细胞进行培养。实验动物操作均经苏州大学实验动物伦理委员会通过。
3.照射条件:大鼠经3.6%水合氯醛溶液(360 mg/kg)腹腔注射麻醉后俯卧摆位于照射区域内,用医用直线加速器4 MeV电子线单次全脑20 Gy照射。射野面积为2 cm×2.5 cm,剂量率为210~220 cGy/min,源皮距为100 cm。照射野前界为双眼后眦连线,后界为双耳后连线。并用铅块遮住大鼠身体的其他部位。健康对照组大鼠相同照射环境下0 Gy照射。
4.原代神经干细胞分离培养:无菌条件下切开孕鼠腹部取出子宫置于冷的磷酸盐缓冲液(PBS)中,剥离胎鼠脑膜并钳取大脑皮质和皮质下组织,充分剪碎组织,放入冰的PBS中漂洗去除血液。加入Accutase消化8 min并反复吹打混匀。用一次性40 μmol/L细胞筛过滤,制成单细胞悬液。离心半径12 cm, 800 r/min,离心3 min。收集单细胞悬液,去上清加入神经干细胞完全培养基,混匀计数。按10×105/ml接种到一次性培养瓶中,放入37℃、5%CO2培养箱中,每天观察细胞生长情况。
5. GFP-慢病毒和GFP-BDNF-慢病毒感染神经干细胞:将传代至第4代细胞悬液转移至离心管中,离心半径12 cm,1 000 r/min,离心3 min,去上清。加入Accutase消化为单细胞悬液。收集单细胞,按10×105/ml接种到一次性培养瓶中。2 h后,将含有细胞的培养液移入离心管中,根据病毒的滴度,分别加入相应体积的GFP-慢病毒和GFP-BDNF-慢病毒。离心半径12 cm,600 r/min,离心1 h后,将细胞轻轻吹打均匀后放入培养瓶中继续培养。观察细胞状态,24 h后进行换液。
6.神经干细胞移植:移植前离心收集第6代GFP-慢病毒感染标记的神经干细胞和GFP-BDNF-慢病毒感染标记的神经干细胞。将细胞浓缩成1×105/μl,置于冰上保存。用3.6%水合氯醛腹腔注射麻醉(360 mg/kg)。将麻醉好的大鼠固定在立体定位仪上,消毒后沿中线切开皮肤,清理颅骨表面。按照坐标(前囟点向后3.5 mm,旁开2.5 mm,深度3.6 mm)向双侧海马内分别注射细胞浓缩液2 μl,注射速率1.2 μl/min,注射完毕后留置微量进样器5 min。待大鼠麻醉清醒后,分笼饲养,给予充足的水和饲料。每个实验组动物分别于移植后的2和8周取脑,用于免疫荧光染色和Western blot蛋白检测。
7.免疫荧光染色:在移植后的2和8周,各个实验组每个时间点随机数表法取4只大鼠。用3.6%水合氯醛腹腔麻醉大鼠。先用PBS灌注,后用4%多聚甲醛固定。断头取脑,先放入4%的多聚甲醛溶液中固定24 h。再依次放入15%、30%蔗糖溶液中进行梯度脱水。脱水完成后冷冻,切片。厚度为40 μm。每6张连续的脑片中选取1张进行免疫荧光染色。PBS漂洗5 min×3次。TritonX-100孵育20 min。10%胎牛血清中室温封闭2 h。一抗4℃孵育24 h。兔抗CD-68 1 :200。一抗孵育完后,PBS漂洗3次×5 min。加二抗孵育1 h(Alexa Fluor 568驴抗兔1 :400),PBS漂洗5 min×3次,贴片观察。激光共聚焦扫描显微镜采集免疫荧光照片,Image J软件对目标阳性细胞进行计数。
8. Western blot检测:在移植后的2、8周,各个实验组每个时间点随机取4只大鼠。用3.6%水合氯醛腹腔麻醉大鼠,待其麻醉后直接断头。在冰上取海马组织。提取细胞总蛋白。聚氰基丙烯酸正丁酯(BCA)法测定蛋白样品浓度。每个孔上样量为40 μg进行SDS-PAGE电泳后,300 mA恒流转膜90 min,5%脱脂奶粉封闭2 h。一抗4℃孵育过夜(BDNF 1 :5 000、GDNF 1 :2 000、NGF 1 :1 000),三(羟甲基)氨基甲烷-盐酸缓冲盐溶液(TBST)漂洗15 min×3次。二抗室温孵育1.5 h(抗兔1 :5 000)。TBST漂洗15 min×3次。滴加增强型化学发光(ECL)显影液。Image J软件对所得条带进行分析。
9.统计学处理:采用SPSS 20.0软件对数据进行分析。数据符合正态分布,以x±s表示。同一时间点内多组间比较,经方差齐性检验,采用单因素方差分析,组间的两两比较采用Bonferroni检验。P < 0.05为差异有统计学意义。
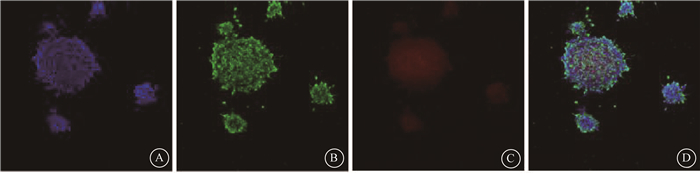
结果1.神经干细胞的鉴定:培养的神经干细胞在第3~4天时可观察到许多神经球悬浮于培养基中。将GFP-慢病毒和GFP-BDNF-慢病毒感染的神经干细胞进行巢蛋白细胞免疫荧光染色,荧光显微镜下见神经球呈Nestin免疫阳性(蓝色为阳性,图 1)。
|
图 1 神经干细胞进行Nestin免疫荧光染色鉴定 ×200 A. Nestin免疫荧光染色(蓝色);B. GFP免疫荧光染色(绿色);C. BDNF免疫荧光染色(红色);D. A、B、C融合图像 Figure 1 Images neural stem cells identified by Nestin immunofluorescence staining ×200 A. Nestin immunostaining image (blue); B. GFP immunostaining image (green); C. BDNF immunostaining image (red); D. Merge of A, B, C images |
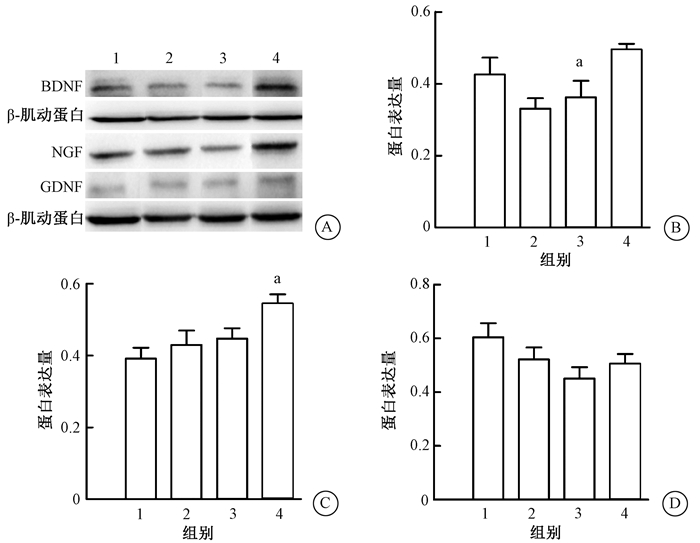
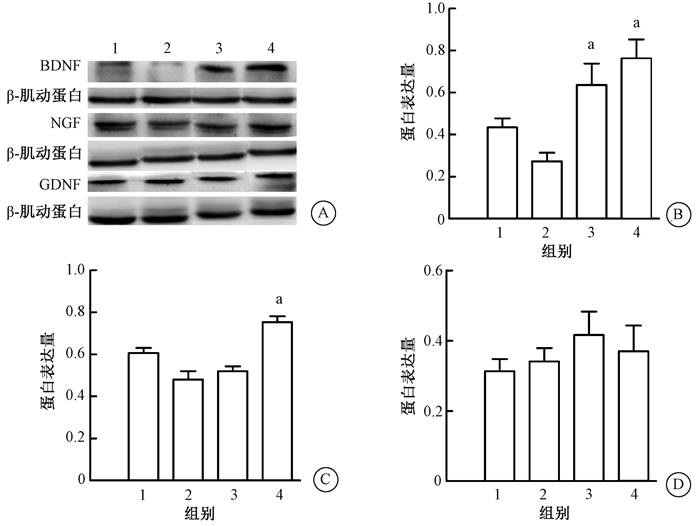
2.神经干细胞移植后BDNF、NGF、GDNF的蛋白表达情况:移植后2和8周用Western blot检测各组海马中相关神经营养因子蛋白表达情况发现,与R组相比,R+BDNF-NSCs组大鼠海马内BDNF蛋白和NGF蛋白水平明显增高(P < 0.05,图 2B、2C、3B、3C)。但GDNF蛋白水平变化不明显(P>0.05,图 2D、3D)。在移植后8周,与R组相比,R+NSCs组大鼠海马内BDNF蛋白水平明显增高(P < 0.05,图 3B)。
|
注:1.健康对照组;2.单纯照射(R)组;3. R+NSCs组;4.R+BDNF-NSCs组。BDNF、NGF 4组间比较,F=3.753、4.267,P < 0.05;a与R组比较,P < 0.05 图 2 移植后2周各组海马中BDNF、NGF、GDNF蛋白表达水平A.电泳条带;B. BDNF; C. NGF; D. GDNF Figure 2 Expression levels of BDNF, NGF and GDNF proteins in hippocampus at 2 weeks after transplantation A. Electrophoresis strip; B. BDNF; C. NGF; D. GDNF |
|
注:1.健康对照组;2.单纯照射(R)组;3. R+NSCs组;4.R+BDNF-NSCs组。BDNF、NGF 4组间比较,F=8.493、16.740,P < 0.001;a与R组比较,P < 0.01 图 3 移植后8周各组海马中BDNF、NGF、GDNF蛋白表达水平A.电泳条带;B. BDNF;C.NGF;D.GDNF Figure 3 Expression levels of BDNF, NGF and GDNF proteins in hippocampus at 8 weeks after transplantation A. Electrophoresis strip; B. BDNF; C. NGF; D. GDNF |
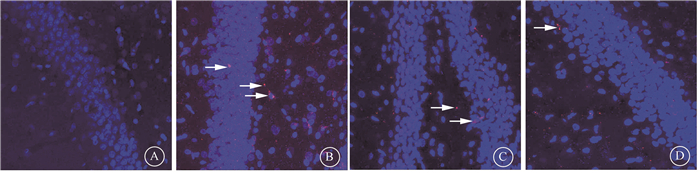
3.移植后大鼠海马中小胶质细胞的活化情况:移植8周用免疫荧光检测各组海马区小胶质细胞活化情况,R+NSCs组和R+BDNF-NSCs组活化的小胶质细胞数量与R组相比未减少(P>0.05,图 4)。
|
注:箭头所指为CD68标记活化的小胶质细胞;红色为CD68,蓝色为DPAI 图 4 移植后8周各组海马中小胶质细胞活化情况免疫荧光染色 ×200 A.健康对照组;B.单纯照射(R)组;C. R+NSCs组;D.R+BDNF-NSCs组 Figure 4 Activation of microglia in hippocampus of each group at 8 weeks after transplantation Immunostaining image ×200 A.Control group; B.R group; C.R+NSCs group; D.R+BDNF-NSCs group |
讨论
目前国内外的本领域研究人员认为,电离辐射诱导的海马神经发生是放射性认知功能障碍的重要发病机制[3]。其中神经营养因子和小胶质细胞活化是放射性认知功能障碍发病机制的重要内容。本研究围绕神经营养因子和小胶质细胞活化展开研究,发现过表达BDNF的神经干细胞移植后可以促进BDNF、NGF的产生,增加了受照后的海马神经营养因子水平,移植后2和8周,R+BDNF-NSCs组海马组织中BDNF、NGF蛋白表达水平较R组明显增高。
电离辐射同时造成海马内各类营养因子表达降低,小胶质细胞的活化以及各类炎症因子的释放[4-5]。在神经退行性疾病中,向帕金森病小鼠模型中移植神经干细胞可以提高脑内BDNF、NGF蛋白表达水平,同时减轻神经系统炎性反应[6]。本研究发现,过表达BDNF的神经干细胞移植后可以促进BDNF、NGF的产生,增加了受照后的海马神经营养因子水平,但本实验中未发现对小胶质细胞活化情况的改善,可能与检测的时间相关。同时也说明,脑内细胞移植治疗疾病时除了对因疾病而丢失的细胞进行补充外,神经营养因子及小胶质细胞的影响也发挥了另一个关键作用。
海马内神经营养因子的表达下降及小胶质细胞活化对移植的神经干细胞的生长发育十分不利。早在2002年Monje等[7]就发现向辐射暴露后的海马内移植的神经干细胞向神经元分化比例大幅减少,而向胶质细胞分化的比例明显增加。Acharya等[8]的研究表明,在全脑照射后的不同时间向大鼠海马内移植神经干细胞的分化命运不同,进一步证实了神经营养因子及小胶质细胞对移植细胞的作用。本研究发现,给予受照射大鼠单纯移植神经干细胞,对海马神经营养因子表达水平改善不明显,也未明显抑制神经系统内射线造成的小胶质细胞活化情况。
BDNF广泛分布于哺乳类动物中枢神经系统中,在海马、下丘脑中含量最丰富。通过与高亲和力受体Trk B或低亲和力受体P75NTR结合,对神经细胞的存活、分化、可塑性进行调控。此外,BDNF还可调促进移植后神经干细胞向神经元方向分化[9]。所以本课题旨在研究将神经干细胞移植技术和基因治疗技术结合,能够更加有效地改善放射性认知功能障碍动物的海马神经营养因子水平下降及小胶质细胞活化情况。目前神经生物学领域的各类技术手段飞速发展,有干细胞移植治疗退行性神经系统疾病的临床研究正在进行中,这些研究方法和结果也将为放射性认知功能障碍的治疗提供重要的借鉴及新的思路。
利益冲突 所有研究者未接受其他机构提供的不当利益,在此对研究的独立性和科学性予以保证作者贡献声明 钟雪、张奇贤为实验主要完成者,收集数据撰写论文;张洁、陈列松协助部分实验的完成;田野设计研究方案,指导实验及论文修改
| [1] |
Makale MT, McDonald CR, Hattangadi-Gluth JA, et al. Mechanisms of radiotherapy-associated cognitive disability in patients with brain tumours[J]. Nat Rev Neurol, 2017, 13(1): 52-64. DOI:10.1038/nrneurol.2016.185 |
| [2] |
Mizui T, Ishikawa Y, Kumanogoh H, et al. Neurobiological actions by three distinct subtypes of brain-derived neurotrophic factor:Multi-ligand model of growth factor signaling[J]. Pharmacol Res, 2016, 105: 93-98. DOI:10.1016/j.phrs.2015.12.019 |
| [3] |
Son Y, Yang M, Wang H, et al. Hippocampal dysfunctions caused by cranial irradiation:a review of the experimental evidence[J]. Brain Behav Immun, 2015, 45: 287-296. DOI:10.1016/j.bbi.2015.01.007 |
| [4] |
Oh SB, Park HR, Jang YJ, et al. Baicalein attenuates impaired hippocampal neurogenesis and the neurocognitive deficits induced by γ-ray radiation[J]. Br J Pharmacol, 2013, 168(2): 421-431. DOI:10.1111/j.1476-5381.2012.02142.x |
| [5] |
Schnegg CI, Greene-Schloesser D, Kooshki M, et al. The PPARδ agonist GW0742 inhibits neuroinflammation, but does not restore neurogenesis or prevent early delayed hippocampal-dependent cognitive impairment after whole-brain irradiation[J]. Free Radic Biol Med, 2013, 61: 1-9. DOI:10.1016/j.freeradbiomed.2013.03.002 |
| [6] |
Zuo FX, Bao XJ, Sun XC, et al. Transplantation of human neural stem cells in a Parkinsonian model exerts neuroprotection via regulation of the host microenvironment[J]. Int J Mol Sci, 2015, 16(11): 26473-26492. DOI:10.3390/ijms161125966 |
| [7] |
Monje ML, Mizumatsu S, Fike JR, et al. Irradiation induces neural precursor-cell dysfunction[J]. Nat Med, 2002, 8(9): 955-962. DOI:10.1038/nm749 |
| [8] |
Acharya MM, Christie L, Lan ML, et al. Human neural stem cell transplantation ameliorates radiation-induced cognitive dysfunction[J]. Cancer Res, 2011, 71(4): 4834-4845. DOI:10.1158/0008-5472.CAN-11-0027 |
| [9] |
Zimmermann T, Remmers F, Lutz B, et al. ESC-derived BDNF-overexpressing neural progenitors differentially promote recovery in Huntington's disease models by enhanced striatal differentiation[J]. Stem Cell Reports, 2016, 7(4): 693-706. DOI:10.1016/j.stemcr.2016.08.018 |
 2019, Vol. 39
2019, Vol. 39


