颅脑CT扫描已经广泛应用于临床。尤其对于儿童和青少年,在最优化图像质量前提下降低辐射剂量一直是研究热点[1-2]。儿童和青少年处于生长发育时期,细胞分裂和再生的速度和比例比成人快得多, 与成人相比,接受相同CT扫描条件,颅脑CT检查所受辐射剂量比成人高2.5倍[3-4],儿童比成人终生癌症风险要高得多。由于儿童和青少年的发展阶段不同,临床实践中需要对此类患者“个性化”颅脑CT扫描方案,但目前尚无有效的指标因子报道。李斌等[5]报道可以应用头围作为参数来调节管电流,但并未阐述不同头围选择不同管电流时间乘积(mAs)的具体依据。本研究中,使用头围作为一个指标来指定mAs,根据蒙特-卡罗分析平台探究颅脑CT扫描范围内各敏感器官的辐射剂量和图像质量。
资料与方法1.患者资料:前瞻性研究通过吉林大学白求恩第一医院伦理委员会的批准(批准号:2017-359)。所有患者均签署知情同意书。连续选取2017年9月至2018年6月本院门诊或住院患者中的因为不同临床症状被建议行颅脑CT检查的儿童及青少年。排除检查过程中不耐受检查、躁动的患者。最后,92名患儿纳入研究,男性50,女性42,1~17岁,平均年龄8.5岁,其中头痛患者40例,头痛及头晕21例,恶心26例,恶心及呕吐12例,外伤10例。采用随机数表法选取22例患者作为常规组, 剩余70例患者归入低剂量组。常规组不限定头围大小随机纳入患者,低剂量组又按不同头围分为3个亚组,根据头围作为一个指标来指定mAs,因此,所有患儿共分4组,即常规组(48.1~59.2 cm,250 mAs,22例)和低剂量A组(54.1~57.0 cm,200 mAs,22例)、B组(51.1~54.0 cm,150 mAs,26例)、C组(48.1~51.0 cm,100 mAs,22例)。头围大小测量方法为:眉弓上缘绕枕骨隆突上缘1圈。
2.方法:所有患儿均在美国GE公司HiSpeed Nx/i双层螺旋CT完成颅脑检查,患儿仰卧位,听眶上线为基线进行扫描。常规组管电流为250 mAs,低剂量组管电流根据头围范围的不同设定分别为:A组,200 mAs;B组,150 mAs;C组,100 mAs。以下剩余的扫描参数均相同:管电压120 kV, 层厚5 mm, 层间距5 mm,矩阵512×512,视野3.6 cm。4组患者扫描完成后均使用迭代重建算法(iDose45级)行图像重建。采用蒙特-卡罗模拟的分析平台(Radimetrics软件, 拜耳医疗保健, 德国)计算敏感器官辐射剂量值。颅脑CT扫描辐射剂量的敏感组织主要有脑实质、眼晶状体、唾液腺。
3.图像质量主观评价:由两名高年资神经放射学家在医学影像信息(PCAS)上分别对常规组和低剂量组的CT图像进行了主观质量评分。使用固定的窗宽80 Hu,窗位40 Hu。图像质量评估:解剖结构清晰,无伪影及噪声,图像质地细腻均匀,能精确诊断,5分;解剖结构尚清晰,基本无伪影及噪声,图像质地细腻尚均匀,能做出诊断,4分;解剖结构可见,噪声略强,少许伪影,图像质地稍欠细腻不均匀,尚可做出诊断,3分;解剖结构隐约可见,噪声较强,伪影较多,图像质地不细腻不均匀,降低诊断可信度,2分;解剖结构不清楚,伪影明显,噪声强,图像质地粗糙,不能做出诊断,1分。两位神经放射学家确定的3个因素的分数取平均值,得到图像质量的总分。图像质量分数≥3分被认为是一个合格的图像。
4.图像质量客观评价:在GE工作站ADW4.4上(美国GE公司)进行测量。测量灰质选取右侧丘脑、壳核及半卵圆中心层面脑皮层,测量白质选取右侧小脑半球、放射冠及半卵圆中心,分别计算灰质和白质3个层面的平均CT值,CT值的标准差(SD)来衡量噪声,信噪比(signal to noise ratio,SNR)为CT值/SD值。所有感兴趣区(ROI)均为50 mm2。
5.统计学处理:使用SPSS 22.0软件分析数据。定量资料符合正态分布以x±s表示。经方差齐性检验采用单因素方差分析比较各组敏感器官辐射剂量值和图像质量评分的差异,并采用Tukey-Kramer检验进行两两比较。不符合正态分布采用Wilcoxon秩和检验。用线性相关与回归来分析常规组中头围和脑实质、眼晶状体、唾液腺辐射剂量值的相关性及回归方程。P < 0.05为差异有统计学意义。两个放射科医生的分析结果的一致性检查使用Kappa-test, Kappa值>0.6为一致性好, 0.4≤Kappa值≤0.6为适中, Kappa值<0.4为一致性差。
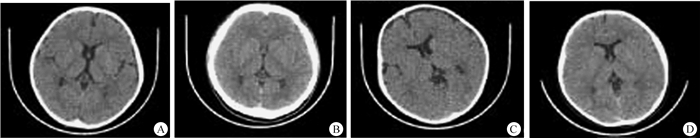
结果1.主观图像质量评分:两名医师对常规组和低剂量组颅脑CT图像质量评分的一致性较好(Kappa=0.716),评分均≥3分,可满足临床诊断需求。各组图像均能显示重要解剖结构(图 1)。主观图像质量评分4组两两比较(SNK法)除常规组(4.97±0.13)与低剂量C组(3.98±0.61)比较差异有统计学意义(q=4.41,P < 0.05)外,其他各组组间比较差异均无统计学意义(P>0.05)。
|
图 1 不同mAs患儿的颅脑CT图像 A.250 mAs; B.200 mAs; C.150 mAs; D.100 mAs Figure 1 Head CT images of children with different mAs A.250 mAs; B.200 mAs; C.150 mAs; D.100 mAs |
2.客观图像质量评分:低剂量组随着mAs的增加,图像的灰质和白质SNR逐渐升高。4组灰质和白质平均CT值、SD值和SNR列于表 1。在灰质和白质评价方面,常规组和低剂量A、B、C组的SD值之间差异明显(P < 0.05),平均CT值和SNR之间差异无统计学意义(P>0.05)。
|
|
表 1 各组行CT检查患儿灰质和白质的平均CT值、SD值和SNR的比较(mSv,x±s) Table 1 Comparisons of mean CT value, SD value and SNR of gray matter and white matter in children examined by CT in each group(mSv, x±s) |
3.敏感器官辐射剂量
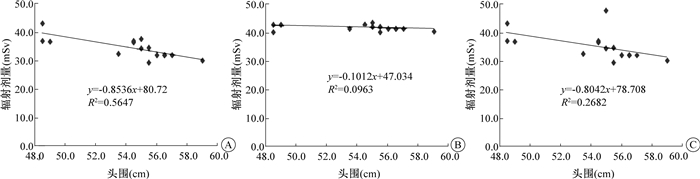
(1) 头围与敏感器官辐射剂量的关系:脑实质、眼晶状体、唾液腺辐射剂量和头围关系及回归方程见图 2。脑实质辐射剂量值与头围呈负线性相关(r=-0.751, P < 0.05)。眼晶状体的辐射剂量值与头围无线性相关(r=-0.310, P>0.05)。唾液腺辐射剂量值与头围亦呈负线性关关(r=-0.518, P < 0.05)。
|
图 2 行CT检查的患儿头围与各器官所受剂量关系的拟合图 A.脑实质;B.眼晶状体;C.唾液腺 Figure 2 Relationship between head circumference and radiation dose A.Brain; B.Eye lens; C.Salivary glands |
(2) 4组患者的脑实质、眼晶状体及唾液腺辐射剂量:由表 2可知,4组之间脑实质、眼晶状体、唾液腺辐射剂量差异均有统计学意义(F=54.51、189.73、65.74, P < 0.05),低剂量A、B、C组的敏感器官辐射剂量低于常规组,在低剂量组中,随着头围的增大,辐射剂量值增高。A、B、C组与常规组辐射剂量比较,差异均有统计学意义(q=23.74~178.81,P < 0.05)。
|
|
表 2 各组行CT检查患儿敏感器官辐射剂量的比较(mSv,x±s) Table 2 Comparison of organ-specific radiation doses to children examined by CT in each group(mSv, x±s) |
讨论
某些国家颅脑CT扫描占儿童和青少年总CT检查的50%以上[6],虽然目前中国尚没有颅脑CT检查数量的大规模数据调查,但我国放开“二孩政策”,出生儿童数量的增加必然导致疾病数量的增加,而颅脑CT检查的比例必然增加。儿童和青少年的辐射相关基因突变和癌症风险比成人的高10倍[7-9],眼晶状体、唾液腺及甲状腺对辐射极其敏感[10-12],但未见有关在颅脑CT检查中敏感器官的辐射剂量具体数值的报道,在本研究中应用Radimetrics软件[13-14]能够测得颅脑CT扫描范围内敏感器官的具体数值。
目前,国内外对于儿童和青少年颅脑CT扫描的最佳设置没有共识。对于标准颅脑CT,除了在选择管电流时间乘积(mAs)时存在较大差异外,所使用的大部分参数在不同的医院之间是一致的,患者可能会受到过多的辐射剂量。不同年龄段的儿童和青少年在颅脑CT检查时使用相同的mAs显然是不合理的。李真林等[15]按照年龄段分组采用不同的mAs,但是儿童和青少年处于生长发育阶段,即使相同年龄段的患者头颅大小也会存在很大的差异,所以年龄并不是衡量头颅大小有效指标,但是头围尺寸可以真正反映头颅的大小。
在常规组所有患者均使用250 mAs,但是发现脑实质的辐射剂量值是不相同的,头围尺寸越小的患者脑实质所受辐射剂量反而越大,表明一些患者可能在常规CT扫描中接受了过量的辐射,通过所得实验数据表明脑实质辐射剂量值与头围呈负线性相关,头围大小对脑实质辐射剂量值的大小有显著影响。脑实质和头围尺寸之间负相关关系的一种可能解释是,较大的颅骨会吸收更多的辐射,从而降低脑实质的辐射剂量,推测如果是这样,在常规组的颅脑CT扫描中,受颅骨保护的器官应该与头围表现出类似的相关性,颅骨之外的器官可能不会与头围呈负线性相关。为了验证这一点,本研究检测了唾液腺(下颌骨保护)和眼晶状体(不受骨骼保护)的辐射剂量。唾液腺也与头围尺寸呈负线性相关。另一方面,虽然较大头围尺寸的辐射剂量似乎减少了,但是眼晶状体的辐射剂量与头围并不是线性相关的。由此推断,在实验组中头围尺寸不同的患者应用不同的mAs是有理论依据的。
低剂量颅脑CT扫描对儿童及青少年患者是存在益处的。随着管电流的减小,辐射剂量也随之降低。A、B、C组相对于常规组脑实质辐射剂量分别降低了25%、33%、49%,眼晶状体辐射剂量降低了20%、37%、50%,唾液腺辐射剂量降低了26%、34%、57%。4组患者的脑实质辐射剂量存在显著差异,3组低剂量组均与常规组不同。C组的辐射剂量明显低于其他3组。对于唾液腺来说,辐射减少的模式和大脑一样。4组患者的眼晶状体辐射剂量各不相同。
虽然管电流降低了,但主观图像质量分数并没有低于3.0分,提示低剂量组图像质量无降低,所有图像均满足临床诊断要求,150和200 mAs扫描时主观图像质量评分与常规250和100 mAs扫描时没有显著性差异,但100和250 mAs扫描时之间图像质量评分存在差异,100 mAs组扫描中部分患者图像得分为3.0,这是诊断的最低可接受质量,这表明低于100 mAs的管流可能导致临床诊断的图像质量无法接受。在客观图像质量评分中,低剂量A、B、C组的噪声(SD值)均高于常规组,差异具有统计学意义,但是各组图像间的平均CT值和信噪比差异无统计学意义。此外,本研究使用了迭代重建算法(idose45级)弥补图像质量的缺失[16]。
研究发现,与传统主观的颅脑CT扫描相比,“个性化”扫描可以显著降低敏感器官辐射剂量,但图像质量保持仍然满足临床诊断要求。头围是可以成为指导儿童和青少年“个性化”颅脑CT扫描的有效指标。但是,本研究存在一定局限性,首先是选择的样本量不足,之后将扩大样本量研究,另外本实验并没有进一步细化头围与mAs和敏感器官辐射剂量之间的关系的具体规律,对于头围与具体应设置的mAs值设置,尚需要进一步的研究。
综上所述,在行颅脑CT扫描时,根据儿童和青少年的头围尺寸调节mAs,可使扫描方案更加“个性化”,在保证图像质量的前提下从而降低患者的敏感器官辐射剂量。
利益冲突 所有研究者未接受任何不正当的赞助,并对研究的独立性和科学性予以保证作者贡献声明 卞冰阳负责结果分析和论文撰写;王静负责影像评价;周清晨、周华康负责扫描;刘卓航负责儿童头围测量;赵丽负责原始数据采集;李丹负责指导方案设计、影像评价和论文修改
| [1] |
王鑫宏, 刘成佳, 孙建忠, 等. 儿童CT扫描部位及有效剂量分析[J]. 中华放射医学与防护杂志, 2017, 37(11): 866-869. Wang XH, Liu CJ, Sun JZ, et al. Analysis of CT-related sites and effective dose in children[J]. Chin J Radiol Med Prot, 2017, 37(11): 866-869. DOI:10.3760/cma.j.issn.0254-5098.2017.11.013 |
| [2] |
谢娜, 干芸根, 王宏伟, 等. 影响婴幼儿头颅低剂量CT图像质量的客观因素的研究[J]. 中华放射医学与防护杂志, 2010, 30(4): 472-474. Xie N, Gan YG, Wang HW, et al. Objective factors affecting the image quality of low-dose cranial CT of infant[J]. Chin J Radiol Med Prot, 2010, 30(4): 472-474. DOI:10.3760/cma.j.issn.0254-5098.2010.04.029 |
| [3] |
Lubin JH, Linet MS, Boice JD Jr, et al. Case control study of childhood acute lymphoblastic leukemia and residential radon exposure[J]. J Natl Cancer Inst, 1998, 90(4): 294-300. DOI:10.1093/jnci/90.4.294 |
| [4] |
Kaletsch U, Kaatsch P, Meinert R, et al. Childhood cancer and residential radon exposure-results of a population-based case-control study in Lower Saxony(Germany)[J]. Radiat Environ Biophys, 1999, 38(3): 211-215. DOI:10.1007/s004110050158 |
| [5] |
李斌, 刘义军, 刘婷, 等. 头部不同头围受检者CT低剂量扫描参数优化研究[J]. 中国医疗设备, 2012, 27(10): 62-66. Li B, Liu YJ, Liu T, et al. Parameters optimization research of low-dose CT scan in head examination with different thickness[J]. China Med Equip, 2012, 27(10): 62-66. DOI:10.39696/j.issn.1674-1633.2012.10.017 |
| [6] |
Bernier MO, Rehel JL, Brisse HJ, et al. Radiation exposure from CT in early childhood:a French large-scale multicentre study[J]. Br J Radiol, 2012, 85(1009): 53-60. DOI:10.1259/bjr/90758403 |
| [7] |
Obara H, Takahashi M, Kudou K, et al. Estimation of effective doses in pediatric X-ray computed tomography examination[J]. Exp Ther Med, 2017, 14(5): 4515-4520. DOI:10.3892/etm.2017.5102 |
| [8] |
Albert GW, Glasier CM. Strategies for computed tomography radiation dose reduction in pediatric neuroimaging[J]. Neurosurgery, 2015, 77(2): 228-232. DOI:10.1227/NEU.0000000000000764 |
| [9] |
Ciarmatori A, Nocetti L, Mistretta G, et al. Reducing absorbed dose to eye lenses in head CT examinations:the effect of bismuth shielding[J]. Australas Phys Eng Sci Med, 2016, 39(2): 583-589. DOI:10.1007/s13246-016-0445-y |
| [10] |
Domienik J, Gryglak S, Jurewicz J. Characteristics of interventional cardiologists and their work practices for the study on radiation-induced lens opacities based on the methodology developed by ELDO-preliminary results[J]. J Radiat Res, 2016, 57(4): 431-437. DOI:10.1093/jrr/rrw019 |
| [11] |
Zhang D, Cagnon CH, Villablanca JP, et al. Peak skin and eye lens radiation dose from brain perfusion CT based on Monte Carlo simulation[J]. AJR Am J Roentgenol, 2012, 198(2): 412-417. DOI:10.2214/AJR.11.7230 |
| [12] |
苏垠平, 肖国兵, 陈俊波, 等. 头、胸部CT扫描所致儿童甲状腺剂量估算及其癌症风险预测[J]. 中华放射医学与防护杂志, 2015, 35(11): 854-858. Su YP, Xiao GB, Chen JB, et al. Estimated radiation dose in the thyroid and thyroid cancer risk attributed to head or chest CT scans for pediatric patients[J]. Chin J Radiol Med Prot, 2015, 35(11): 854-858. DOI:10.3760/cma.j.issn.0254-5098.2015.11.013 |
| [13] |
Weis M, Henzler T, Nance JW Jr, et al. Radiation dose comparison between 70 kVp and 100 kVp with spectral beam shaping for non-contrast-enhanced pediatric chest computed tomography:a prospective randomized controlled sudy[J]. Invest Radiol, 2017, 52(3): 155-162. DOI:10.1097/RLI.0000000000000325 |
| [14] |
Li X, Yang K, DeLorenzo M C, et al. Assessment of radiation dose from abdominal quantitative CT with short scan length[J]. Br J Radiol, 2017, 90(1074): 20160931. DOI:10.1259/bjr.20160931 |
| [15] |
李真林, 肖家和, 杨志刚, 等. 小儿头部多层螺旋CT检查的放射剂量评价[J]. 临床放射学杂志, 2005, 24(1): 73-75. Li ZL, Xiao JH, Yang ZG, et al. Evaluation of radiation dose in multislice spiral CT for pediatric head[J]. J Clin Radiol, 2005, 24(1): 73-75. DOI:10.3969/j.issn.1001-9324.2005.01.017 |
| [16] |
Wang H, Tan B, Zhao B, et al. Raw-data-based iterative reconstruction versus filtered back projection:image quality of low-dose chest computed tomography examinations in 87 patients[J]. Clin Imaging, 2013, 37(6): 1024-1032. DOI:10.1016/j.clinimag.2013.06.004 |
 2019, Vol. 39
2019, Vol. 39


