2. 河北医科大学第一医院妇产科, 石家庄 050031
2. Department of Obstetrics and Gynecology, First Hospital of Hebei Medical University, Shijiazhuang 050031, China
近年来,随着宫颈癌早期筛查的普及,手术操作技术的不断提高,诊疗技术的发展,使得更多的早期宫颈癌得到及时的诊断和治疗,有效降低了死亡率。但仍然有29%~38%的宫颈癌患者在治疗后复发,其中约75%的复发病灶局限在盆腔[1-2]。复发性宫颈癌的治疗效果不理想[3],其治疗效果与预后受多方面因素影响[4]。目前复发宫颈癌治疗效果及预后的影响因素成为临床研究热点。但至今尚没有针对局部复发宫颈癌患者治疗的前瞻性随机试验,盆腔复发宫颈癌患者是否行同步放化疗证据尚不足[5]。已有相关研究对比了单纯放疗和同步放化疗治疗复发性宫颈癌的临床疗效,但由于病例数量较少,结论还有待进一步证实[6]。本研究收集了147例宫颈癌术后盆腔复发患者,通过对多个临床、病理因素进行单因素、多因素分析,明确了影响宫颈癌术后盆腔复发患者的放疗效果及预后的相关因素。
资料与方法1.临床资料及入组标准:回顾性收集2004年8月至2016年12月在河北医科大学第四医院收治的子宫颈癌术后盆腔复发患者175例,将资料完整的筛选出来的147例患者纳入本研究。入组标准:①患者KPS评分≥90。②有宫颈癌手术史,术前术后未做过放疗。③通过病理学证实复发,或以下指标中至少有两项阳性结果:血清鳞状细胞癌抗原(SCC-Ag)升高,电子计算机断层扫描(CT)、磁共振成像(MRI)以及正电子发射断层扫描(PET-CT)提示复发。复发部位包括阴道残端周围的中心性复发患者和盆壁受侵的患者。排除标准:①术后有辅助治疗史。②髂血管旁及主动脉旁淋巴结复发或远处转移。③复发后只行姑息治疗。④伴有严重心脑血管疾病、肝肾疾病等全身性疾病的患者。所有患者签署放化疗知情同意书。
2.治疗方法:143例行放疗外照射+腔内后装治疗,4例行单纯放疗外照射。行传统的盆腔对穿野放疗66例(44.9%),调强放疗81例(55.1%)。传统的盆腔对穿放疗射野为盆腔两野:上界位于腰4至腰5椎体之间,下界位于闭孔下缘,外界在真骨盆最宽处外放1.5~2.0 cm。处方总剂量45~50 Gy,每日1野1次,每次1.8~2.0 Gy,每周5次,共25次完成。调强放疗采用6 MV X射线直线加速器(瑞典医科达公司)5~9野等中心子野优化照射,设野范围包括:部分阴道、阴道残端、复发肿瘤、闭孔、髂内、髂外、髂总及腹主动脉旁淋巴引流区。GTV为盆腔局部复发病灶。处方总剂量为PTV45 Gy(1.8 Gy/次),GTV 60~68 Gy,分成25~29次,每日1次,每周5次,共计5~6周完成。在放射治疗结束后根据肿瘤残留位置,决定后装治疗方式。若阴道附近中心性复发外照射后残留病灶小,使用阴道模型给予阴道残端黏膜下0.5~1.0 cm参考点近距离照射14~21 Gy/2~3次。盆壁受侵患者外照射结束后,给予后装插植放疗15~28 Gy/3~4次。后装采用一体化193Ir源后装机(瑞典医科达公司)。
3.随访:随访时间从放疗结束之日开始,终止时间为2018年1月11日,中位随访时间为33.2个月(3~167个月)。
4.评价:放射治疗评价根据修订后的实体肿瘤反应评估标准(RECIST1.1版)进行评估[7]。分为完全缓解(CR)、部分缓解(PR)、稳定(SD)、进展(PD)。有效为CR+PR。直肠放射性损伤参考美国放射肿瘤学会协作组(RTOG)和欧洲癌症研究中心(EORTC)晚期放射损伤分级,1级:直肠黏膜水肿,排便习惯改变,稀便或便秘,偶便血;2级:直肠黏膜增厚,直肠狭窄,排便困难,常便血,药物治疗后,症状可缓解;3级:严重的排便困难,溃疡或瘘形成,全血便。
5.统计学处理:采用SPSS 21.0软件进行分析。对患者的临床病例特征和放疗方法等进行logistic回归模型单因素分析,P < 0.05为差异有统计学意义。采用Kaplan-Meier法统计生存率,并绘制相应生存曲线,预后相关因素对比使用Log-rank。对P < 0.10的因素采用COX比例风险回归模型进行多因素分析。治疗后不良反应分析采用χ2检验。
结果1.入组患者病例特征:本研究147例患者从宫颈癌根治术之日到复发日期的中位无病间隔为12个月(4~144个月)。患者病例特点见表 1。
|
|
表 1 147例宫颈癌术后盆腔复发放射治疗后完全缓解相关因素的单因素分析 Table 1 Univariate analysis of factors associated with complete remission after radiotherapy for pelvic recurrence in 147 cases of cervical cancer |
2.治疗效果:治疗后3个月内行第1次评估,完全缓解91例(61.9%),部分缓解37例(25.2%),进展19例(12.9%)。对患者的各项参数进行Logistic回归模型单因素分析,显示术前国际妇产科学联盟(FIGO)分期0~ⅠB期治疗后完全缓解率(70.2%)明显高于ⅡA ~ⅡB期治疗后完全缓解率(44.9%),差异有统计学意义(χ2=8.194,P < 0.05);盆腔侧壁未受侵组治疗后完全缓解率(51.6%)明显高于盆腔侧壁受侵组治疗后完全缓解率(48.4%),差异有统计学意义(χ2=12.863,P < 0.05);复发肿瘤体积≤3 cm组治疗后完全缓解率(71.9%)明显高于复发肿瘤体积>3 cm组(55.6%),差异有统计学意义(χ2=3.907,P < 0.05),见表 1。
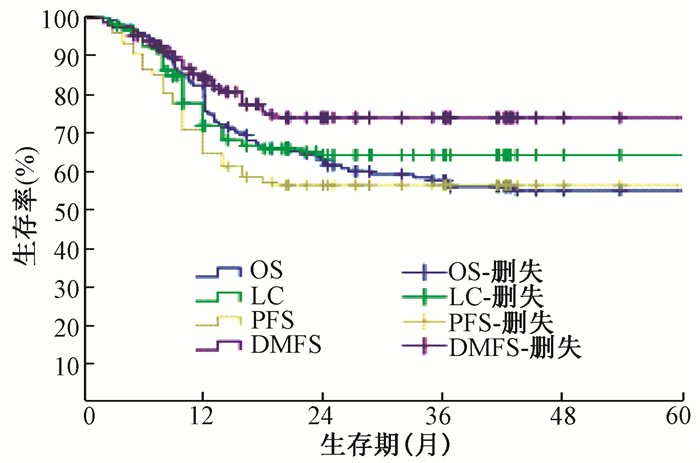
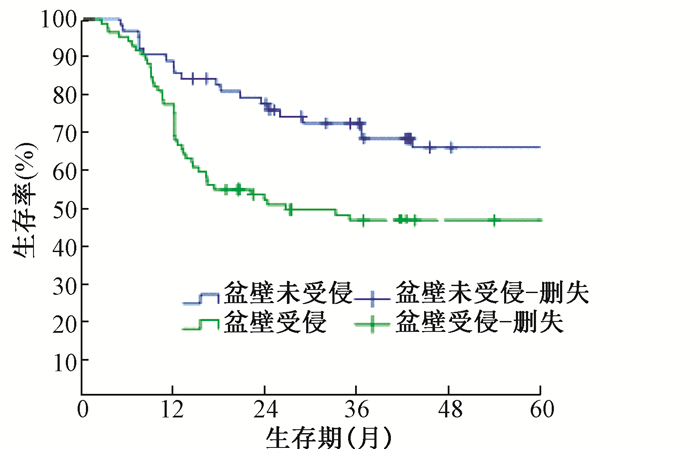
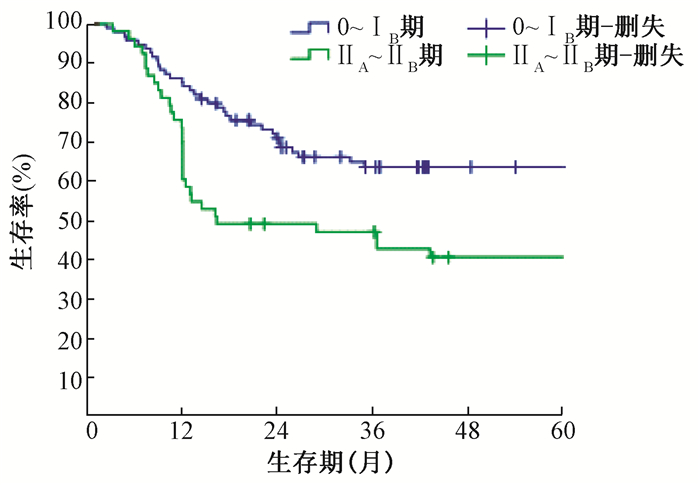
进一步多因素logistic回归分析发现,FIGO分期、盆腔侧壁是否受侵是影响宫颈癌术后盆腔复发患者放疗效果的独立因素(P<0.05),见表 2。147例宫颈癌术后盆腔复发患者放疗后5年的累积总生存率(OS)、局部控制率(LC)、无进展生存率(PFS)和远距离无转移生存率(DMFS)分别为55.0%、63.6%、56.0%、73.9%(图 1)。54例宫颈癌术后盆壁未受侵患者放射治疗后5年总生存率(OS)为65.0%,明显高于盆壁受侵患者(46.6%)(图 2)。术前分期0~ⅠB期宫颈癌术后盆腔复发患者的5年总生存率(63.5%)高于ⅡA-ⅡB期(40.6%),见图 3。
|
|
表 2 147例宫颈癌术后盆腔复发患者放射治疗后完全缓解相关因素多因素分析 Table 2 Multivariate analysis of factors associated with complete remission after radiotherapy for pelvic recurrence in 147 patients with cervical cancer |
|
注:OS.总生存率;LC.局部控制率;PFS.无进展生存率;DMFS.无远处转移生存率 图 1 147例宫颈癌术后盆腔复发患者放射治疗后生存曲线 Figure 1 Survival curve after radiotherapy in 147 patients with pelvic recurrence after pelvic resection |
|
图 2 147例宫颈癌盆壁受侵与未受侵患者放射治疗后Kaplan-Meier总生存曲线 Figure 2 Kaplan-Meier overall survival curve after radiotherapy in patients without pelvic wall invasion |
|
图 3 147例宫颈癌患者术前分期组放射治疗后Kaplan-Meier总生存曲线, Figure 3 Kaplan-Meier overall survival curve in preoperative staging group after radiotherapy |
3.不良反应:其中53例发生骨髓抑制,均予以对症支持治疗后恢复正常;16例患者膀胱炎,予以对症处理后,尿急、尿疼、尿频症状明显好转。23例患者出现1级放射性直肠炎,31例出现2级放射性直肠炎,予以云南白药、地塞米松等灌肠处理,出血症状明显好转或消失。3例患者发生直肠阴道瘘,无1例死于不良反应并发症。93例宫颈癌术后盆腔复发盆壁受侵患者,出现≥2级放射性直肠炎的发生率高于盆壁未受侵者,分别为26.9%和16.7%,差异有统计学意义(χ2=5.046,P < 0.05)。
讨论本研究共纳入147例早期宫颈癌术后盆腔复发接受放射治疗的患者。对其临床及病理特点进行统计分析,以明确盆腔复发肿瘤放疗疗效及预后的影响因素。在本研究单因素分析中,宫颈癌术后盆腔局部复发肿瘤的大小影响放射治疗的效果和预后,但多因素分析发现复发肿瘤大小并无统计学意义。表明复发肿瘤大小是影响宫颈癌术后盆腔复发治疗效果和预后的一个相关因素,但并不是其治疗效果和预后的独立影响因素。本研究中复发肿瘤>3 cm的患者,放射治疗后完全缓解率55.6%,5年总生存率58.7%,复发肿瘤<3 cm者,完全缓解率71.9%,5年生存率64.9%。可以看出复发肿瘤越大,预后相对越差。但临床上发现盆腔中心复发肿瘤较大的患者,外照射结束后,若肿瘤局部有残留,通过近距离插植放疗给予残留肿瘤适形度较高的照射,治疗效果较好。而盆壁有受侵的患者,即便复发肿瘤体积不是很大,若外照射后局部肿瘤仍有残留,由于解剖位置的限制,部分区域虽然可以通过插植放疗,但难以达到合理的放射源的分布,所以导致部分患者放疗后未控。既往的研究分析也发现复发部位是影响预后的重要因素[8~10]。本研究的单因素、多因素分析中发现盆壁是否受侵是影响宫颈癌术后盆腔复发患者治疗效果及预后的重要因素。本研究的147例患者,盆壁未受侵者54例,治疗后完全缓解率51.6%,5年生存率77.7%,盆壁受侵者93例,治疗后完全缓解率48.4%,5年生存率41.7%。统计学分析发现盆腔侧壁是否受侵对宫颈癌术后盆腔复发患者治疗效果和生存率的影响有显著差异。对临床分期的研究表明,0~ⅠB期宫颈癌术后盆腔复发患者放射治疗后完全缓解率、5年生存率分别为70.2%、63.9%,ⅡA ~ⅡB期完全缓解率、5年生存率分别为44.9%、37.6%(P<0.05)。表明了宫颈癌术后盆腔复发患者术前FIGO分期越早,放射治疗后越易达到完全缓解,远期治疗效果越好。分析原因可能系术前分期较晚的患者更容易发生侵及盆壁的复发有关。
因为1级不良反应可耐受,故本研究主要分析2级、3级不良反应。本研究中宫颈癌术后盆腔复发患者中,盆壁受侵患者出现≥2级放射性直肠炎的发生率为26.9%,其中3例发生直肠阴道瘘,而盆壁未受侵患者出现≥2级放射性直肠炎的发生率为16.7%。盆腔侧壁受侵患者直肠损伤发生率较高,原因可能是通常在相同放疗剂量条件下,盆壁受侵患者的治疗效果比盆壁未受侵患者差,常需局部推高放疗剂量。所以,盆壁受侵患者放疗总剂量高于盆壁未受侵者,使直肠的受照射量增加,增加了直肠反应的风险。因此,在增加放疗剂量的同时,要考虑与其并存的不良反应,权衡利弊,制定个体化治疗方案。三维后装插植放疗是目前最适形的放疗手段,因为可以人为的建立施源器通道,用于外照射结束后未控肿瘤的局部推量。
近年来,使用三维后装插植放疗用于盆壁复发肿瘤的局部推量,可明显提高靶区的适形度,进而提高局部控制率,同时直肠与膀胱受照剂量和体积明显减少,相应的放射性直肠炎也明显减少。目前调强放疗、三维插植放疗已广泛应用于宫颈癌术后盆腔复发患者的治疗,取得了较好的效果。本研究发现,治疗前依据盆腔不同复发部位设定个体化放疗计划,给予盆壁复发肿瘤较高的放疗剂量是提高肿瘤局部控制率,改善盆腔复发肿瘤患者预后的最有效措施。
利益冲突 无作者贡献声明 蒋佳佳、刘红负责数据的整理和分析、论文的撰写和最终版本修订;王玉净、张倩影负责病例收集和随访;房朝辉、李魁秀提出研究思路,对整个研究方案设计指导
| [1] |
Goncalves A, Fabbro M, Lhommé C, et al. A phase Ⅱ trial to evaluate gefitinib as second-or third-line treatment in patients with recurring locoregionally advanced or metastatic cervical cancer[J]. Gynecol Oncol, 2008, 108(1): 42-46. DOI:10.1016/j.ygyno.2007.07.057 |
| [2] |
Boussios S, Seraj E, Zarkavelis G, et al. Management of patients with recurrent/advanced cervical cancer beyond first line platinum regimens:Where do we stand? A literature review[J]. Crit Rev Oncol Hematol, 2016, 108: 164-174. DOI:10.1016/j.critrevonc.2016.11.006 |
| [3] |
连利娟, 林巧稚. 妇科肿瘤学[M]. 北京: 人民卫生出版社, 1994: 353-358. Lian LJ, Lin QZ. Gynecologic oncology[M]. Beijing: Peopie's Medical Publishing House, 1994: 353-358. |
| [4] |
张晓春, 张雪艳, 刘爱红, 等. 子宫颈癌复发后治疗方法与预后的关系[J]. 中华妇产科杂志, 1995, 30(10): 611-613. Zhang XC, Zhang XY, Liu AH, et al. Pelvic recurrence of cervical:the prognostic relationship to the retreatment modalities[J]. Chin J Obstet Gynecol, 1995, 30(10): 611-613. |
| [5] |
Friedlander M, Grogan M. Guidelines for the treatment of recurrent and metastatic cervical cancer[J]. Oncologist, 2002, 7(4): 342-347. |
| [6] |
Ito H, Shigematsu N, Kawada T, et al. Radiotherapy for centrally recurrent cervical cancer of the vaginal stump following hysterectomy[J]. Gynecol Oncol, 1997, 67(2): 154-161. DOI:10.1006/gyno.1997.4855 |
| [7] |
Yin YJ, Li HQ, Sheng XG, et al. The treatment of pelvic locoregional recurrence of cervical cancer after radical surgery with intensity-modulated radiation therapy compared with conventional radiotherapy:a retrospective study[J]. Int J Gynecol Cancer, 2015, 25(6): 1058-1065. DOI:10.1097/IGC.0000000000000360 |
| [8] |
Haasbeek CJ, Uitterhoeve AL, van der Velden J, et al. Long-term results of salvage radiotherapy for the treatment of recurrent cervical carcinoma after prior surgery[J]. Radiother Oncol, 2008, 89(2): 197-204. DOI:10.1016/j.radonc.2008.01.004 |
| [9] |
Ijaz T, Eifel PJ, Burke T, et al. Radiation therapy of pelvic recurrence after radical hysterectomy for cervical carcinoma[J]. Gynecol Oncol, 1998, 70(2): 241-246. DOI:10.1006/gyno.1998.5093 |
| [10] |
Maneo A, Landoni F, Cormio G, et al. Concurrent carboplatin/5-fluorouracil and radiotherapy for recurrent cervical carcinoma[J]. Ann Oncol, 1999, 10(7): 803-807. DOI:10.1023/:1008356010556 |
 2019, Vol. 39
2019, Vol. 39


