2. 南京医科大学附属苏州医院肿瘤放疗科, 苏州 215002;
3. 苏州大学附属第一医院肿瘤放疗科 215006
2. Department of Radiotherapy and Oncology, Nanjing Medical University Affiliated Suzhou Hospital, Suzhou 215002, China;
3. Department of Radiation Oncology, The First Affiliated Hospital of Soochow University, Suzhou 215006, China
食管癌80%以上是鳞状细胞癌(esophageal squamous cell carcinoma, ESCC)[1]。由于ESCC具有发病较隐匿、进展迅速等临床病理特点,早期食管癌的诊断率较低,而根据第7版美国癌症联合委员会(American Joint Committee on Cancer,AJCC)指南,同步放化疗是晚期、不能手术或不愿手术食管癌患者的标准治疗方案[2],但总体预后仍然较差, 5年总生存率17%左右[3]。因此,寻找能够预测ESCC接受放化疗患者近期疗效及生存预后的指标,从而采取有效措施进行干预是近年研究的热点。许多临床试验已经报道系统炎性标志物,如中性粒细胞与淋巴细胞比值(neutrophil-to-lymphocyte ratio,NLR), 血小板与淋巴细胞比值(platelet-to-lymphocyte ratio,PLR)和C反应蛋白与白蛋白比值(C-reactive protein/albumin ratio,CRP/Alb),与恶性肿瘤的预后密切相关[4-7]。但既往报道多为单项炎性指标对预后的影响,为临床肿瘤医师提供的信息有限。因此,本研究探讨了治疗前NLR,PLR和CRP/Alb 3项炎性指标对接受根治性放(化)疗的食管鳞癌患者近期疗效及远期生存预后的影响。
资料与方法1.一般临床资料:回顾性选取2013年1月至2014年12月在扬州大学附属泰兴人民医院行根治性放(化)疗且病历、随访资料齐全的ESCC患者作为研究对象,纳入标准:①年龄≥20岁,卡氏评分≥70分且病理明确诊断为ESCC。②既往未接受过放(化)疗。③治疗前无出血、穿孔征象,治疗目的为根治性放(化)疗。预计生存时间均>3个月。④无严重血液障碍性疾病患者。排除标准:①未完成放疗中途退出者。②患者同时具有其他肿瘤或食管癌已远处转移。③患者具有肝硬化、血液性疾病或者自身免疫性疾病、急性感染等。共107例患者入组,其中男性82例,女性25例,年龄范围45~85岁,中位数67岁;治疗前病变部位:胸上段35例、胸中段47例、胸下段25例;依据2009年国际抗癌联盟(UICC)分期:Ⅰ期2例,Ⅱ期59例、Ⅲ期46例;采用单纯放疗者19例,同步放化疗者88例,治疗方案通过医院伦理委员会论证,所有患者均已签署放疗或放化疗知情同意书。入组患者的临床资料见表 1。入组患者治疗前1周完成常规血液检查,并根据中性粒细胞与淋巴细胞比值(NLR)、血小板与淋巴细胞比值(PLR)和C反应蛋白与白蛋白比值(CRP/Alb)的中位值将患者分为NLR<3.06组(54例)和NLR≥3.06组(53例),PLR<145.26组(54例)与PLR≥145.26组(53例),CRP/Alb<0.13组(52例)和CRP/Alb≥0.13组(55例),研究其对近期疗效及远期生存的影响。
|
|
表 1 107例食管鳞癌患者的临床病理资料 Table 1 Clinicopathological characteristics of 107 patients with esophageal squamous cell carcinoma |
2.放疗方法:使用放疗定位膜固定,CT模拟机定位,扫描层厚每层为4 mm。患者均采用三维适形放疗(three dimensional conformal RT, 3D-CRT),常规分割照射,1.8~2.0 Gy/次,5次/周。治疗处方剂量95%PTV:DT 56~66 Gy/6~7周。肿瘤靶区(GTV)为食管原发病灶及区域转移淋巴结;食管原发瘤定义为食管管壁厚度>0.5 cm或不含气食管腔直径>1.0 cm。区域转移淋巴结定义为纵隔内淋巴结短径≥1.0 cm,气管食管旁沟、心包角淋巴结长径≥0.5 cm;临床靶区(CTV):包括GTV,上下外放3 cm、左右、前后外扩1 cm;CTV上下外扩1 cm、左右外扩0.5 cm为计划靶区(PTV)。危及器官包括脊髓≤45 Gy、双肺V20≤25%~28%、心脏V30≤40%。
3.化疗方法:88例患者接受同步放化疗,采用TP方案:顺铂25 mg/m2第1~4天;紫杉醇135~175 mg/m2第1天静脉滴注。同步化疗在放疗第2天开始使用,28 d为1个周期,共2个周期。
4.近期疗效评价:治疗结束后3月内行CT复查,按RECIST1.1版实体瘤疗效评价标准评价食管原发肿瘤及区域转移淋巴结的治疗效果[8],分为完全缓解(CR), 部分缓解(PR), 稳定(SD)和进展(PD), 有效为CR+PR,无效为SD+PD。
5.随访:采取门诊定期复诊及电话随访两种方式,所有入组患者治疗结束后第1年每3月复查1次,随后2年每6月复查1次,最后1年复查1次,随访时间至2017年12月。
6.统计学处理:应用SPSS 17.0统计软件分析,近期疗效采用logistic法单因素及多因素分析;对生存率行Kaplan—Meier法计算并Log-rank法检验,Cox回归模型法评估预后因素。采用受试者工作特征曲线(receiver operating characteristic curve,ROC)分析血液炎性标志物对患者近期疗效及生存预后的预测价值。P < 0.05为差异有统计学意义。
结果1.食管鳞癌患者放化疗前血液炎性指标对治疗效果的影响:入组患者总体治疗有效率为69.2%,NLR<3.06组和NLR≥3.06组,有效率分别为83.3%、54.7%;PLR<145.26组与PLR≥145.26组,有效率分别为77.8%和60.4%;CRP/Alb<0.13组和CRP/Alb≥0.13组,有效率分别为90.4%和49.1%;单因素logistic回归分析显示治疗方式(HR=2.118,95%CI 1.145~3.282,P < 05)、NLR(HR=4.138,95%CI 1.687~10.148,P < 05)、PLR(HR=2.297,95%CI 1.001~5.414,P=0.050)和CRP/Alb(HR=3.784,95%CI 2.325~6.160,P < 05)与治疗效果密切相关;在多变量logistic回归分析进一步显示治疗方法(HR=1.342, 95%CI 1.023~2.467, P < 0.05)与CRP/Alb(HR=7.004, 95%CI 2.088~23.496, P < 0.05)是疗效的独立危险因素。
2.治疗前血液炎性指标对食管鳞癌放化疗患者无疾病进展生存时间的影响:在NLR < 3.06与≥3.06患者中,其中位PFS时间分别为19(95%CI 12.827~25.173)和12个月(95%CI 10.057~13.943),两组患者的1、2、3年PFS率比较差异有统计学意义(χ2=11.529, P < 0.05);而在PLR < 145.26与≥145.26患者中,其中位PFS时间分别为15(95%CI 7.799~22.201)和13个月(95%CI 10.860~15.140),两组患者1、2、3年PFS率比较差异有统计学意义(χ2=4.162, P < 0.05);最后在CRP/Alb < 0.13的患者中,中位PFS时间为24个月(95%CI 21.536~28.041),CRP/Alb ≥0.13患者中,中位PFS时间为11个月(95%CI 9.679~12.321),两组患者1、2、3年PFS率比较差异有统计学意义(χ2=10.201, P < 0.05),见表 2。
|
|
表 2 放化疗前不同血液炎性指标对食管鳞癌患者1、2、3年无疾病进展生存情况(%) Table 2 The 1-, 2- and 3-year progression-free survival status of different blood inflammatory markers in patients with esophageal squamous cell carcinoma before chemoradiotherapy (%) |
另外,单因素COX回归分析显示:TNM分期、治疗方式、NLR、PLR和CRP/Alb均与食管鳞癌患者的PFS密切相关(P < 0.05);在多因素COX回归模型中显示:TNM分期(HR=1.326, 95%CI 1.070~1.838, P < 0.05)、治疗方式(HR=0.400, 95%CI 0.230~0.694, P < 0.05)与CRP/Alb(HR=3.518, 95%CI 1.975~6.266,P < 0.05)是PFS的独立预后因素,见表 3。
|
|
表 3 107例食管鳞癌接受放(化)疗患者无疾病进展生存时间的单因素和多因素COX回归分析 Table 3 Univariate and multivariate COX analysis of 107 ESCC patients treated with CRT or single RT |
3.治疗前血液炎性指标根据TNM分期及治疗方式对食管鳞癌放化疗患者无疾病进展生存时间的亚组分析:根据TNM分期进行亚组生存分析结果显示:在Ⅰ和Ⅱ期患者中,CRP/Alb < 0.13的中位PFS时间为27个月(95%CI为23.270~31.094),1、2、3年PFS率为78.8%、63.6%、57.6%,而CRP/Alb ≥0.13的中位PFS时间为12个月(95%CI为9.730~13.521),1、2、3年PFS率为42.9%、6.3%、1.6% (χ2=33.829, P < 0.05);在Ⅲ期患者中,CRP/Alb < 0.13的中位PFS时间为21个月(95%CI为10.937~38.063),1、2、3年PFS率为57.9%、42.1%、26.3%,而CRP/Alb ≥0.13的中位PFS时间为11个月(95%CI为9.735~12.265),1、2、3年PFS率为37.0%、14.8%、7.4% (χ2=7.488, P < 0.05)。
根据治疗方式进行亚组分析,在单纯放疗患者中,CRP/Alb < 0.13的中位PFS时间为15个月(95%CI为7.301~22.699),1、2、3年PFS率为57.1%、14.3%、12.6%,而CRP/Alb ≥0.13的中位PFS时间为8个月(95%CI为4.605~11.395),1、2、3年PFS率为16.7%、3.3%、0.0% (χ2=6.799, P < 0.05);在放化疗患者中,CRP/Alb < 0.13的中位PFS时间为25个月(95%CI为22.399~29.378),1、2、3年PFS率为73.3%、62.2%、51.1%,而CRP/Alb ≥0.13的中位PFS时间为12个月(95%CI为10.168~13.832),1、2、3年PFS率为46.5%、9.3%、4.7% (χ2=27.575, P < 0.05)。
4.受试者工作特征曲线对疗效和生存预后的预测:绘制受试者工作特征曲线是为了进一步证实血液炎性指标对疗效和PFS的预测价值,如图 1所示,NLR、PLR和CRP/Alb预测疗效的曲线下面积(AUC)分别为0.653 (95% CI 0.535~0.771, P < 05)、0.645(95% CI 0.533~0.758, P < 05)和0.824 (95% CI 0.743~0.905, P < 0.05)。NLR、PLR和CRP/Alb预测PFS的AUC分别为0.640 (95% CI 0.529~0.752, P < 05)、0.636(95% CI 0.520~0.751, P < 05)和0.833 (95% CI 0.817~0.949, P < 0.05),见图 2。这充分说明CRP/Alb在预测食管鳞癌接受放化疗患者的近期疗效和无疾病进展生存时间方面优于NLR和PLR。
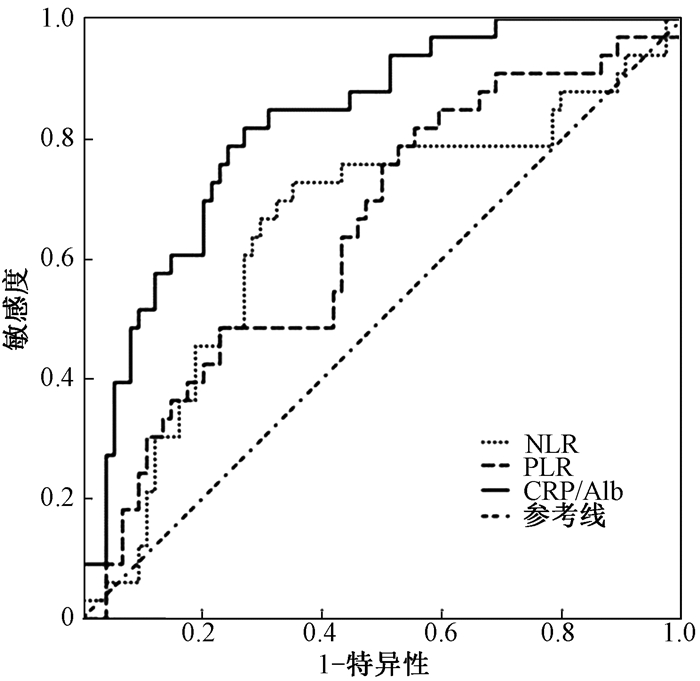
|
注:NLR.中性粒细胞与淋巴细胞比值; PLR.血小板与淋巴细胞比值;CRP/Alb. C-反应蛋白与白蛋白比值 图 1 NLR,PLR,CRP/Alb预测107例食管鳞癌接受放(化)疗患者近期疗效的受试者工作特征曲线 Figure 1 NLR, PLR, CRP/Alb predicted the short-term efficacy of 107 patients with esophageal squamous cell carcinoma treated with chemoradiotherapy using receiver operating characteristic curve |
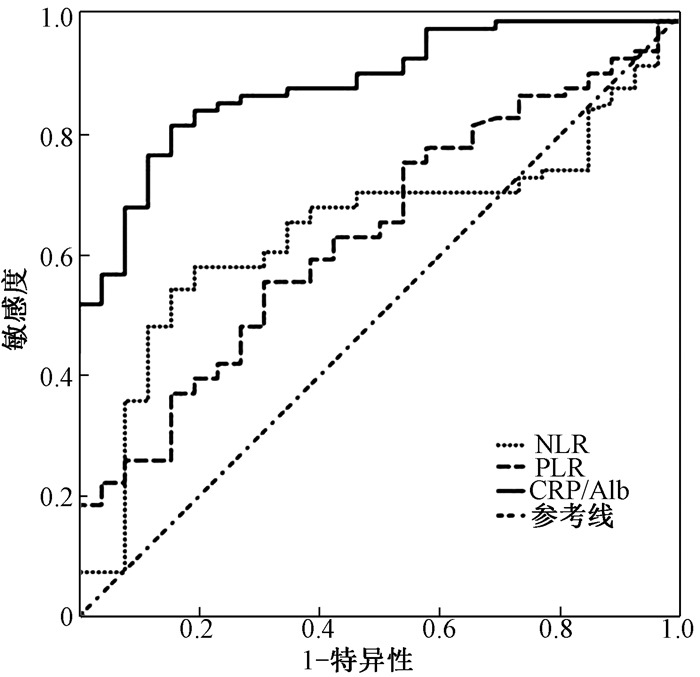
|
注:NLR.中性粒细胞与淋巴细胞比值; PLR.血小板与淋巴细胞比值;CRP/Alb. C-反应蛋白与白蛋白比值 图 2 NLR、PLR、CRP/Alb预测107例食管鳞癌接受放(化)疗患者无疾病进展生存时间的受试者工作特征曲线 Figure 2 NLR, PLR, CRP/Alb predicted the progression-free survival of 107 patients with esophageal squamous cell carcinoma treated with chemoradiotherapy using receiver operating characteristic curve |
讨论
食管鳞状细胞癌是中国常见的消化道恶性肿瘤,由于发病隐匿,初诊时大多为中晚期,失去手术治疗的时机;放化疗为标准治疗方案,但近期治疗效果与远期生存时间仍不尽人意。目前临床上用来判断食管鳞癌接受放化疗患者疗效及预后的因素主要依靠治疗前的临床TNM分期,在本研究中也证实了TNM分期确实是影响食管鳞癌患者无疾病进展时间的独立预后因素。但在临床工作中经常遇见处于同一临床分期、并且接受相同治疗手段的患者,其疗效或生存预后明显不同,因此,治疗前寻找新的生物标志物补充临床TNM分期的不足至关重要。
全身炎性反应在恶性肿瘤中普遍存在,并且与肿瘤进展和复发密切相关。目前研究已经证明肿瘤相关炎性细胞是肿瘤微环境的构成因素之一,能够促进肿瘤细胞增殖、侵袭和转移,在肿瘤发生发展中起着重要作用[9]。许多临床研究也表明血液炎性指标复合物能够有效预测食管癌放化疗患者的治疗效果,如Kijima等[10]的研究认为不能手术的晚期食管鳞癌患者,纤维蛋白原和中性粒细胞与淋巴细胞比值联合评分(the combination of fibrinogen and neutrophil-lymphocyte ratio, F-NLR)越高,其治疗效果越差,总生存率越低;Zhu等[11]的研究表明中性粒细胞与淋巴细胞比值和血小板与淋巴细胞比值联合评分(the combination of NLR and PLR, CNP)是食管鳞癌放化疗患者治疗效果的敏感指标,其预测效能明显优于单纯的中性粒细胞与淋巴细胞比值或血小板与淋巴细胞比值。而本研究的单因素logistic回归分析显示治疗方式、NLR、PLR和CRP/Alb与治疗效果密切相关(P均<0.05);而在多变量logistic回归分析进一步显示只有治疗方法与CRP/Alb是疗效的独立危险因素,NLR和PLR差异无统计学意义(P>0.05),受试者工作特征曲线也进一步证实血液炎性指标CRP/Alb对疗效预测价值优于NLR和PLR。
目前大量的研究已经证明血液炎性标志物,包括NLR,PLR和LMR与许多恶性肿瘤的生存预后存在密切关系[4-5, 12]。而目前报道认为CRP/Alb作为一种新的标志物在预测肿瘤生存预后方面具有重要价值,如Liu等[6]的研究表明对于根治性手术切除的胃癌患者CRP/Alb是预测总生存时间的敏感指标,其术前比值越高,预后越差;Tao等[13]研究认为接受根治性放化疗的鼻咽癌患者CRP/Alb也是预测生存预后的重要敏感指标,治疗前比值升高,预后亦较差。而本研究发现CRP/Alb<0.13患者的1、2、3年无疾病进展生存时间优于CRP/Alb≥0.13患者,并且在在多因素COX回归模型中也显示CRP/Alb是独立于TNM分期及治疗方式的重要生存预后因素,而NLR和PLR没有达到类似结果,这在受试者工作特征曲线中进一步得到证实。最后,从TNM分期及治疗方式的亚组分析得出,无论在食管鳞癌的早期患者(Ⅰ+Ⅱ期),还是晚期患者(Ⅲ期),是接受单纯放疗,还是同步放化疗,CRP/Alb < 0.13的无疾病进展生存时间均优于CRP/Alb ≥0.13。
血液炎性指标CRP/Alb在预测胸段食管鳞状细胞癌接受放化疗患者近期疗效及生存预后方面优于NLR和PLR,一方面是因为NLR、PLR的评价基础仅为免疫系统, 未结合患者营养状态, 故预测效能较为局限。而另一方面CRP是很多原发性恶性肿瘤炎症相关的预后指标, 低Alb水平是一种营养不良的表现,与不同肿瘤的预后也有密切关系。因此,CRP/Alb结合了机体炎症反应(CRP)与营养状态(Alb)两大方面,其预测价值也会明显增加。
总之,CRP/Alb检测简便、经济,可以作为评估食管鳞癌接受放化疗患者近期疗效及远期生存预后的一种有效指标,弥补治疗前TNM临床分期的不足,为制定正确的治疗方案和随访策略提供有用信息。但本研究的病例数相对较少,且为单中心、回顾性研究,在此基础上应进一步设计前瞻性临床试验以进一步验证。
利益冲突 无作者贡献声明 郭信伟、冀胜军负责资料的收集和论文撰写;周绍兵、周菊英提出选题方向;刘阳晨、叶宏勋指导论文写作和修改
| [1] |
Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115-132. DOI:10.3322/caac.21338 |
| [2] |
Rice TW, Rusch VW, Ishwaran H, et al. Cancer of the esophagus and esophagogastric junction:data-driven staging for the seventh edition of the American Joint Committee on Cancer/International Union Against Cancer Cancer Staging Manuals[J]. Cancer, 2010, 116(16): 3763-3773. DOI:10.1002/cncr.25146 |
| [3] |
Zhang Y. Epidemiology of esophageal cancer[J]. World J Gastroenterol, 2013, 19(34): 5598-5606. DOI:10.3748/wjg.v19.i34.5598 |
| [4] |
Yodying H, Matsuda A, Miyashita M, et al. Prognostic significance of neutrophil-to-lymphocyte ratio and platelet-to-lymphocyte ratio in oncologic outcomes of esophageal cancer:a systematic review and meta-analysis[J]. Ann Surg Oncol, 2016, 23(2): 646-654. DOI:10.1245/s10434-015-4869-5 |
| [5] |
Koh CH, Bhoo-Pathy N, Ng KL, et al. Utility of pre-treatment neutrophil-lymphocyte ratio and platelet-lymphocyte ratio as prognostic factors in breast cancer[J]. Br J Cancer, 2015, 113(1): 150-158. DOI:10.1038/bjc.2015.183 |
| [6] |
Liu X, Sun X, Liu J, et al. Preoperative C-reactive protein/albumin ratio predicts prognosis of patients after curative resection for gastric cancer[J]. Transl Oncol, 2015, 8(4): 339-345. DOI:10.1016/j.tranon.2015.06.006 |
| [7] |
Yu X, Wen Y, Lin Y, et al. The value of preoperative glasgow prognostic score and the C-reactive protein to albumin ratio as prognostic factors for long-term survival in pathological T1N0 esophageal squamous cell carcinoma[J]. J Cancer, 2018, 9(5): 807-815. DOI:10.7150/jca.22755 |
| [8] |
Nishino M, Jagannathan JP, Ramaiya NH, et al. Revised RECIST guideline version 1.1:What oncologists want to know and what radiologists need to know[J]. AJR Am J Roentgenol, 2010, 195(2): 281-289. DOI:10.2214/AJR.09.4110 |
| [9] |
Mantovani A, Allavena P, Sica A, et al. Cancer-related inflammation[J]. Nature, 2008, 454(7203): 436-444. DOI:10.1038/nature07205 |
| [10] |
Kijima T, Arigami T, Uchikado Y, et al. Combined fibrinogen and neutrophil-lymphocyte ratio as a prognostic marker of advanced esophageal squamous cell carcinoma[J]. Cancer Sci, 2017, 108(2): 193-199. DOI:10.1111/cas.13127 |
| [11] |
Zhu S, Miao CW, Wang ZT, et al. Sensitivity value of hematological markers in patients receiving chemoradiotherapy for esophageal squamous cell carcinoma[J]. Oncol Targets Ther, 2016, 9: 6187-6193. DOI:10.2147/OTT.S115011 |
| [12] |
Kano S, Homma A, Hatakeyama H, et al. Pretreatment lymphocyte-to-monocyte ratio as an independent prognostic factor for head and neck cancer[J]. Head Neck, 2017, 39(2): 247-253. DOI:10.1002/hed.24576 |
| [13] |
Tao CJ, Chen YY, Jiang F, et al. The C-reactive protein/albumin ratio is an independent prognostic factor for overall survival in patients with nasopharyngeal carcinoma receiving intensity-modulated radiotherapy[J]. J Cancer, 2016, 7(14): 2005-2011. DOI:10.7150/jca.16210 |
 2019, Vol. 39
2019, Vol. 39


