2. 河南省肿瘤医院放疗科, 郑州 450008;
3. 河南省人民医院胃肠外科, 郑州 450008
2. Department of Radiotherapy, Henan Cancer Hospital, Zhengzhou 450008, China;
3. Gastrointestinal Surgery, Henan Provincial People's Hospital, Zhengzhou 450008, China
放射治疗是中晚期肝癌治疗的重要手段。虽然三维适形放疗明显提高了患者的生存率,但是其疗效并不尽如人意[1]。因此,如何增强放射敏感性,提高放疗疗效,一直是肝癌治疗领域研究的热点。MicroRNAs(miRNAs)是一类非编码的单链小分子RNA,可通过调控一种或多种靶基因的表达参与肿瘤细胞的发生和发展。miR-29c是一种定位于1q32.2染色体上的miRNA,其可通过参与细胞分化和细胞凋亡等生物学功能,参与鼻咽癌、食管癌和前列腺癌等多种肿瘤发生发展[2-4]。有报道指出,miR-29c在肝癌组织中低表达,与组织学分级、肿瘤分期、微血管侵润和总生存期缩短等有关,在肝癌的发生发展中扮演着抑癌基因的作用,且其表达受电离辐射的影响[5-7],但miR-29c是如何影响肝癌的放射敏感性尚不完全清楚。AKT2是PI3K/Akt信号转导通路的重要因子,其在肿瘤的生长及转移过程中发挥着重要作用,且与肝癌的放射抵抗机制关系密切[8]。已有研究证实,miR-29c可通过靶向调控AKT2参与肺癌的顺铂耐药机制[9],但miR-29c靶向AKT2有无参与肝癌的放射抵抗机制鲜见报道。因此,本研究以肝癌HepG2细胞为研究对象,探讨miR-29c靶向AKT2对HepG2放射敏感性的影响,以期为提高肝癌放射治疗提供新的靶点和线索。
材料与方法1.细胞、试剂与仪器:人正常肝细胞系THLE-3和肝癌细胞系HepG2购于美国ATCC公司。RPMI1640培养基、胎牛血清和胰蛋白酶购于美国Hyclone公司,AKT2和GAPDH抗体购于美国Santa Cruz公司,p-mTOR抗体、mTOR抗体、S6抗体和p-S6抗体购于美国Cell Signaling公司。噻唑蓝(MTT)试剂购于美国Sigma公司,放射免疫沉淀法(RIPA)裂解液、反转录试剂盒、二喹啉甲酸(BCA)蛋白检测试剂盒购于上海碧云天生物公司,TRIzol试剂购于日本TaKaRa公司,脂质体2000转染试剂购于美国Invitrogen公司,miR-29c模拟物(mimics)、miR-29c抑制剂(inhibitor)及相应的阴性对照购于上海吉玛公司。慢病毒载体颗粒AKT2 shRNA和无功能杂乱(Scrambled)shRNA由上海生工生物构建,pcDNA3.1/myc-HisA质粒和AKT2基因重组质粒由美国Invitrogen构建。Dual Luciferase报告基因检测系统购于北京Promega公司。PRIMUS-M型医用直线加速器购于德国西门子公司,酶联免疫检测仪购于奥迪利Anthos公司。
2.细胞培养:采用快速融合法将冻存的THLE-3和HepG2细胞融化,将细胞悬液转入加有10%胎牛血清的RPMI 1640培养基中,以1 000 r/min、离心半径10 cm离心5 min后,弃培养液,加入新的培养液,轻轻吹打制备单细胞悬液。以移液枪将无菌的细胞悬液转入培养瓶中,置于5%CO2的37℃恒温培养箱中培养,待细胞完全贴壁后,加入质量浓度为2.5 g/L的胰蛋白酶消化传代。
3. RT-PCR检测:收集对数生长期的待测细胞,根据TRIzol试剂说明书提取细胞总RNA。以定量(核酸浓度检测仪检测总RNA浓度)后的RNA为模板,严格参照试剂盒说明书步骤反转录合成PCR扩增所需的模板链cDNA。PCR反应条件如下:95℃下预变性60 s(循环数1)、95℃下变性30 s(循环数35)、56℃下退火30 s(循环数35)、72℃下延伸30 s(循环数35)。miR-29c的上游引物为5′CGATTTCTCCTGGTGTTCA3′,下游引物为5′ACCGATTTCAAATGGTGC3′;U6的上游引物为5′CTCGCTTCGGCAGCACA3′,下游引物为5′AACGCTTCACGAATTTGCGT3′;均由上海吉玛公司合成,以U6作内参,2-△△Ct法检测miR-29c表达。
4.细胞转染:取对数生长期HepG2细胞,将其分为空白对照组、过表达miR-NC组、过表达miR-29c组、阴性对照组、抑制miR-29c组,其中未做转染的HepG2细胞为空白对照组,转染miR-29c mimics阴性对照/miR-29c inhibitor阴性对照的HepG2细胞为过表达miR-NC组/阴性对照组,而转染miR-29c mimics /miR-29c inhibitor的HepG2细胞为过表达miR-29c组/抑制miR-29c组。将HepG2细胞于5% CO2的37℃恒温培养箱中培养。待细胞融合度达70%左右时,严格参照转染试剂脂质体2000的说明书步骤按照实验分组进行转染。转染48 h后,分别以克隆形成实验和MTT实验检测各组细胞存活率和细胞活力。后期实验分别将慢病毒载体颗粒AKT2 shRNA和Scrambled shRNA转染至HepG2细胞中,分别标记为沉默AKT2组和沉默对照组;转染pcDNA3.1 /myc-HisA质粒和AKT2基因重组质粒的细胞分别标记为过表达对照组和过表达AKT2组,采用Western blot检测各组细胞中AKT2蛋白的表达。
5.细胞照射:采用6 MV X射线照射,其中吸收剂量率200 cGy/min,照射野面积20 cm×20 cm,固定源皮距100 cm。
6.克隆形成实验:取待测的THLE-3或HepG2细胞,加入胰蛋白酶消化后,制备浓度为3×103个/ml的单细胞悬液,以每孔2 ml种植于6孔细胞板上,于细胞培养箱中培养过夜。室温下,以6 MV X射线垂直照射,照射剂量分别为0、2、4、6和8 Gy。照射结束后,继续培养9 d后终止培养,弃培养液后,常温下每孔加入3 ml甲醇,固定10 min后,弃固定液,加入3 ml姬姆萨染液染色20 min。显微镜下观察细胞的克隆形成率,其中以>50个细胞记为有效克隆,以克隆数与接种细胞数的百分比表示克隆形成率(PE),以克隆数/(PE×接种细胞数)表示存活分数(SF)。根据多靶单击模型拟合细胞存活曲线。
7. MTT实验:收集待测的HepG2细胞,以胰蛋白酶消化调整细胞浓度为5×104个/ml,以每孔100 μl接种至96孔细胞板上,并设置无细胞的空白孔(只含培养液)。于细胞培养箱内培养48 h。加入20 μl MTT溶液(5 mg/ml)反应4 h后,再加入150 μl二甲基亚枫(DMSO)。待MTT晶体充分溶解后,以酶联免疫检测仪测定各组细胞在570 nm波长处的吸光度(A)值。按照如下公式计算各组细胞活力。细胞活力(%)=(A实验孔- A空白孔)/(A对照孔- A空白孔)×100%。
8.双荧光素酶报告基因实验:根据TargetScan靶基因预测软件预测AKT2可能是miR-29c的靶基因。为了验证这一靶向关系,构建了野生型(AKT2-Wt)和突变型(AKT2-Mut)的AKT2 3′UTR荧光素酶报告载体,分别与miR-NC/anti-miR-NC和miR-29c mimic/miR-29c inhibitor共转染HepG2细胞48 h后,采用Dual Luciferase报告基因检测系统检测各处理组HepG2细胞的双荧光素酶活性。
9. Western blot检测:收集空白对照组、miR-NC组/anti-miR-NC组和miR-29c组/anti-miR-29c组细胞,加入RIPA细胞裂解液裂解细胞,1 000 r/min,离心半径10 cm离心5 min收集总蛋白。以BCA法定量后,上样至SDS-PAGE凝胶中进行电泳分离。电泳完毕后,以半干法转至PVDF膜上。37℃下,经含5%脱脂奶粉封闭1.5 h后,加入AKT2抗体(1 :200)、p-mTOR抗体(1 :500)、mTOR抗体(1 :500)、S6抗体(1 :1 000)、p-S6抗体(1 :1 000)和GAPDH抗体(1 :500),4℃下孵育24 h。以每次5 min封闭液洗涤3次后,加入1 :1 000倍稀释的辣根过氧化酶表达的二抗37℃下孵育1 h。暗室内,滴加ECL显影液显影后,凝胶成像系统扫描,以GAPDH为内参,Quantity One V4.62软件分析AKT2蛋白的表达。
10.统计学处理:数据符合正态分布以x±s形式表示。采用SPSS 22.0进行数据分析。多组间比较经方差齐性检验后使用单因素方差分析,组间多重比较采用SNK-q检验,两组间比较采用独立样本t检验。P < 0.05为差异有统计学意义。
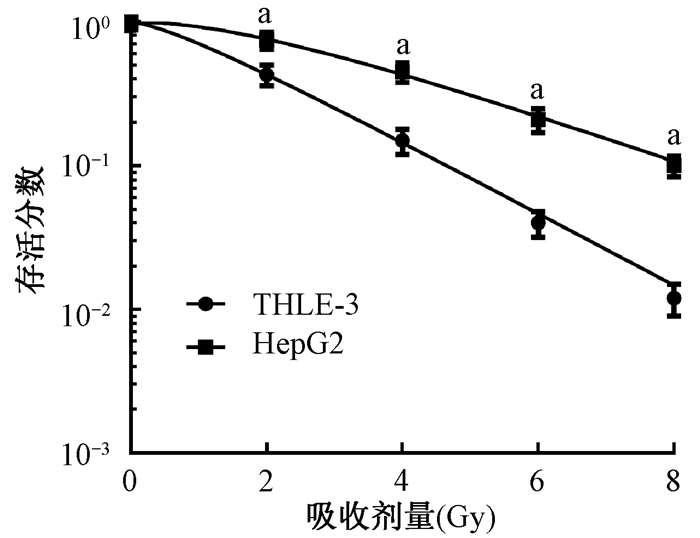
结果1.照射诱导HepG2细胞中miR-29c表达降低:RT-PCR检测结果显示,肝癌细胞HepG2中miR-29c表达(0.31±0.03)较正常肝细胞THLE-3中miR-29c表达(1.00±0.06)明显降低(t=17.816,P < 0.05)。克隆形成实验检测结果显示,肝癌细胞HepG2不同剂量(2、4、6和8 Gy)X射线照射后,细胞存活率较正常肝细胞THLE-3显著降低(t=4.541、6.823、7.218、9.363,P < 0.05),见图 1。以不同剂量(2、4、6和8 Gy)X射线照射24 h后,HepG2细胞中miR-29c表达分别为0.68±0.07、0.54±0.05、0.48±0.05和0.46±0.05较空白对照组1.00±0.07显著下降(t=5.599、9.262、10.470、10.873,P < 0.05)。
|
注:a与THLE-3相比,t=4.541、6.823、7.218、9.363,P < 0.05 图 1 HepG2和THLE-3细胞的存活曲线 Figure 1 Survival curve of HepG2 and THLE-3 cells |
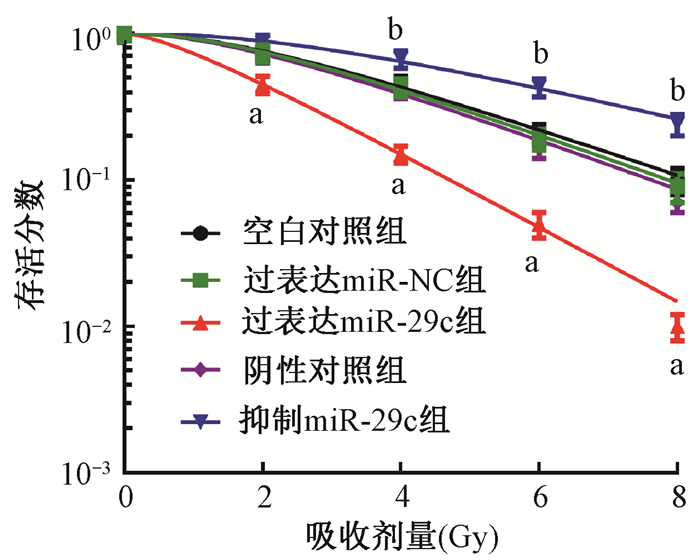
2. miR-29c增加HepG2细胞的放射敏感性:克隆形成实验检测结果如图 2所示,过表达miR-29c组细胞的存活率较对照组明显降低(t=4.307、7.668、7.668、6.894,P < 0.05),放射增敏比SER为1.490;抑制miR-29c组细胞的存活率较阴性对照组明显升高(t=4.003、6.713、7.141,P < 0.05),SER为0.683。MTT实验结果由表 1可见,与相应对照组相比,过表达miR-29c组经不同剂量(2、4、6和8 Gy)X射线照射24 h后细胞活力明显降低(t=3.443、8.116、13.434,P < 0.05),而抑制miR-29c组细胞活力明显升高(t=4.282、5.113,P < 0.05)。
|
注:a与过表达miR-NC组相比,t=4.307、7.668、7.668、6.894,P < 0.05;b与阴性对照组相比,t=4.003、6.713、7.141,P < 0.05 图 2 miR-29c对HepG2细胞存活率的影响 Figure 2 Effect of miR-29c on survival rate of HepG2 |
|
|
表 1 miR-29c对不同剂量照射后HepG2细胞活力的影响(%,x±s) Table 1 Effect of miR-29c on cell viability of HepG2 (%, x±s) |
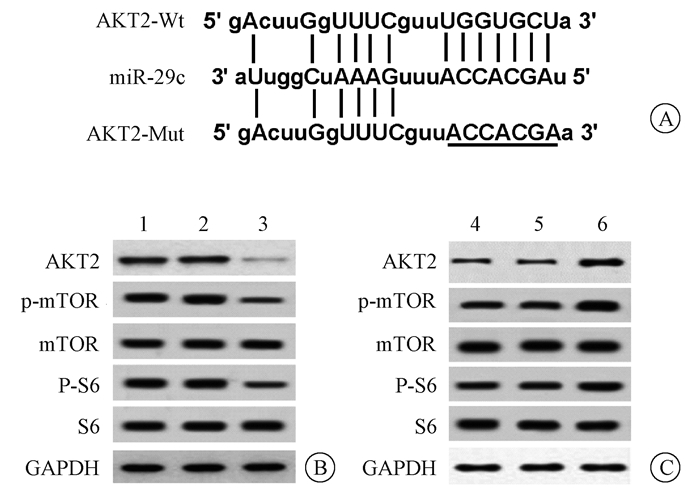
3. AKT2为miR-29c的靶基因:采用TargetScan软件预测发现,AKT2的3′UTR中含有与miR-29c互补的核苷酸序列,见图 3。双荧光素酶报告基因实验结果显示,在HepG2细胞中,过表达miR-29c可显著抑制AKT2 3′UTR的荧光素酶活性(t=11.425,P < 0.05);反之,则显著促进AKT2 3′UTR的荧光素酶活性(t=7.141,P < 0.05),见表 2。Western blot检测结果显示,过表达miR-29c明显抑制HepG2细胞中AKT2及其下游p-mTOR、p-S6蛋白表达(t=15.027、12.050、10.544,P < 0.05),对mTOR和S6蛋白表达无显著影响;而抑制miR-29c则得到相反结果(t=9.722、5.743、4.163,P < 0.05),见图 3和表 2。
|
注:1.空白对照1组;2.过表达miR-NC组;3.过表达miR-29c组;4.空白对照2组;5.阴性对照组;6.抑制miR-29c组 图 3 AKT2与miR-29c靶向关系的验证结果 A. AKT2的3′UTR与miR-29c互补的核苷酸序列;B.过表达miR-29c对AKT2及其下游蛋白表达的影响;C.抑制miR-29c对AKT2及其下游蛋白表达的影响 Figure 3 Verification of relationship between AKT2 and miR-29c A. Complementary nucleotide sequences between the 3′UTR of AKT2 and miR-29c; B. Effect of overexpression of miR-29c on the expression of AKT2 and its downstream protein; C. Effect of inhibition of miR-29c on the expression of AKT2 and its downstream protein |
|
|
表 2 各组细胞中HepG2细胞的活力表达(%,x±s) Table 2 Effect of miR-29c on cell viability of HepG2(%, x±s) |
4.构建沉默和过表达AKT2的HepG2细胞株:Western blot检测发现,沉默AKT2组细胞中AKT2蛋白的表达(0.14±0.01)较沉默对照组(0.81±0.08)明显降低(t=14.394,P < 0.05);过表达AKT2组细胞中AKT2蛋白的表达(1.45±0.15)较过表达对照组(0.36±0.04)明显升高(t=12.161,P < 0.05),见图 4。

|
注:1.沉默对照组;2.沉默AKT2组;3.过表达对照组;4.过表达AKT2组 图 4 Western blot检测沉默和过表达AKT2后HepG2细胞中AKT2蛋白表达 A. AKT2沉默;B. AKT2过表达 Figure 4 Western blot assay of the expression of AKT2 protein in HepG2 cells after silencing and overexpressing AKT2 A. AKT2 silence; B. AKT2 overexpression |
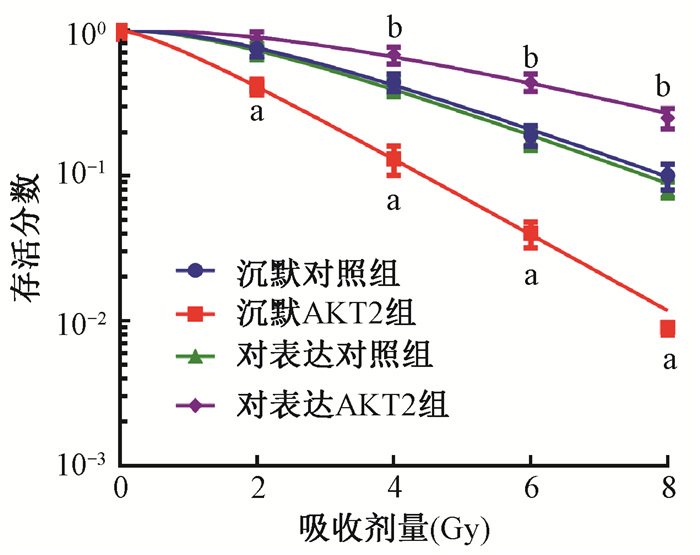
5. AKT2对HepG2放射敏感性的影响:克隆形成实验检测发现,沉默AKT2后,HepG2细胞的存活率显著降低(t=5.720、8.004、8.368、7.871,P < 0.05),SER为1.542,与过表达miR-29c相吻合,见图 5和表 3;反之,过表达AKT2则使HepG2细胞存活率明显升高(t=4.323、6.713、7.141,P < 0.05),SER为0.688,这一结果与抑制miR-29c相一致,见图 5和表 3。MTT检测发现,沉默AKT2促进照射对HepG2细胞活力的抑制作用(t=5.114、11.014、12.873,P < 0.05);反之,过表达AKT2则逆转了照射对HepG2细胞活力的抑制作用(t=4.445、6.104,P < 0.05),结果见表 3。
|
注:a与沉默对照组相比,t=5.720、8.004、8.368、7.871,P < 0.05;b与过表达对照组相比,t=4.323、6.713、7.141,P < 0.05 图 5 AKT2对HepG2细胞存活率的影响 Figure 5 Effect of AKT2 on survival rate of HepG2 |
|
|
表 3 不同剂量照射后AKT2对HepG2细胞活力的影响(%,x±s) Table 3 Effect of AKT2 on cell viability of HepG2 (%, x±s) |
讨论
在肿瘤的发生发展过程中,miRNAs异常表达不仅与肿瘤细胞的恶性发展有关,还与肿瘤细胞的放射抵抗效应关系密切。胶质瘤细胞中miR-212的表达升高有助于减弱辐射诱导的肿瘤细胞凋亡和细胞对照射的抗性[10];在照射后的结直肠癌患者细胞和血液中miR-214明显降低,细胞自噬增强;miR-214过表达可通过靶向抑制ATG12介导的自噬促进肿瘤细胞的放射敏感性[11];miR-22在乳腺癌细胞中表达下调,其过表达可通过靶向SIRT1抑制乳腺癌细胞活力、诱导细胞凋亡并提高肿瘤细胞的放射敏感性[12]。当然,肝癌细胞的放射抵抗机制也与miRNAs表达有关。如miR-122过表达可通过调节HIF-1α、ROS、BCL-2、Bax及Bim表达提高肝癌细胞HepG2的放射敏感性[13]。肝癌是一种常见的肝脏恶性肿瘤,放射是中晚期肝癌重要的治疗手段,但放射抵抗效应一直是影响治疗的重要原因。寻找有效的分子靶点或放疗增敏剂对提高肝癌的放射治疗效果具有重要意义。miR-29c是早先从神经细胞中发现的miRNA,可调控细胞分化、增殖、迁移、凋亡和信号通路等参与肿瘤的发生与发展[14]。miR-29c在胰腺癌组织和细胞中下调,其过表达可通过靶向调控ITGB1抑制肿瘤细胞的增殖、迁移和侵袭[15];胃癌中,miR-29c可能靶向AMPK/mTOR信号通路调控胃癌细胞的增殖、侵袭[16];肺癌中,重组miR-29c可通过激活细胞凋亡和下调靶基因Bcl-2、MCL-1表达克服辐射抗性[17]。miR-29c在肝癌组织中低表达,与组织学分级、肿瘤分期、微血管侵润和总生存期缩短等有关,与肝癌的发生发展密切相关,且其表达受电离辐射的影响,但其对肝癌放射敏感性的影响并不明确[5-7]。本研究中,以肝癌HepG2细胞为研究对象,通过明确miR-29c在HepG2细胞中低表达后,给予X射线照射后发现,HepG2细胞中miR-29c表达明显降低。转染miR-29c mimics上调miR-29c表达后,HepG2细胞的存活分数和细胞存活率均降低;反之,转染miR-29c inhibitor抑制miR-29c表达后,HepG2细胞的存活分数和细胞存活率均升高。结果提示,miR-29c在肝癌的放射抵抗过程中发挥着重要的调控作用。
PI3K/AKT信号通路是细胞内经典的转导通路,可参与肿瘤细胞的增殖、凋亡、转移和血管生成等过程,该通路的活化在肝癌的发生发展发挥着重要的促进作用[18-19],靶向干扰或抑制该途径有望成为肿瘤治疗的放射增敏剂[20];AKT2是AKT的一种亚型,也是PI3K/Akt细胞信号通路中重要调控因子,其活化与多种肿瘤细胞的形成、发展及放射抵抗有关。如:结直肠癌中,AKT缺失通过调控MTS1表达抑制肿瘤细胞的增殖和转移[21];抑制卵巢癌中AKT2表达后,能够明显抑制癌细胞的增殖,促进细胞凋亡并增强肿瘤细胞的放射敏感性[22]。为了进一步探讨miR-29c调控肝癌的放射敏感性的分子机制,通过生物信息学预测,双荧光素酶报告基因实验和Western blot检测验证发现AKT2是miR-29c的靶基因。猜测miR-29c可能通过靶向调控AKT2表达参与调控肝癌的放射敏感性。为了验证这一猜想,通过构建AKT2沉默或过表达的HepG2细胞株,观察其对HepG2细胞放射敏感性的影响。结果发现,沉默AKT2后,HepG2细胞的存活分数降低,细胞活力减弱,这与过表达miR-29c相吻合;反之,AKT2过表达则使HepG2细胞存活分数升高,细胞活力增强,与抑制miR-29c相一致。这与Sun等[9]得出miR-29c可通过靶向调控AKT2参与肺癌的顺铂耐药机制相吻合。提示,miR-29c可通过靶向AKT2参与调控肝癌的放射敏感性。
综上所述,miR-29c在肝癌的放射抵抗机制中发挥着重要作用,其在放射过程中低表达,上调其表达可通过靶向调控AKT2增加肝癌细胞HepG2放射敏感性。这一结果为提高肝癌的放射治疗效果提供了新的线索和靶点。
利益冲突 所有作者共同认可文章内容,不涉及相关利益冲突作者贡献声明 黄长山、叶柯负责实验设计;余伟、谢毅负责数据分析整理;王谦负责实施及论文的撰写
| [1] |
杨世荣, 王嵘, 柴丽霞, 等. 艾迪注射液联合三维适形放疗治疗中晚期原发性肝癌临床观察[J]. 陕西中医, 2017, 38(11): 1495-1496. Yang SR, Wang R, Chai LX, et al. Clinical observation of Aidi injection combined with three-dimensional conformal radiotherapy in the treatment of advanced primary liver cancer[J]. Shaanxi Traditional Chin Med, 2017, 38(11): 1495-1496. DOI:10.3969/j.issn.1000-7369.2017.11.003 |
| [2] |
Niu M, Gao D, Wen Q, et al. MiR-29c regulates the expression of miR-34c and miR-449a by targeting DNA methyltransferase 3a and 3b in nasopharyngeal carcinoma[J]. BMC Cancer, 2016, 16(1): 218. DOI:10.1186/s12885-016-2253-x |
| [3] |
Cheung A, Li B, Xu W, et al. miR-29c modulates chemoresistance in esophageal cancer cells by suppressing FBXO31[J]. Eur J Cancer, 2016, 61(1): S64. DOI:10.1016/S0959-8049(16)61222-4 |
| [4] |
刘南京, 李婷, 赵燕, 等. miR-29c促进前列腺癌PC3细胞凋亡[J]. 基础医学与临床, 2017, 37(12): 1706-1711. Liu NJ, Li T, Zhao Y, et al. miR-29c promotes apoptosis of PC3 cells in prostate cancer[J]. Basic Clin Med, 2017, 37(12): 1706-1711. DOI:10.3969/j.issn.1001-6325.2017.12.009 |
| [5] |
Dong CW, Wang YX, Du FT, et al. Low miR-29c expression is a prognostic marker in hepatocellular carcinoma[J]. Genet Mol Res, 2016, 15(3): 2456-2467. DOI:10.4238/gmr.15037316 |
| [6] |
Bae HJ, Noh JH, Kim JK, et al. MicroRNA-29c functions as a tumor suppressor by direct targeting oncogenic SIRT1 in hepatocellular carcinoma[J]. Oncogene, 2014, 33(20): 2557-2567. DOI:10.1038/onc.2013.216 |
| [7] |
Wang B, Li D, Sidler C, et al. A suppressive role of ionizing radiation-responsive miR-29c in the development of liver carcinoma via targeting WIP1[J]. Oncotarget, 2015, 6(12): 9937-9950. DOI:10.18632/oncotarget.3157 |
| [8] |
Yu Y, Qian L, Du N, et al. Ganoderma lucidum polysaccharide enhances radiosensitivity of hepatocellular carcinoma cell line HepG2 through Akt signaling pathway[J]. Exp Ther Med, 2017, 14(6): 5903-5907. DOI:10.3892/etm.2017.5340 |
| [9] |
Sun DM, Tang BF, Li ZX, et al. MiR-29c reduces the cisplatin resistance of non-small cell lung cancer cells by negatively regulating the PI3K/Akt pathway[J]. Sci Rep, 2018, 8(1): 8007. DOI:10.1038/s41598-018-26381-w |
| [10] |
He X, Fan S. hsa-miR-212 modulates the radiosensitivity of glioma cells by targeting BRCA1[J]. Oncol Reports, 2018, 39(3): 977-984. DOI:10.3892/or.2017.6156 |
| [11] |
Hu JL, He GY, Lan XL, et al. Inhibition of ATG12-mediated autophagy by miR-214 enhances radiosensitivity in colorectal cancer[J]. Oncogenesis, 2018, 7(2): 16. DOI:10.1038/s41389-018-0028-8 |
| [12] |
Zhang X, Li Y, Wang D, et al. miR-22 suppresses tumorigenesis and improves radiosensitivity of breast cancer cells by targeting Sirt1[J]. Biol Res, 2017, 50(1): 27. DOI:10.1186/s40659-017-0133-8 |
| [13] |
许刚, 王燕, 吴立广, 等. miR-122对肝癌细胞HepG2放疗敏感性影响及其机制研究[J]. 中华肿瘤防治杂志, 2017, 24(16): 1130-1136. Xu G, Wang Y, Wu LG, et al. Effect of miR-122 on radiosensitivity of hepatocellular carcinoma cell line HepG2 and its mechanism[J]. Chin J Cancer Prevent Treat, 2017, 24(16): 1130-1136. |
| [14] |
张姣, 宋雷雷, 赵亚萍, 等. miR-29参与恶性肿瘤发生发展的研究进展[J]. 医学研究杂志, 2013, 42(11): 172-174. Zhang J, Song LL, Zhao YP, et al. Advances in the study of microRNA-29 in the occurrence and development of malignant tumors[J]. J Med Res, 2013, 42(11): 172-174. |
| [15] |
Lu Y, Hu J, Sun W, et al. MiR-29c inhibits cell growth, invasion, and migration of pancreatic cancer by targeting ITGB1[J]. Onco Targets Ther, 2016, 9: 99-109. DOI:10.2147/OTT.S92758 |
| [16] |
魏耕富, 王健生, 马智, 等. miR-29c靶向调控AMPK/mTOR信号通路对胃癌细胞生物学行为的影响[J]. 解放军医药杂志, 2017, 29(12): 10-12, 24. Wei GF, Wang JS, Ma Z, et al. The effects of microRNA-29c targeting AMPK/mTOR signaling pathway on the biological behavior of gastric cancer cells[J]. PLA J Med, 2017, 29(12): 10-12, 24. DOI:10.3969/j.issn.2095-140X.2017.12.003 |
| [17] |
Arechaga-Ocampo E, Lopez-Camarillo C, Villegas-Sepulveda N, et al. Tumor suppressor miR-29c regulates radioresistance in lung cancer cells[J]. Tumour Biol, 2017, 39(3): 1010428317695010. DOI:10.1177/1010428317695010 |
| [18] |
Nan Z, Pan L, Anesthesiology DO, et al. Mechanism of ibuprofen regulating migration and invasion of liver cancer QGY-7703 cells through PI3K/Akt/mTOR signaling pathway[J]. Cancer Res Prevent Treat, 2016, 43(12): 1035-1038. DOI:10.3971/j.issn.1000-8578.2016.12.005 |
| [19] |
Fu X, Liu M, Qu S, et al. Exosomal microRNA-32-5p induces multidrug resistance in hepatocellular carcinoma via the PI3K/Akt pathway[J]. J Exp Clin Cancer Res, 2018, 37(1): 52. DOI:10.1186/s13046-018-0677-7 |
| [20] |
Goda JS, Pachpor T, Basu T, et al. Targeting the AKT pathway:Repositioning HIV protease inhibitors as radiosensitizers[J]. Indian J Med Res, 2016, 143(2): 145-159. DOI:10.4103/0971-5916.180201 |
| [21] |
Agarwal E, Robb CM, Smith LM, et al. Role of Akt2 in regulation of metastasis suppressor 1 expression and colorectal cancer metastasis[J]. Oncogene, 2017, 36(22): 3104-3118. DOI:10.1038/onc.2016.460 |
| [22] |
孙冬岩, 翁丹卉, 宋晓红, 等. RNAi抑制Akt2基因表达对卵巢癌细胞系A2780放射敏感性的影响[J]. 中国癌症杂志, 2008, 18(2): 96-100. Sun DY, Weng DH, Song XH, et al. Effects of RNAi on radiosensitivity of ovarian cancer cell line A2780 by inhibiting Akt2 gene expression[J]. Chin J Cancer, 2008, 18(2): 96-100. DOI:10.3969/j.issn.1007-3639.2008.02.004 |
 2019, Vol. 39
2019, Vol. 39
