2. 西南医院肿瘤放疗科, 重庆 400038
2. Department of Radiation Oncology, Southwest Hospital, Army Medical University, Chongqing 400038, China
放射性肺损伤(radiation-induced lung injury)是多种胸部肿瘤放射治疗、核辐射损伤的常见并发症,表现为早期的放射性肺炎(radiation pneumonitis,RP)和晚期的放射性肺纤维化(radiation fibrosis,RF),后者是一不可逆的病变[1-2],目前尚无有效的防治方法,是致死的主要原因及治疗难题[3]。近年来干细胞成为许多难治性疾病的希望,但存在来源、免疫及其伦理等问题,自体干细胞动员则避免了上述困扰。正常情况下外周血循环内的干细胞含量极低,在损伤、应急等条件下,其数量可明显增多,但并不能满足严重损伤时器官组织修复的需要。应用干细胞动员剂进行骨髓干细胞动员则可显著提高外周血中的干细胞数目,这些干细胞不但可迁移定植于损伤部位直接参与损伤组织的修复,还可通过调节免疫及炎症反应等促进组织修复[4]。粒细胞集落刺激因子(G-CSF)是目前常用及效果最好的骨髓干细胞动员剂之一[5],可同时动员造血和间充质干细胞(MSCs)[4-5]。本课题组前期小鼠颅脑损伤研究中发现,采用G-CSF动员后小鼠骨髓和外周血MSCs的成纤维集落形成单位(CFU-F)数量显著高于对照,而创伤区域的微环境能趋化MSCs在创面的优势定植、分布,有效参与创伤修复,显著降低了严重颅脑创伤小鼠的死亡[6]。对心血管、肝脏和神经系统等损伤的修复作用也有研究证实[6-9]。本研究拟用G-CSF辐照前进行骨髓干细胞动员,通过组织学观察及图像分析等方法研究自体干细胞动员在放射性肺损伤中的防治作用。
材料与方法1.实验动物与试剂:雄性SPF级C57 BL/6小鼠75只,6~8周龄,体质量(20±2)g,由陆军军医大学野战外科研究所动物实验中心提供。重组人粒细胞集落刺激因子(rhG-CSF,济南齐鲁制药公司),戊巴比妥钠(天津光复精细化工研究所),Masson染色试剂盒(北京中杉生物技术有限公司),天狼猩红染液为本室配制。
2.实验动物分组:75只实验小鼠采用随机数表法分为健康对照组25只、单纯照射组25只、照射+自体干细胞动员组(治疗组)25只,保证每组各时相点最终取材为6只动物。治疗组小鼠于照射前1~5 d,每天固定时间一次性给予腹部皮下注射rhG-CSF 250 μg·kg-1d-1,连续5 d,健康对照组小鼠给予相同剂量的生理盐水。
3.小鼠肺放射模型的建立:小鼠以1%戊巴比妥钠(45 mg/kg)腹腔注射麻醉后,腹面朝上依次排列并以胶带固定于有机玻璃板上,10只/次,采用高性能医用直线加速器(Varian 2300C/D型, 美国Varian公司),以6~8 MV X射线(剂量率1.8 Gy/min)照射,照射野为1 cm ×1 cm,源皮距(SSD)=100 cm,单次照射剂量14 Gy,经前胸照射全肺建立放射性肺损伤动物模型。
4.取材及标本处理:受照后小鼠常规喂饲,逐日动态观测动物一般状况如精神、活动度、进食及排便状态以及呼吸频率、体重、体表毛发变化等情况,记录动物死亡情况并测算死亡率。致伤后主要于3和4个月两个时间点取材。实验小鼠称取体重(g)后麻醉,经眼球取血约1.5 ml左右,4℃下静置待凝固后3 500 r/min,离心半径为13.5 cm,离心5 min取上清,-70℃储藏备用。取两肺称湿重(mg),左肺整叶经10%中性甲醛溶液固定后以作常规石蜡包埋制片,取右肺于-70℃储存备用。同时取骨髓、心脏等组织,于10%中性甲醛固定。
5.小鼠肺系数计算:根据小鼠体重及肺湿重,按下述公式计算肺系数。肺系数=肺湿重(mg)/体重(g)。
6.小鼠肺组织学及特殊染色观察:留取的组织经固定后石蜡包埋,4~5 μm切片,常规HE染色并按相关试剂盒说明行Masson、天狼猩红染色,普通光学显微镜下观察,摄像。Masson染色胶原纤维呈蓝色,天狼猩红染色胶原纤维呈红色,细胞核呈绿色,其他成分呈黄色。
7.小鼠肺组织学损伤程度评分:参照孙万良等[10]和Hübner等[11]方法进行肺组织肺泡炎及肺纤维化程度评分。对HE染色每组每张切片上的所有视野进行观察,对每个视野内肺组织病理变化作记录及评分,计算每个时相点的评分(每个视野肺损伤的平均评分)。
肺泡炎评分标准:0分,无炎细胞浸润,肺泡结构完整,肺泡隔无增宽;1分,肺间隔增宽,炎细胞浸润,肺泡腔渗出及出血,病变 < 视野的20%;2分,炎症病变范围为20%~50%;3分,肺组织结构紊乱,肺泡塌陷,肺泡隔明显增宽融合,大量渗出及炎症细胞浸润,局部肺实变,病变范围>50%。
肺纤维化评分标准为:0级,正常肺;1级,孤立的肺泡隔轻微的纤维化改变(肺泡隔增宽但 < 3倍正常);2级,肺泡隔出现结节样的纤维化改变(>3倍正常肺泡隔, 纤维化结节未连续; 部分肺泡增大);3级,肺泡隔出现连续的纤维化墙(整个视野肺泡隔>3倍正常);4级,出现单个纤维化团块(< 10%视野);5级,出现融合的纤维化团块(10%~50%视野);6级,大的、连续的纤维化团块存在(>50%视野);7级,纤维化区域中存在少量气泡(无肺泡隔存在,肺泡几乎由纤维团块闭塞但仍见5个以上的肺泡);8级,完全纤维性闭塞。评分按相应级别计算。
8.小鼠肺组织天狼猩红胶原染色偏振光观测:天狼猩红胶原染色按本室常规方法进行, 切片进一步于偏振光显微镜下观察(Ⅰ型胶原为具强双折光性红黄色荧光粗纤维, Ⅲ型胶原为弱双折光性绿色细纤维,在相同曝光等一致性条件下摄像,每组每例随机拍摄5个肺泡区视野。采用图像分析软件Image Pro-Plus(Version 6.0,美国Media Cybernetics公司),分析测定显色的纤维含量,参数设定:阳性面积(area)和积分光密度(IOD)。
9.统计学处理:数据符合正态分布,用x±s表示。用SPSS 13.0软件,对实验中所有计量数据的多组数据比较经方差齐性检验后采用单因素ANOVA方差分析,组间两两比较采用LSD法。P < 0.05为差异有统计学意义。
结果1.小鼠一般情况及死亡率:照射后各组动物精神活动等一般情况不佳,以1~2周内明显,此后精神、动度及饮食逐渐改善。3个月时照射后各组动物体重均较健康对照组轻(F=18.92,P < 0.05),但治疗组体重仍较单纯照射组高(P < 0.05),4个月体重增加,变化趋势同前(F=41.47,P < 0.05),见表 1。单纯照射组动物死亡率为37.5%,死亡时间主要发生在照后11周,而治疗组无一死亡。
|
|
表 1 各组小鼠不同时间体重变化(g,x±s) Table 1 The changes of mice weight after radiation injury(g, x±s) |
2.小鼠肺系数改变:小鼠受照后3个月肺系数较健康对照组明显增大(F=23.2,P < 0.05),但治疗组较单纯照射组小,两组间差异有统计学意义(P < 0.05),见表 2。
|
|
表 2 各组小鼠照射后不同时间肺系数变化(mg/g,x±s) Table 2 The changes of mice lung index after radiation injury(mg/g, x±s) |
3.小鼠肺组织学变化:小鼠胸部辐照后3个月,单纯照射组主要表现肺组织上皮、血管内皮等细胞为主的变性、坏死,吞噬细胞、淋巴细胞浸润为主的间质炎性反应,有的区域肺泡腔内可见大量吞噬脂质的泡沫细胞集聚,肺泡隔部分细胞(成纤维细胞为主)增生及局灶性纤维沉积,Masson及天狼猩红染色可见局灶性的蓝或红色胶原,局部见肺萎陷及肺大泡形成。治疗组也见肺组织细胞的变性、坏死等损伤伴肺间质炎及细胞、纤维增生等病理改变,但损伤及炎症反应、纤维增生的程度较均单纯照射组为轻,Masson及天狼猩红染色蓝色或红色胶原较少(图 1)。4个月时单纯照射组及治疗组肺泡及间质炎已明显减轻,但纤维增生及胶原沉积增加,Masson及天狼猩红染色蓝色或红色胶原较3月明显增多,肺泡隔明显增宽,部分肺泡条索化;与单纯照射组相比,治疗组肺泡隔增宽、纤维增生及胶原沉积程度则较轻(图 2)。本研究中照后3、4个月是主要观测点,但在整个观测过程中发现照射后2个月肺组织虽然呈现以肺上皮、血管内皮细胞为主的损伤伴炎症反应等病理改变,但已可见纤维增生,此后3个月增多,4个月时更为明显,至7月时纤维增生越加显著。
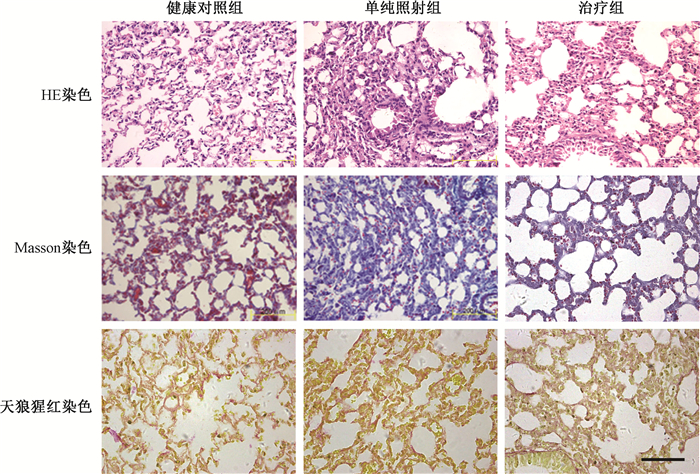
|
图 1 损伤后3个月小鼠肺病理学观察 ×200 Figure 1 The pathological images of mice lung at 3 months after radiation injury ×200 |
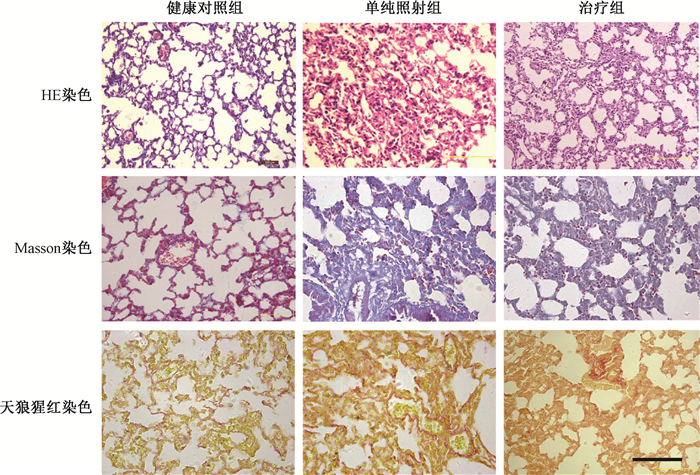
|
图 2 损伤后4个月的小鼠肺病理学观察 ×200 Figure 2 The pathological images of mice lung at 4 months after radiation injury ×200 |
4.小鼠肺组织学损伤程度评分:结果见表 3。照射后肺泡炎在3个月时评分最高,4个月减轻,3个月时单纯照射组、治疗组均与健康对照组存在差异(F=11.93,P < 0.05),纤维化评分在3、4个月时相点单纯照射组、治疗组均较健康对照组升高(F=28.73,16.85,P < 0.05),但治疗组较单纯照射组降低,4个月时存在差异(P < 0.05)。
|
|
表 3 各组小鼠不同时间肺损伤组织学肺泡炎评分及纤维化评分(x±s) Table 3 Histological scoring of pneumonitis and lung fibrosis after radiation injury(x±s) |
5.小鼠肺组织胶原含量改变:天狼猩红染色后偏振光显微镜下观察见随着照射后时间的增加,肺泡隔内呈红黄色粗纤维的Ⅰ型胶原,绿色细纤维的Ⅲ型胶原逐步增多,特别是Ⅰ型胶原最为明显,单纯照射组较治疗组更为多见,更为粗大。照射后各组胶原测定的阳性面积(Area)及积分光密度(IOD)值均较健康对照组升高,差异均有统计学意义(Area:F3个月=17.17,F4个月=18.17,P < 0.05;IOD:F3个月=17.7,F4个月=17.79,P < 0.05),而治疗组增加量在两个时相点则较单纯照射组明显降低,差异有统计学意义(P < 0.05,见表 4)。
|
|
表 4 小鼠肺组织胶原含量分析测定(x±s) Table 4 The collagen contents in mice lung(x±s) |
讨论
放射性肺损伤的发生机制主要在于电离辐射导致的肺上皮、内皮细胞为主的细胞变性、坏死,引发间质性肺炎的发生,继而出现损伤,对炎症刺激反应的细胞、纤维增生,终至形成不可逆的肺纤维化病变;因此减少肺组织损伤,促进其再生、修复从而降低纤维化的发生是防治该病的关键环节。对干细胞特别是骨髓干细胞的研究应用为放射性肺损伤防治开辟了新思路,通过自体骨髓干细胞的动员来进行损伤的修复更具有实用性。
G-CSF属于生长因子家族,Hofer等[12]发现其可促进骨髓中特定的干细胞群向中性粒细胞分化并调节其功能与分布,进而研究发现其能刺激造血细胞增生,诱导单核/巨噬细胞成熟并抗细胞凋亡,在射线诱导的骨髓抑制中发挥重要意义,以后证实了G-CSF具有同时动员骨髓造血干细胞和间充质干细胞的能力[13-14]。而近年的研究发现间充质干细胞(MSCs)具有较强的多系分化潜能及低的免疫原性和旁分泌特性而更加受到青睐。由于G-CSF具有强的骨髓干细胞动员能力,用其进行动员后,可将骨髓干细胞池中的干细胞动员入外周血形成外周血干细胞,人体外周血干细胞可增加数十倍,小鼠甚至可达120倍,从而有可能参与损伤组织的修复,这在心血管、肝脏和神经系统等损伤修复中已得到验证[7-9],但也存在争议,如MSCs来源于中胚层细胞群体,其与纤维化形成的细胞具有相同的背景和来源,而且其中可能就存在成纤维细胞、移植或者动员是否会更加重纤维化的问题。研究表明,干细胞移植或者动员的时间是关键因素之一[15-16]。在急性损伤的窗口期进行移植或者动员,才能促使MSCs向修复受损的组织方向进行,反之则参与纤维修复加重纤维化的发展。因此有理由推测,早期自体干细胞动员对于放射性肺损伤应该有积极防治作用。
本研究采用照射前以G-CSF进行自体干细胞动员,以保证损伤发生的急性期有足够数量的骨髓干细胞进入外周循环,并迅速迁移定植于肺损伤部位发挥效应。本研究结果表明,采用自体干细胞动员后,在实验期无一例动物死亡(本研究观察至照射后7个月,动物依然存活并且状态良好),提示损伤前自体干细胞的动员对放射性肺损伤具有明显的防治效应。动物体重治疗组的改善情况也明显优于单纯照射组。在肺病理组织学上,早期的肺组织变性、坏死、炎症反应变化,后期的纤维及细胞增生、纤维化形成等,治疗组的病变也明显轻于单纯照射组,说明自体干细胞动员无论对减轻辐射导致的早期肺组织损伤、炎症反应还是后期的纤维增生及促再生修复都有积极的作用。认为这可能与G-CSF促进骨髓干细胞池的干细胞进入外周血循环,这些明显增多的干细胞能够很快进入受照的肺组织损伤区域,一方面定植分化为肺上皮细胞等参与修复;另一方面到达损伤区的MSCs通过旁分泌、免疫调节等作用减轻局部炎症及损伤反应,促进肺组织再生修复同时减轻纤维修复过程相关[15],具体机制将在下一步的研究中进行深入探讨。
为进一步量化肺组织损伤程度,本研究通过组织学半定量评分、图像分析等方法以使组织学结果更具可比及可信性。关于肺组织损伤的半定量评分,传统采用的是1988年Ashcroft等[17]提出的8级评分标准及方法进行,但该方法主要是基于人体组织标本建立的,8级标准中缺乏2、4、6级的具体评分细则。Hübner等[11]对此标准进行了补充及细化,以肺泡隔及肺基本结构的损伤为基础,完善了8级不同肺纤维化损伤的评分标准,使之在动物实验及人体标本的研究上更易于观测实施,即使非病理组织学专业研究者,也能够根据该标准及评分细节(包括具体图像标准)进行评估,因此,是一简单有效值得推广的评估方法。本研究采用上述标准进行肺组织学损伤评分,结果发现无论对炎症反应还是纤维化的形成,治疗组病变均较单纯照射组轻。进一步用天狼猩红染色结合图像观测分析的方法验证了治疗组纤维化程度明显较单纯照射组减轻,提示自体骨髓干细胞动员对于放射性肺损伤确实有良好的防治作用,但其具体作用机制还有待研究。
志谢 感谢本所赵娜实验师对本研究提供的优秀技术工作协作利益冲突 无
作者贡献声明 孙慧勤负责实验设计、实验操作、数据整理及论文撰写;王涛、王钰、王锋超、何君、周青、龙爽参与实验研究与操作、部分数据整理;庞学利、冉新泽和粟永萍在实验方案设计,结果分析和论文修改过程中给予指导
| [1] |
Omarini C, Thanopoulou E, Johnston SR. Pneumonitis and pulmonary fibrosis associated with breast cancer treatments[J]. Breast Cancer Res Treat, 2014, 146(2): 245-258. DOI:10.1007/s10549-014-3016-5 |
| [2] |
Huang Y, Zhang W, Yu F, et al. The cellular and molecular mechanism of radiation-induced lung injury[J]. Med Sci Monit, 2017, 23: 3446-3450. DOI:10.12659/MSM.902353 |
| [3] |
Yarnold J, Brotons MC. Pathogenetic mechanisms in radiation fibrosis[J]. Radiother Oncol, 2010, 97(1): 149-161. DOI:10.1016/j.radonc.2010.09.002 |
| [4] |
Tay J, Levesque JP, Winkler IG. Cellular players of hematopoietic stem cell mobilization in the bone marrow niche[J]. Int J Hematol, 2017, 105(2): 129-140. DOI:10.1007/s12185-016-2162-4 |
| [5] |
Reeves G. Overview of use of G-CSF and GM-CSF in the treatment of acute radiation injury[J]. Health Phys, 2014, 106(6): 699-703. DOI:10.1097/HP.0000000000000090 |
| [6] |
邓均, 艾国平, 周桃莉, 等. G-CSF动员循环间充质干细胞及其对小鼠颅脑损伤修复的可行性分析[J]. 第三军医大学学报, 2007, 29(12): 1131-1134. Deng J, Ai GP, Zhou TL, et al. Feasibility of MSCs mobilization by G-CSF and its prosthetic effect in traumatic brain injury[J]. Acta Acad Med Milit Tertiae, 2007, 29(12): 1131-1134. DOI:10.3321/j.issn.1000-5404.2007.12.001 |
| [7] |
D'Amario D, Leone AM, Borovac JA, et al. Granulocyte colony-stimulating factor for the treatment of cardiovascular diseases:An update with a critical appraisal[J]. Pharmacol Res, 2018, 127: 67-76. DOI:10.1016/j.phrs.2017.06.001 |
| [8] |
Jia H, Wang Y, Wang T, et al. Synergistic effects of G-CSF and bone marrow stromal cells on nerve regeneration with acellular nerve xenografts[J]. Synapse, 2017, 71(7): e21974. DOI:10.1002/syn.21974 |
| [9] |
李东良, 何秀华, 范敬静, 等. 骨髓动员与骨髓间充质干细胞移植促进极量肝切除大鼠肝再生作用的对照研究[J]. 解放军医学杂志, 2014, 39(8): 595-600. Li DL, He XH, Fan JJ, et al. A comparison of effects of bone marrow stem cell mobilization and bone marrow mesenchymal stem cell transplantation on the recovery of function and regeneration of rat liver tissue after massive excision of liver[J]. Med J Chin PLA, 2014, 39(8): 595-600. DOI:10.11855/j.issn.0577-7402.2014.08.01 |
| [10] |
孙万良, 张晶, 魏丽, 等. 大鼠放射性肺损伤模型的建立与动态观察[J]. 现代生物医学进展, 2013, 13(26): 5001-5007. Sun WL, Zhang J, Wei L, et al. Establishment of irradiation induced lung injury in rats model and related mechanism research[J]. Prog Modern Biomed, 2013, 13(26): 5001-5007. |
| [11] |
Hübner RH, Gitter W, El MNE, et al. Standardized quantification of pulmonary fibrosis in histological samples[J]. Biotechniques, 2008, 44(4): 507-511, 514-517. DOI:10.2144/000112729 |
| [12] |
Hofer M, Pospíšil M, Komurková D, et al. Granulocyte colony-stimulating factor in the treatment of acute radiation syndrome:a concise review[J]. Molecules, 2014, 19(4): 4770-4778. DOI:10.3390/molecules19044770 |
| [13] |
Piscaglia AC, Shupe TD, Oh SH, et al. Granulocyte-colony stimulating factor promotes liver repair and induces oval cell migration and proliferation in rats[J]. Gastroenterology, 2007, 133(2): 619-631. DOI:10.1053/j.gastro.2007.05.018 |
| [14] |
Kocher AA, Schuster MD, Szabolcs MJ, et al. Neovascularization of ischemic myocardium by human bone-marrow-derived angioblasts prevents cardiomyocyte apoptosis, reduces remodeling and improves cardiac function[J]. Nat Med, 2001, 7(4): 430-436. DOI:10.1038/86498 |
| [15] |
Yan X, Liu Y, Han Q, et al. Injured microenvironment directly guides the differentiation of engrafted Flk-1(+) mesenchymal stem cell in lung[J]. Exp Hematol, 2007, 35(9): 1466-1475. DOI:10.1016/j.exphem.2007.05.012 |
| [16] |
Xu T, Zhang Y, Chang P, et al. Mesenchymal stem cell-based therapy for radiation-induced lung injury[J]. Stem Cell Res Ther, 2018, 9(1): 18. DOI:10.1186/s13287-018-0776-6 |
| [17] |
Ashcroft T, Simpson JM, Timbrell V. Simple method of estimating severity of pulmonary fibrosis on a numerical scale[J]. J Clin Pathol, 1988, 41(4): 467-470. DOI:10.1136/jcp.41.4.467 |
 2019, Vol. 39
2019, Vol. 39


