胰腺作为人体最重要的消化腺,在临床诊疗活动如肿瘤放疗、血管造影、介入治疗等,受到辐射损伤的概率较大,从而导致外分泌功能障碍。现已证实组织细胞辐射损伤后将发生一系列的应激反应,包括氧化应激、各种炎性因子的释放、细胞周期阻滞、DNA损伤修复路径的启动等[1],这些应激反应均需要线粒体提供能量支持。辐射损伤后,线粒体亦可发生损伤,造成功能障碍,如3大营养物质的摄取、三羧酸循环、氧化磷酸化过程、氧化呼吸链等[2-3];明确胰腺外分泌细胞辐射损伤后线粒体主导的能量代谢变化及其调控机制,对辐射损伤的防护至关重要。缺氧诱导因子HIF-1α是一种细胞应激转录因子,已被证明在肺部辐射损伤后被激活,从而发挥重要作用[4-6]。HIF-1α在缺氧及富氧条件均可获得活性,并在转录水平调节LDHA等糖酵解相关基因的表达[7-8]。另外,HIF-1α也通过诱导miR120来间接抑制三羧酸(TCA)循环酶[9-10]。本实验通过单次大剂量(6及12 Gy)X射线照射,模拟胰腺大剂量辐射损伤事件,旨在研究辐射对胰腺外分泌细胞线粒体损伤及能量代谢影响,并探讨其可能的机制。
材料与方法1.细胞与培养:大鼠胰腺外分泌细胞AR42 J购于美国标准细胞库(ATCC),培养液为含10%胎牛血清、100 U/ml青霉素和链霉素的DMEM高糖培养液(美国GIBCO公司),并在37℃、5% CO2饱和湿度条件的恒温培养箱中培养。在倒置显微镜下观察细胞的生长情况,待细胞铺满瓶底的80%左右时,用0.25%乙二胺四乙酸(EDTA)胰酶消化后进行传代处理,取对数生长期的细胞用于实验。将细胞分为照射组(6 Gy)和空白对照组(0 Gy)。
2.实验动物:清洁级昆明大鼠8只,雄性,4~6周龄,由苏州大学动物中心提供,购入后适应性喂养1周后进行相关实验。动物按随机数表法分为对照组与假照射组,每组4只。照射组接受一次性12 Gy X射线辐照,对照组予假照射(0 Gy)。
3.辐照条件:应用X-RAD 320ix型生物学X射线辐照仪(美国PXi公司)对细胞及大鼠进行单次辐照。细胞离辐照源50 cm,剂量率为1.5 Gy/min,照射剂量为6 Gy;辐照大鼠时,大鼠予自制固定器固定,源皮距51 cm,上至胸骨剑突,下至耻骨联合,剂量率为1.5 Gy/min,参照杨爱洁等[11]实验方案,选择照射总剂量为12 Gy。
4.蛋白表达的检测:经辐照实验处理后24 h的细胞,去除培养基,按说明书提取细胞总蛋白;动物辐照后24 h,麻醉大鼠,解剖腹腔完整取出胰腺,置无菌PBS液中清洗,剪除残留的血液,将组织剪成1 mm3,加入组织裂解液,并用超声波破碎仪在冰浴中短暂超声细胞20~30次,直至肉眼观察不到块状组织,继续在冰上裂解15~30 min,4℃,12 000 r/min,离心半径13.5 cm,离心10 min,吸取上清,为组织蛋白裂解液。蛋白免疫印迹法(Western blot)检测乳酸脱氢酶A型同工酶(LDHA)、丙酮酸脱氢酶(PDH)、缺氧诱导因子1α(HIF-1α)(美国Cell Signaling公司)的表达,并同时检测内参β-肌动蛋白,鼠源及兔源二抗(美国Novus生物公司)。
5. ROS检测:96孔板每孔种6 000个细胞,每亚组细胞铺6个复孔,辐照后24 h检测ROS值。ROS DCFH-DA检测试剂盒购自于上海翊圣生物科技有限公司,辐射后24 h按商家说明书装载探针,并用Infinite M1000 pro全波长荧光酶标仪(瑞士tecan公司)实时检测,激发波长设置为488 nm, 发射波长为525 nm, 读取总强度数值F值。并以对照组F值为100%,计算各组细胞相对F值作为ROS产生量的高低。ROS相对产生量=(F实验/F对照)×100%。
6.线粒体膜电位检测(JC-1法):线粒体膜电位检测试剂盒购自上海翊圣生物科技有限公司。细胞重悬计数铺于24孔板中,每孔约铺2×106细胞,每组细胞铺5个复孔,细胞贴壁生长后做相应实验处理。分别取对照组、照射组照后24、48、72、96 h后的细胞,严格按商家说明书进行试剂装载。Infinite M1000 pro荧光酶标仪检测,线粒体膜电位用绿红荧光的相对比例衡量,绿色/红色荧光分别由激发光/发射光为485 nm/530 nm及525 nm/590 nm测取,得到的数值作一个相对值(R),并以空白对照组线粒体膜电位为对照(以空白对照组作为100%),计算细胞线粒体相对膜电位。线粒体相对膜电位=(R实验/R对照)×100%。
7. siRNA转染及质粒导入:转染的细胞选用复苏后3~5代的细胞,转染试剂选用Lipofectamine TMRNAiMAX(美国Invitrogen公司),HIF-1α siRNA(siHIF-1α)购于美国Qiagen公司,Flg-HIF-1α质粒及感受态细胞购于北京Tiangen公司,质粒抽提试剂盒购于上海迈基生物公司。转染程序严格按照制造商的方案步骤进行。转染效果由免疫印迹检测证实。
8. ATP含量测定:细胞内的ATP含量的测定采用一步法检测系统试剂盒(美国PerkinElmer公司),具体方法严格按照试剂盒步骤进行。在不透明的96孔板里种细胞,每孔种6 000个细胞,每组种5个复孔,然后在辐照结束后分别检测24和48 h的ATP值。应用荧光酶标仪检测,记录数据,并与同步四甲基偶氮唑盐(MTT)法修正后,进行统计分析。
9.乳酸生成测定:将经过辐照处理后24和48 h的各组细胞吸取培养基,应用L-乳酸测试盒检测乳酸含量,严格按照乳酸试剂盒说明书步骤进行检测,酶标仪中放入96孔板,在波长565 nm范围内读数,记为吸光度(A0),在室温下继续孵育20 min后,重新检测读数,记为A20。计算:ΔA=A20-A0,取ΔA作为乳酸值进行统计分析。
10.统计学处理:各实验独立重复3次以上,GraphPad Prism 5软件作图分析。采用SPSS 15.0统计软件分析处理数据。计量资料符合正态分布,以x±s表示。两组数据之间的比较采用双样本t检验,3组以上数据比较经方差齐性检验后,采用单因素方差分析。P < 0.05为差异有统计学意义。
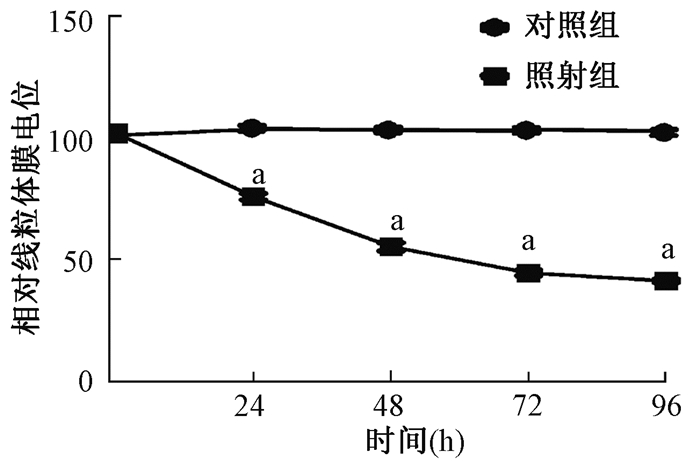
结果1.辐射暴露后导致线粒体膜电位变化:胰腺外分泌细胞辐射暴露后24~96 h,与空白对照组比较,照射组细胞线粒体膜电位呈持续性下降,各时段比较差异均有统计学意义(t=5.438~17.687,P < 0.05),见图 1。
|
注:a 与同时间段对照组照后比较,t=5.438、11.264、14.227、17.687,P < 0.05 图 1 胰腺外分泌细胞辐照后线粒体膜电位变化 Figure 1 Changes in mitochondrial membrane potential after irradiation of pancreatic exocrine cells |
2.辐射暴露后ROS产生量比较:对两组细胞在辐照后24 h进行ROS产生量检测显示,以对照组细胞ROS产生量相对值为100%,照射组细胞ROS产生量相对值为(168.18±7.78)%,两组比较照射组显著升高,差异有统计学意义(t=7.935, P < 0.05)。
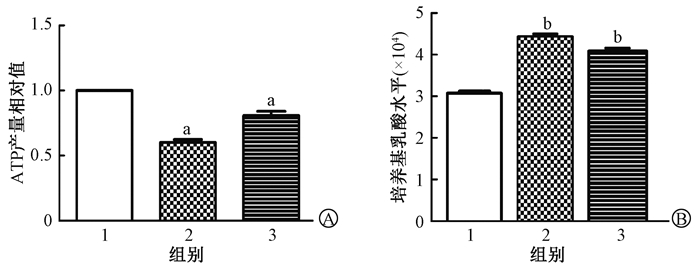
3.辐照诱导下胰腺外分泌细胞三磷酸腺苷(ATP)及乳酸产生量变化:如图 2所示,AR42 J细胞受照后24及48 h,ATP产量均低于对照组,差异有统计学意义(q=17.300、8.328,P < 0.05)。照射后48 h,ATP产量较24 h有一定程度回升(t=5.580,P < 0.05)。照射后24 h及48 h,乳酸产生量均高于对照组,差异有统计学意义(q=21.790、16.250,P < 0.05)。
|
注:1.空白对照组;2.照射后24 h组;3.照射后48 h组。与对照组比较,aq=17.300、8.328,bq=21.790、16.250, P < 0.05;ATP.三磷酸腺苷 图 2 照射后AR42 J细胞能量变化 A. ATP产生量变化;B.乳酸产生量改变 Figure 2 Energy changes of AR42 J cells after irradiation A.Changes in ATP production; B.Changes in lactic acid production |
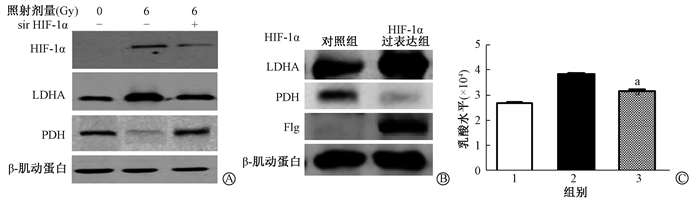
4.辐射诱导后胰腺外分泌细胞能量代谢变化:Western blot检测显示,对照组细胞中LDHA呈低表达状态,PDH为高表达,表明有氧磷酸化代谢途径在正常胰腺外分泌细胞中的优势地位;而照射组在辐射暴露后24 h,LDHA表达显著增强,PDH表达下调,表明辐照诱导加强了丙酮酸向乳酸转变,而不是转变为乙酰辅酶A进而进入线粒体(图 3)。
|
注:a与照射组比较,t=7.225, P < 0.05;1.对照组;2.照射组;3.照射+siHIF-1α组 图 3 照射后胰腺外分泌细胞能量代谢相关蛋白表达情况及乳酸生成变化 A.胰腺外分泌细胞代谢相关蛋白表达; B.沉默HIF-1α后能量代谢相关蛋白表达; C.沉默HIF-1α后乳酸生成变化 Figure 3 Expression of energy metabolism related proteins and changes of lactate production in pancreatic exocrine cells after irradiation A. Expression of metabolic related proteins in pancreatic exocrine cells; B. expression of energy metabolism-related proteins after silencing HIF-1α; C.The changes of lactate production in silencing HIF-1α |
5.辐射后能量代谢的变化与HIF-1α表达的关系:Western blot检测显示,对照组中HIF-1α不表达,而暴露于6 Gy的X射线照射组细胞HIF-1α显著上调,与代谢相关因子LDHA表达上调、PDH表达下调存在相关性。siRNA转染技术沉默HIF-1α表达后,消除了辐射诱导的LDHA、PDH的表达变化;收集照射后24 h细胞培养基行乳酸浓度检测显示,与照射组相比,沉默照射+siHIF-1α组乳酸产生量减少(t=7.225, P < 0.05),说明降低了辐照诱导的糖酵解代谢途径。通过导入Flg-HIF-1α质粒过表达HIF-1α,亦观察到未照射的AR42 J细胞LDHA的表达上调,见图 3。
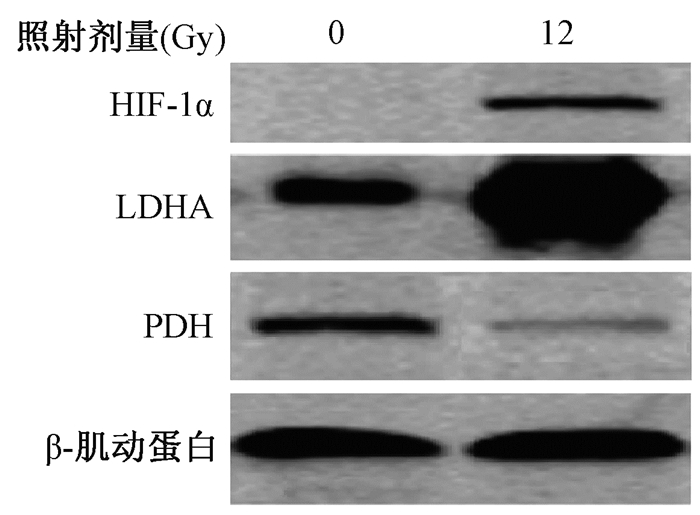
6.大鼠照射后胰腺的能量代谢:大鼠腹部予12 Gy X射线照射后,Western-blot检测显示,照射组与假照射组比较,HIF-1α表达上升,同样的调控能量代谢相关因子表达发生改变,LDHA表达上调,PDH表达受到抑制(图 4),趋势与细胞实验一致。
|
图 4 照后两组大鼠胰腺组织相关蛋白的表达 Figure 4 Expression of metabolic related proteins in pancreatic tissue in radiation injury animal model |
讨论
胰腺是腹膜后位器官,作为人体最重要的消化腺,胰腺在辐射暴露后的组织病理学改变主要是腺泡细胞。Ahnadu-Suka等[12]观察了24只猎狗术中照射后胰腺的病理改变,发现受照射的狗出现了胰腺腺泡细胞萎缩,外分泌功能障碍。在人体中亦观察到术中照射引起胰腺外分泌功能的显著减弱[13]。Hoekstra等[14]在13例放疗后不同时间死亡的患者体内观察到胰腺及周围组织的进行性腹膜后纤维化,以及残留胰腺组织与胰腺癌相似的退化改变,如脉管硬化、神经退化、腺泡萎缩和导管的不典型改变。
电离辐射是一种DNA毒性剂,可导致DNA的损伤反应(DDR)已被人们熟知,同时辐射对细胞器的损伤作用也逐渐被人们认识,线粒体作为机体的能量中心,在辐射损伤反应中起到重要而关键的作用。研究发现,电离辐射可通过增加氧化应激和改变线粒体基因表达而引起线粒体功能障碍[2-3],同时辐射也可通过ROS介导的各种途径调节诱导细胞凋亡和自噬。一些线粒体的辐射损伤可通过Ca2+依赖的线粒体通透性转换到相邻的线粒体,从而导致更多的ROS/RNS生成,这被称为传感/扩增机制,并且可能是低剂量辐射激活某些细胞质信号通路的必要途径[15]。线粒体损伤必然伴随着能量供给的失衡与失调。Wang等[16]发现辐射可诱导西藏小猪的肠组织ATP、ADP、AMP和TAN含量的减少,并与DNA的损伤程度存在显著相关性,线粒体和能量产生(特别是ATP)的显著减少可能导致危及生命的后果及较差的治疗反应。在本实验中,观察到AR42 J细胞辐射暴露后,ATP产生量下降,而线粒体膜电位在辐射后96 h内呈进行性下降,线粒体毒性因子ROS产生量激增,说明线粒体受到了持续性损伤。而培养基中乳酸含量的增加,提示线粒体外糖酵解过程的增强,这种增强过程推断是胰腺外分泌细胞线粒体辐射损伤后的一种应激反应。而蛋白水平的检测发现,促糖酵解的关键因子LDHA表达加强,而PDH表达受到抑制,进一步说明了其能量代谢方式发生了转变,而且这种转变与缺氧诱导因子表达上调相关。进一步的动物实验发现,大剂量X射线照射后,胰腺组织能量代谢相关蛋白表达同样发生变化,趋势与细胞实验相符。本实验中虽未对胰腺的外分泌部与其他组织细胞进行分离,但胰腺外分泌部构成胰腺实质的绝大部分[17],这种变化趋势应该能够代表为外分泌部的内环境下的变化情况。
辐射应激下细胞代谢的转变,一方面可减少线粒体中氧化磷酸化过程,减少氧化呼吸链中活性氧的产生;另一方面可通过糖酵解的方式快速产生ATP供能,故可将其视为细胞的一种应激保护机制。这种应激对于正常组织细胞的影响目前尚存争议。有学者发现,糖酵解途径的开启对于低剂量辐照(0.1 Gy)诱导的抗性是必需的,是组织细胞辐射抗性的基础[18],并且这种代谢转变对免疫细胞增殖和存活至关重要[19]。然而,这种保护机制类似于肿瘤细胞的代谢方式——Warburg效应,涉及激活线粒体的氧化磷酸化和生物合成的放射防护和药物制剂的作用机制的新假设已经提出,认为线粒体的氧化磷酸化的激活是针对极端条件(如辐射暴露和肿瘤形成)的细胞保护的一种方式[20]。然而,细胞中氧化磷酸化/ATP合成到糖酵解(厌氧呼吸)的能量代谢转换,可能会降低这些细胞增殖率和损伤修复过程[3]。辐射应激下过度的糖酵解产生的乳酸局部堆积,可诱导炎症反应[21]和胰岛素抵抗[22],辐射诱导的能量代谢紊乱(糖酵解途径增强和有氧氧化途径受抑制)类似于恶性肿瘤的代谢方式,这种长期的持续状态对细胞向间质性转变(EMT)具有促进作用,均有可能对辐射的远后效应产生不利影响。因此,大剂量的辐射暴露后组织细胞的能量代谢紊乱,可能是辐射防护的有效策略。
HIF-1α是细胞应对缺氧环境的反应元件,促使各种应激反应及能量代谢转变。相当多的证据表明,线粒体参与了氧化应激的传感,氧化应激导致的线粒体损伤也可介导HIF-1α上调。研究表明,在缺氧及氧化应激下,刺激线粒体产生活性氧(ROS),进而抑制PHD(含脯氨酰羟化酶结构域的酶)活性和HIF-1α降解,而这些氧自由基特异性地来自电子传递链中的复合物Ⅲ[23-24]。本实验所观察到的辐照后胰腺外分泌细胞HIF-1α的表达上调,可能与ROS产生量急剧升高相关。
综上所述,辐射暴露后胰腺外泌细胞线粒体受损,并伴有大量氧自由基生成,ATP产生量下降。HIF-1α表达上调,介导胰腺外分泌细胞能量代谢发生转变,表现为糖酵解途径增强,经由线粒体的有氧氧化途径受到抑制。这种能量代谢的转变,对组织细胞的远后效应尚须进一步的探讨。而保护线粒体、有效清除过量ROS、纠正辐射诱导的能量代谢紊乱,可能是胰腺辐射防护的关键。
利益冲突 所有研究者未因进行该研究而接受任何不正当的职务或财务利益,在此对研究的独立性和科学性予以保证。作者贡献声明 刘显荣设计研究方案、进行实验、收集数据并起草论文;彭秀达、卢先州负责论文修改及总体思路指导;阳敦学参与试验的操作及数据整理;龙建武提供实验指导
| [1] |
Mavragani IV, Nikitaki Z, Souli MP, et al. Complex DNA damage:a route to radiation-induced genomic instability and carcinogenesis[J]. Cancers (Basel), 2017, 9(7): 91-111. DOI:10.3390/cancers9070091 |
| [2] |
Yamamori T, Yasui H, Yamazumi M, et al. Ionizing radiation induces mitochondrial reactive oxygen species production accompanied by upregulation of mitochondrial electron transport chain function and mitochondrial content under control of the cell cycle checkpoint[J]. Free Radic Biol Med, 2012, 53(2): 260-270. DOI:10.1016/j.freeradbiomed.2012.04.033 |
| [3] |
Kam WW, Banati RB. Effects of ionizing radiation on mitochondria[J]. Free Radic Biol Med, 2013, 65: 607-619. DOI:10.1016/j.freeradbiomed.2013.07.024 |
| [4] |
Rabbani ZN, Mi J, Zhang Y, et al. Hypoxia inducible factor 1α signaling in fractionated radiation-induced lung injury:role of oxidative stress and tissue hypoxia[J]. Radiat Res, 2010, 173(2): 165-174. DOI:10.1667/RR1816.1 |
| [5] |
Higgins DF, Kimura K, Iwano M, et al. Hypoxia-inducible factor signaling in the development of tissue fibrosis[J]. Cell Cycle, 2008, 7(9): 1128-1132. DOI:10.1667/RR1816.1 |
| [6] |
Kim WY, Oh SH, Woo JK, et al. Targeting heat shock protein 90 overrides the resistance of lung cancer cells by blocking radiation-induced stabilization of hypoxia-inducible factor-1α[J]. Cancer Res, 2009, 69(4): 1624-1632. DOI:10.1158/0008-5472.CAN-08-0505 |
| [7] |
Semenza GL, Jiang BH, Leung SW, et al. Hypoxia response elements in the aldolase A, enolase 1, and lactate dehydrogenase A gene promoters contain essential binding sites for hypoxia-inducible factor 1[J]. J Biol Chem, 1996, 271(51): 32529-32537. DOI:10.1074/jbc.271.51.32529 |
| [8] |
Lunt SY, Vander Heiden MG. Aerobic glycolysis:meeting the metabolic requirements of cell proliferation[J]. Annu Rev Cell Dev Biol, 2011, 27: 441-464. DOI:10.1146/annurev-cellbio-092910-154237 |
| [9] |
杨爱洁, 何信佳, 安永恒, 等. 不同分割照射对胰腺生物学效应的影响[J]. 中华放射医学与防护杂志, 2011, 31(6): 653-656. Yang AJ, He XJ, An YH, et al. biological effects of different fractionated irradiation on pancreas after[J]. Chin J Radiol Med Prot, 2011, 31(6): 653-656. DOI:10.3760/cma.j.issn.0254-5098.2011.06.008 |
| [10] |
Corn PG. Hypoxic regulation of miR-210:shrinking targets expand HIF-1's influence[J]. Cancer Biol Ther, 2008, 7(2): 265-267. DOI:10.4161/cbt.7.2.5745 |
| [11] |
杨爱洁, 何信佳, 安永恒, 等. 单次大剂量X线照射对大鼠胰腺的损伤作用[J]. 齐鲁医学杂志, 2011, 26(4): 316-318. Yang AJ, He XJ, An YH, et al. Damage of rat pancreas after a single large-dose radiation[J]. Med J Qilu, 2011, 26(4): 316-318. |
| [12] |
Ahmadu-Suka F, Gillette EL, Withrow SJ, et al. Exocrine pancreatic function following intraoperative irradiation of the canine pancreas[J]. Cancer, 1988, 62(6): 1091-1095. DOI:10.1002/(ISSN)1097-0142 |
| [13] |
Yamaguchi K, Nakamura K, Kimura M, et al. Intraoperative radiation enhances decline of pancreatic exocrine function after pancreatic head resection[J]. Dig Dis Sci, 2000, 45(6): 1084-1090. DOI:10.1023/A:1005529430847 |
| [14] |
Hoekstra HJ, Restrepo C, Kinsella TJ, et al. Histopathological effects of intraoperative radiotherapy on pancreas and adjacent tissues:a postmortem analysis[J]. J Surg Oncol, 1988, 37(2): 104-108. DOI:10.1002/(ISSN)1096-9098 |
| [15] |
Leach JK, Van Tuyle G, Lin PS, et al. Ionizing radiation-induced, mitochondria-dependent generation of reactive oxygen/nitrogen[J]. Cancer Res, 2001, 61(10): 3894-3901. |
| [16] |
Wang YJ, Liu W, Chen C, et al. Irradiation induced injury reduces energy metabolism in small intestine of Tibet minipigs[J]. PLoS One, 2013, 8(3): e58970. DOI:10.1371/journal.pone.0058970 |
| [17] |
晁青鲜, 于鹤萌, 赫晓燕. 一例秃鹫胰腺组织结构的观察[J]. 野生动物学报, 2018, 39(3): 678-680. Chao QX, Yu HM, He XY. Observation on the cinereous (Aegypius monachus)vulture pancreatic tissue structure[J]. Chin J Wildl, 2018, 39(3): 678-680. DOI:10.3969/j.issn.1000-0127.2018.03.039 |
| [18] |
Lall R, Ganapathy S, Yang M, et al. Low-dose radiation exposure induces a HIF-1-mediated adaptive and protective metabolic response[J]. Cell Death Differ, 2014, 21(5): 836-844. DOI:10.1038/cdd.2014.24 |
| [19] |
Ben-Neriah Y, Karin M. Inflammation meets cancer, with NF-κB as the matchmaker[J]. Nat Immunol, 2011, 12(8): 715-723. DOI:10.1038/ni.2060 |
| [20] |
Kozyreva EV, Eliseenko NN. Ability of energy metabolism of cells to activate repair of its genetic material after radiation damage[J]. Radiats Biol Radioecol, 2002, 42(6): 632-635. |
| [21] |
Hashimoto T, Hussien R, Oommen S, et al. Lactate sensitive transcription factor network in L6 cells:activation of MCT1 and mitochondrial biogenesis[J]. FASEB J, 2007, 21(10): 2602-2612. DOI:10.1096/fj.07-8174com |
| [22] |
Priyanka A, Anusree SS, Nisha VM, et al. Curcumin improves hypoxia induced dysfunctions in 3T3-L1 adipocytes by protecting mitochondria and down regulating inflammation[J]. Biofactors, 2014, 40(5): 513-523. DOI:10.1002/biof.1175 |
| [23] |
Kaelin WG Jr. ROS:really involved in oxygen sensing[J]. Cell Metab, 2005, 1(6): 357-358. DOI:10.1016/j.cmet.2005.05.006 |
| [24] |
Klimova T, Chandel NS. Mitochondrial complex Ⅲ regulates hypoxic activation of HIF[J]. Cell Death Differ, 2008, 15(4): 660-666. DOI:10.1038/sj.cdd.4402307 |
 2019, Vol. 39
2019, Vol. 39


