2. 福建医科大学附属第一医院放疗科, 福州 350005
2. Department of Radiotherapy, First Affiliated Hospital to Fujian Medical University, Fuzhou 350005, China
放射治疗作为胸部恶性肿瘤最主要的治疗手段之一,常常会引起肺部组织不同程度的放射性损伤,如果放射损伤严重,就会在一定程度对放疗的剂量产生限制,从而影响治疗的疗效[1]。NLRP3炎症复合体是由NLRP3、接头蛋白(ASC)和半胱天冬酶-1(Caspase-1)前体组成的多蛋白复合物。当NLRP3激活时,会招募和激活促炎症蛋白酶Caspase-1,而活化的Caspase-1会剪切IL-1β和IL-18的无活性前体,生成有活性的IL-1β和IL-18释放至细胞外,从而调节免疫应答和炎症反应。
miR-223是一种高度保守的miRNA,在多种炎症相关的疾病中,miR-223都被发现是通过抑制其靶基因NLRP3的表达来参与炎症反应的调控[2-3],在放射性肺损伤中未见有miR-223的相关研究。推测在放射性肺损伤中miR-223通过调控NLRP3的表达,抑制炎症因子IL-1β和IL-18的分泌,减轻了放射性炎症,防护放射性肺损伤,本研究对此进行了验证。
材料与方法1.主要试剂和仪器:直线加速器Clinac600C/D(美国Varian医疗系统公司);QuantStudio 5定量PCR仪(美国ABI公司);FluorChem E超灵敏全自动成像分析系统(美国Protein Simple公司);TRIzol Reagent(美国Invitrogen公司);miR-223 Agomir/NC(广州市锐博生物科技有限公司);BCA蛋白浓度测定试剂盒(美国Thermo Scientific公司);qPCR试剂盒(美国Promega公司);小鼠IL-1β及IL-18 Elisa检测试剂盒(武汉博士德公司);NLRP3(货号15101S)、Caspase-1(货号3866S)和β-肌动蛋白(货号3700S)单克隆抗体(美国CST公司);Western blot试剂盒、山羊抗小鼠二抗、ELC发光液(江苏碧云天公司)。
2.实验动物与照射方法:SPF级雌性C57BL/6J小鼠,体重(20±2)g,购于上海斯莱克实验动物有限公司,实验动物生产许可证号SCXK(闽)2010G0001,质量合格证号0000419。动物使用协议已经审查委员会批准,实验中动物的处置符合动物伦理学标准。给小鼠喂食SPF级饲料,环境温度(24±2)℃,相对湿度50%,白天和黑夜12 h交替。用随机数表法将小鼠分为健康对照组、单纯照射组、照射+miR-223组和照射+阴性对照(NC)组,每组10只小鼠。用4%水合氯醛注射小鼠腹腔(0.1 ml/10 g),将麻醉后小鼠固定于塑料鼠夹内,确保小鼠体位不发生改变,照射区域由前肢腋窝至剑突水平位置,宽约1.2 cm。采用6 MV X射线,吸收剂量率0.4 Gy/min,单次全肺照射15 Gy。
3.动物给药方法:采用尾静脉注射给药,照射+miR-223组和照射+NC组将miR-223 agomir/NC溶解于经高压灭菌的生理盐水中,调整浓度,使得20 μl中含有10 nmol药物,每次注射给予20 μl药物。照射前1 d给药,之后每2 d给药1次。
4.苏木素-伊红(HE)及免疫组织化学法检验:照射后第14天通过颈椎脱臼法处死小鼠,摘取双肺。将肺右上叶置于10%甲醛溶液中固定24 h,后转入75%乙醇中保存24 h,石蜡包埋样本。连续石蜡切片,行HE染色。镜下观察病理组织结构改变。免疫组织化学法检测步骤:将石蜡切片脱蜡,在3%的H2O2中灭活15 min,用磷酸盐缓冲液(PBS)冲洗。将切片放抗原修复缓冲液(pH 6.0)中煮沸15 min,自然冷却至室温后PBS冲洗。用血清封闭10 min后倾去;再滴加一抗工作液(1 :100),放置于4℃过夜后用PBS冲洗;37℃下用生物素标记的二抗孵育30 min后PBS冲洗;加入辣根酶标记链霉卵白素(SA/HRP)工作液,37℃孵育30 min后PBS冲洗;二氨基联苯胺(DAB)溶液显色;使用苏木素-伊红复染后脱水,透明,封片。显微镜下观察靶蛋白在肺组织中的定位及表达水平,每张切片在200倍镜下随机选择10个视野,以染色强度和阳性细胞的百分比进行评分,总分为两者乘积。染色强度:无棕黄色颗粒为0分;淡黄色颗粒为1分;棕黄色颗粒为2分;大量深棕色或褐色颗粒为3分。阳性细胞的比例:无阳性细胞为0分,< 25%为1分,25%~50%为2分,51%~80%为3分,>80%为4分。
5.采用酶联免疫吸附(ELISA)法测定IL-1β及IL-18的表达量:实验前先将肺组织在预冷的生理盐水中清洗以除去血液,之后用滤纸拭干并称重,用移液枪量取肺组织块重量9倍的生理盐水。在冰上用匀浆器研磨,制备肺组织匀浆。将制备好的10%匀浆在4℃条件下,采用离心半径6 cm, 3 000 r/min离心15 min,离心结束后留上清,弃沉淀。使用BCA法测定组织匀浆中的总蛋白含量,并且用生理盐水将所有样品蛋白浓度调整为1.75 mg/ml。根据对应ELISA试剂盒提供的操作步骤, 测定组织内IL-1β及IL-18的表达量,每个样品设置3复孔,结果以pg/mg表示。
6.实时荧光定量PCR检测肺组织中miR-223和NLRP3的表达量:取小鼠肺冻存样品50 mg,加入1 ml TRIzol,按照试剂说明书方法提取RNA,用分光光度计检测RNA含量和纯度;取1 μg总RNA,分别加入miR-223正向引物(CGCGAGCACAGAATTAATACGACTCACTATACGCGGGGGTATT)和U6反向引物(AACGCTTCACGAATTTGCGT),使用GoScriptTM试剂盒反转录miR-223和U6。使用Oligo(dT)反转录cDNA。将反转录得到的产物加入GoTaq© qPCR反应液中进行Real-time PCR扩增,扩增条件95℃ 5 min、95℃ 20 s、60℃ 20 s、72℃ 30 s,共40个循环,分别以U6和β-肌动蛋白为内参,使用2-△△Ct法对miR-223和NLRP3的扩增结果进行相对定量分析。每个样本重复3次实验。引物序列及产物长度如下:MiR-223为57 bp,正向引物为5′GGCTGTCAGTTTGTCAAATACC3′,反向引物为5′CGCGAGCACAGAATTAATACG3′;U6 94 bp,正向引物为5′CTCGCTTCGGCAGCACA3′,反向引物为5′AACGCTTCACGAATTTGCGT3′;NLRP3 141 bp,正向引物为5′ATTACCCGCCCGAGAAAGG3′,反向引物为5′TCGCAGCAAAGATCCACACAG3′;β-肌动蛋白154 bp, 正向引物为5′GGCTGTATTCCCCTCCATCG3′,反向引物为5′CCAGTTGGTAACAATGCCATGT3′。
7.蛋白免疫印迹法(Western blot)检测蛋白表达:使用RIPA裂解液提取肺组织样本的总蛋白,通过BCA法测定样本蛋白浓度后,取50 μg蛋白,于10%SDS-PAGE胶中电泳,电泳后进行转膜,将转好的膜置于TBST配置的5%脱脂奶粉中室温封闭1 h后,3(羟甲基)氨基甲烷—盐酸缓冲盐溶液(TBST)洗膜,按目的蛋白大小剪取膜,分别加入一抗(NLRP3抗体和Caspase-1抗体)及内参β-肌动蛋白抗体,于4℃孵育过夜,使用TBST洗膜3次后,加入HRP标记的对应二抗,37℃孵育1 h,采用电化学发光(ECL)法进行显色,然后于FluorChem E系统进行拍照,Quantity One 4.62(美国Bio-Rad公司)成像软件进行图像分析,目的蛋白条带的灰度值与内参蛋白条带灰度值的比值表示目的蛋白的相对表达量,上述实验重复3次,取其均值。
8.统计学处理:采用GraphPad Prism 5软件进行分析。采用K-S法进行正态性检验,数据以x±s表示,采用非成对t检验比较两组间差异。P < 0.05为差异具有统计学意义。
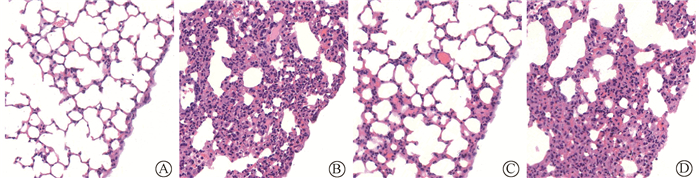
结果1.病理组织学改变:HE染色显示,健康对照组小鼠的肺组织结构清晰,肺泡形态正常,肺泡壁薄, 毛细血管壁完整, 无渗出和出血。而单纯照射组和照射+NC组小鼠的肺组织病变表现为肺泡壁增厚,肺间质及肺泡壁毛细血管扩张、出血,同时伴有大量炎性细胞的浸润。而照射+miR-223组的小鼠肺组织炎症、渗出等病理表现较单纯照射组都显著减轻(图 1)。
|
图 1 各组小鼠肺组织的病理改变 HE染色 ×200 A.健康对照组;B.单纯照射组;C.照射+miR-223组;D. miR-NC组 Figure 1 The pathological changes in lung tissue of mice HE staining ×200 |
2.小鼠肺组织中miR-223和NLRP3 mRNA的表达量:与健康对照组小鼠相比单纯照射组和照射+NC组小鼠的肺组织样品中miR-223的表达量下降(t=8.00、9.29,P < 0.05)而NLRP3的表达量明显升高(t=4.08、4.74,P < 0.05)。照射+miR-223组的小鼠与单纯照射组相比,NLRP3 mRNA的表达量下降(t=3.22,P < 0.05,表 1)。
|
|
表 1 各组小鼠肺组织中miR-223与NLRP3 mRNA的相对表达水平(x±s) Table 1 The expressions of miR-223 and NLRP3 mRNAs in lung tissue of mice(x±s) |
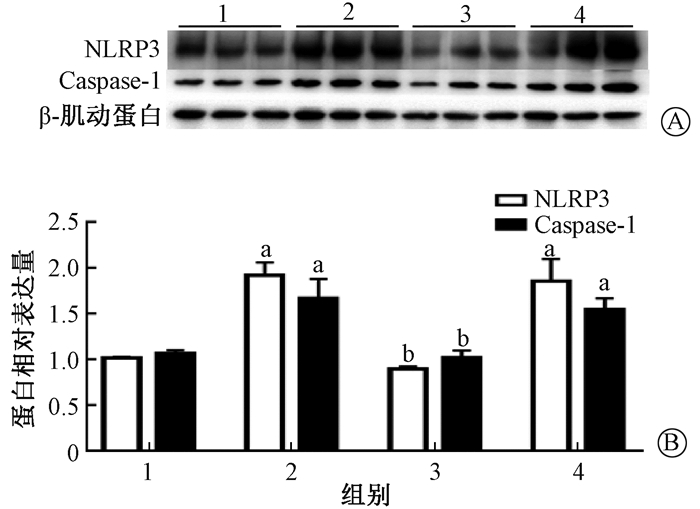
3. Western blot检测NLRP3和Caspase-1蛋白表达:Western blot结果显示,与健康对照组小鼠相比单纯照射组和照射+NC组小鼠肺组织内的NLRP3与Caspase-1蛋白表达均显著升高(t=11.19、5.99、4.83、6.46,P < 0.05),而照射+miR-223组小鼠NLRP3与Caspase-1蛋白表达较单纯照射组均降低(t=12.47、4.95,P < 0.05,图 2)。
|
注:1.健康对照组;2.单纯照射组;3.照射+miR-223组;4.照射+NC组。a与健康对照组比较,t=11.19、5.99、4.83、6.46, P < 0.05;b与单纯照射组比较,t=12.47、4.95, P < 0.05 图 2 Western blot检测各组小鼠肺组织中NLRP3和Caspase-1蛋白表达水平 A. Western blot蛋白条带;B.蛋白相对表达量 Figure 2 The expression levels of NLRP3 and Caspase-1 protein in lung tissue of mice A. Western blot protein bands; B. The relative expression of NLRP3 and Caspase-1 |
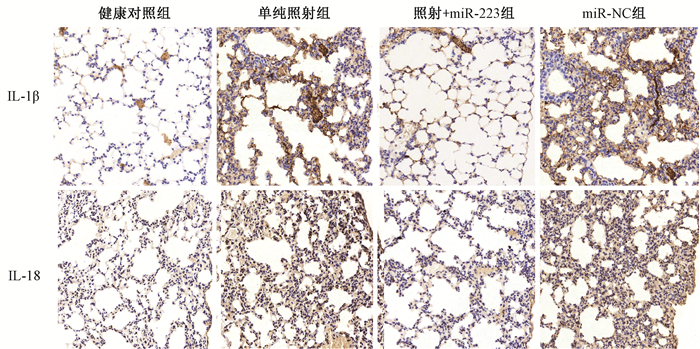
4.免疫组织化学法检测肺组织中IL-1β和IL-18蛋白表达:结果显示,正常小鼠的肺组织中IL-1β和IL-18表达水平较低,主要在肺上皮细胞中存在少量弱阳性表达;而在单纯照射组肺组织中,IL-1β和IL-18出现明显阳性甚至强阳性表达,主要表达于肺间质及肺上皮细胞胞质,部分巨噬细胞胞质也出现阳性表达;照射+miR-223组小鼠肺组织中IL-1β和IL-18蛋白表达较单纯照射组低。健康对照组、单纯照射组、照射+miR-223组以及照射+NC组,IL-1β免疫组织化学评分分别为1.10+0.23、7.50+0.43、2.10+0.31及7.50+0.43;IL-18免疫组织化学评分分别为1.00+0.39、6.00+0.61、1.60+0.40及5.70+0.59。与健康对照组比较,单纯照射组和照射+NC组的评分分值均显著升高,差异有统计学意义(tIL-1=13.12、13.12,tIL-18=6.85、6.57,P < 0.05);而照射+miR-223组与单纯照比较,IL-1β和IL-18评分分值有显著下降(t=10.16、6.00,P < 0.05,图 3)
|
图 3 各组小鼠肺组织的IL-1β及IL-18蛋白表达 免疫组织化学染色×200 Figure 3 The expressions of IL-1β and IL-18 protein in lung tissue of mice Immunohistochemical staining ×200 |
5.小鼠肺组织匀浆中炎症因子的表达:由表 2可知,与健康对照组比较,单纯照射组小鼠肺组织匀浆中IL-1β和IL-18含量均明显增高(t=18.06、12.79,P < 0.05)。照射+miR-223组IL-1β和IL-18的表达量相对于单纯照射组明显降低(t=8.22、8.47,P < 0.05)。
|
|
表 2 各组小鼠肺组织匀浆中IL-1β和IL-18含量(pg/mg,x±s) Table 2 The levels of IL-1β and IL-18 in lung tissue of mice (pg/mg, x±s) |
讨论
放射性肺损伤包括急性放射性肺炎和放射性肺纤维化,而在急性炎症期,肺上皮细胞和巨噬细胞由于受到辐射损伤而分泌的多种炎症因子和趋化因子会导致级联放大效应,造成严重炎症反应,从而导致后期严重的纤维化[4]。因此,在急性炎症期就进行积极主动地的药物干预,减轻肺部的炎症反应,可以预防和阻止后期肺纤维化的发生和进展。但是,目前对于放射性肺损伤,尚无很理想的预防和治疗的措施。寻找有效防治放射性肺损伤的药物,成为近年来放射防护研究的热点问题[5-6]。
MiR-223是一种调节炎症的microRNA,通常在骨髓来源的细胞中高表达[7]。miR-223在许多炎症相关的疾病中都起到了重要的调控作用[8-10]。在肺部疾病的相关研究中,miR-223通过调控不同的靶基因表达呈现出多种作用。在研究感染引起的急性肺损伤研究中,发现来自多形核中性粒细胞的miR-223可以穿梭至肺上皮细胞中,并通过调控靶基因PARP-1的表达,抑制肺部炎症,减轻由金黄色葡萄球菌引起的急性肺损伤[9]。而在肺动脉高压相关的研究中发现,miR-223可通过抑制其靶基因RhoB和MLC2的表达,调节肺动脉平滑肌细胞增殖,迁移和肌动蛋白重组,导致血管重塑同时抑制肺动脉高压的发展[11]。
在miR-223众多的靶基因中,NLRP3是其经典的靶基因之一,参与炎症复合体的组装,构成了炎症复合体的核心部分。近年来的肺部疾病研究中发现,NLRP3与肺损伤及纤维化有着密切的联系,可作为肺损伤疾病新的潜在治疗靶点。如苦杏仁甙可以通过对NLRP3信号通路的抑制,保护由LPS诱导的急性肺损伤[12];在由博来霉素诱导的特发性肺纤维化中,NLRP3又通过TGF-β调控了肺上皮细胞发生上皮间质转化的过程,抑制NLRP3的活化可以减轻肺纤维化的程度[13];在矽肺病的研究中,NLRP3炎性小体参与介导了上皮间质转化,可能是阻止肺纤维化的靶点[14]。在放射性肺损伤中,辐射可损伤组成肺结构的细胞(如成纤维细胞和上皮细胞)并激活巨噬细胞中的NLRP3炎性体。这导致IL-1的释放和嗜酸性粒细胞聚集,从而促进Th2细胞介导的免疫应答,分泌细胞因子诱导放射性肺炎和纤维化。而靶向抑制这些促炎途径可以显著减轻辐射诱导的肺损伤[15]。在放射性肺损伤近年的研究中也发现X射线的照射可以激活NLRP3炎性体,并进一步刺激Caspase-1和Caspase-4/5/11的激活,从而释放大量炎性细胞因子IL-1β和IL-18和炎性细胞内容物,引起炎症反应,最终导致细胞崩解[16]。以上的研究都说明,抑制NLRP3炎性体的激活可能是减轻放射性肺损伤的一条有效途径。
本研究探讨了在急性放射性肺损伤中miR-223能否通过抑制NLRP3的表达,减轻放射性肺炎的程度,起到防护放射性肺损伤的作用。结果显示,15 Gy X射线单次照射小鼠肺部,导致肺组织中miR-223表达降低和NLRP3的表达升高。而伴随NLRP3的升高,活化的Caspase-1的表达也随之升高,而Caspase-1会将无活性的细胞因子前体pro-IL-1β和pro-IL-18转化为成熟的IL-1β和IL-18,并促进其分泌,引起炎症反应。因此,本研究在多种检测手段中均观察到NLRP3、Caspase-1、IL-1β以及IL-18表达的升高,造成小鼠放射性肺炎。当给予miR-223 agomir治疗后,小鼠肺部的炎症情况明显减轻,并且一系列蛋白如NLRP3、Caspase-1、IL-1β以及IL-18的表达水平显著降低。这表明miR-223对小鼠急性放射性肺损伤有一定的防治作用。其作用机制可能是通过抑制靶基因NLRP3的表达,降低NLRP3炎症复合体的活化水平,从而抑制复合体中的效应蛋白Caspase-1的活化,最终减少炎症因子IL-1β和IL-18的分泌减轻炎症反应。总之,miR-223通过阻断急性放射性肺损伤中发生级联式的炎症反应,减轻了放射性肺炎的程度,起到了防护放射性肺损伤的作用。
志谢 本研究还得到2016年福建医科大学启航基金(2016QH043)资助利益冲突 所有研究者未因进行该研究而接受任何不正当的职务或财务利益,在此对研究的独立性和科学性予以保证
作者贡献声明 王锃负责实验操作及论文撰写;苏丽、蓝瑞隆负责动物照射;陈瑞庆负责数据统计分析;傅冷西指导论文撰写
| [1] |
郑苗丽, 冯勤付. 放射性肺损伤的研究进展[J]. 中华放射肿瘤学杂志, 2018, 27(7): 692-695. Zheng ML, Feng QF. Research progress in radiation-induced lung injury[J]. Chin J Radiat Oncol, 2018, 27(7): 692-695. DOI:10.3760/cma.j.issn.1004-4221.2018.07.015 |
| [2] |
Feng Z, Qi S, Zhang Y, et al. Ly6G+ neutrophil-derived miR-223 inhibits the NLRP3 inflammasome in mitochondrial DAMP-induced acute lung injury[J]. Cell Death Dis, 2017, 8(11): e3170. DOI:10.1038/cddis.2017.549 |
| [3] |
Neudecker V, Haneklaus M, Jensen O, et al. Myeloid-derived miR-223 regulates intestinal inflammation via repression of the NLRP3 inflammasome[J]. J Exp Med, 2017, 214(6): 1737-1752. DOI:10.1084/jem.20160462 |
| [4] |
姚逸临, 李和根. 放射性肺损伤的研究进展[J]. 西部医学, 2018, 30(5): 773-775, 780. Yao YL, Li HG. The research progress of radioactive lung injury[J]. Med J West China, 2018, 30(5): 773-775, 780. DOI:10.3969/j.issn.1672-3511.2018.05.036 |
| [5] |
孙丹丹, 肖莉, 于悦. LY2109761对小鼠放射性肺纤维化的治疗作用[J]. 中华放射医学与防护杂志, 2017, 37(9): 651-655. Sun DD, Xiao L, Yu Y. Role of LY2109761 in radiation-induced pulmonary fibrosis in mice[J]. Chin J Radiol Med Prot, 2017, 37(9): 651-655. DOI:10.3760/cma.j.issn.0254-5098.2017.09.002 |
| [6] |
康亚辉, 王金凤, 张曲, 等. 穿心莲内酯对小鼠放射性肺损伤的防护作用[J]. 中华放射医学与防护杂志, 2014, 34(7): 507-511. Kang YH, Wang JF, Zhang Q, et al. Andrographolide protects against radiation-induced lung injury in mice[J]. Chin J Radiol Med Prot, 2014, 34(7): 507-511. DOI:10.3760/cma.j.issn.0254-5098.2014.07.007 |
| [7] |
Haneklaus M, Gerlic M, O'Neill LA, et al. miR-223:infection, inflammation and cancer[J]. J Intern Med, 2013, 274(3): 215-226. DOI:10.1111/joim.12099 |
| [8] |
Yang F, Xu Y, Liu C, et al. NF-κB/miR-223-3p/ARID1A axis is involved in Helicobacter pylori CagA-induced gastric carcinogenesis and progression[J]. Cell Death Dis, 2018, 9(1): 12. DOI:10.1038/s41419-017-0020-9 |
| [9] |
Neudecker V, Brodsky KS, Clambey ET, et al. Neutrophil transfer of miR-223 to lung epithelial cells dampens acute lung injury in mice[J]. Sci Transl Med, 2017, 9(408): eaah5360. DOI:10.1126/scitranslmed.aah5360 |
| [10] |
Gou W, Zhang Z, Yang C, et al. MiR-223/Pknox1 axis protects mice from CVB3-induced viral myocarditis by modulating macrophage polarization[J]. Exp Cell Res, 2018, 366(1): 41-48. DOI:10.1016/j.yexcr.2018.03.004 |
| [11] |
Zeng Y, Zhang X, Kang K, et al. MicroRNA-223 attenuates hypoxia-induced vascular remodeling by targeting RhoB/MLC2 in pulmonary arterial smooth muscle cells[J]. Sci Rep, 2016, 6: 24900. DOI:10.1038/srep24900 |
| [12] |
Zhang A, Pan W, Lv J, et al. Protective effect of amygdalin on LPS-induced acute lung injury by inhibiting NF-κB and NLRP3 signaling pathways[J]. Inflammation, 2017, 40(3): 745-751. DOI:10.1007/s10753-017-0518-4 |
| [13] |
Tian R, Zhu Y, Yao J, et al. NLRP3 participates in the regulation of EMT in bleomycin-induced pulmonary fibrosis[J]. Exp Cell Res, 2017, 357(2): 328-334. DOI:10.1016/j.yexcr.2017.05.028 |
| [14] |
Li X, Yan X, Wang Y, et al. NLRP3 inflammasome inhibition attenuates silica-induced epithelial to mesenchymal transition (EMT) in human bronchial epithelial cells[J]. Exp Cell Res, 2018, 362(2): 489-497. DOI:10.1016/j.yexcr.2017.12.013 |
| [15] |
Sohn SH, Lee JM, Park S, et al. The inflammasome accelerates radiation-induced lung inflammation and fibrosis in mice[J]. Environ Toxicol Pharmacol, 2015, 39(2): 917-926. DOI:10.1016/j.etap.2015.02.019 |
| [16] |
韩蓉, 吴东明, 邓仕华, 等. X线辐照激活NLRP3炎性体引起损伤肺组织细胞焦亡(pyroptosis)[J]. 细胞与分子免疫学杂志, 2017, 33(9): 1206-1211. Han R, Wu DM, Deng SH, et al. NLRP3 inflammasome induces pyroptosis in lung tissues of radiation-induced lung injury in mice[J]. Chin J Cell Mol Immunol, 2017, 33(9): 1206-1211. DOI:10.13423/j.cnki.cjcmi.008426 |
 2019, Vol. 39
2019, Vol. 39


