2. 空军军医大学基础医学和组织学与胚胎学教研室, 西安 710032
2. Department of Histology and Embryology, Air Force Medical University, Xi'an 710032, China
近年来,电磁辐射在工业、农业、医学、国防等领域的应用尤其广泛,相关从业人群暴露于该辐射的强度、时间和复杂性与日俱增,已成为主要的环境污染源和重大公共卫生问题。其中,电磁脉冲(electromagnetic pulse, EMP)是一种前沿极快、频谱较宽、能量较高的非电离辐射[1],主要来源于职业环境,如脉冲功率技术实验室[2]。EMP作为一种特殊的作业环境电磁辐射,其对雄性生殖健康的影响也引起了学者们的关注。据报道,较低场强的EMP暴露对雄性生殖功能均有一定程度的损伤[3]。但至今为止,关于高场强EMP对生殖的影响少有报道。因此,本研究探讨了高场强EMP暴露对健康成年雄性小鼠生殖的影响,为职业环境条件下EMP卫生防护标准的制定提供理论和实验依据。
材料与方法1.动物分组和取材:清洁级BALB/c小鼠48只,健康雄性,8周龄,体重(19.2±1.4)g,购自空军军医大学实验动物中心[生产许可证号:XK(陕2014-002)],饲养于恒定环境中,温度(23±2)℃,自由进食水。小鼠依照随机数表法分为假暴露组和暴露组,每组24只,于暴露后不同时间(1、7、14和35 d)取材。1%戊巴比妥钠60 mg/kg腹腔麻醉小鼠后,剥离双侧附睾尾,制备精子悬液待精子质量检测。剥离双侧睾丸,一侧冻存于-80℃待提取蛋白,另一侧固定于Bouin氏液(北京雷根公司)中待组织学检测。所有动物操作均依照空军军医大学实验动物伦理要求进行,并已获得实验动物中心实验动物福利与伦理委员会批准(20170606)。
2. EMP暴露:按照文献[4]方法,采用的全固态纳秒EMP发生器(中国西北核技术研究所)包括3个相对独立的单元:谐振充电单元、磁脉冲压缩单元和半导体开关单元。EMP暴露组小鼠单只放入一个内部空间为16 cm×5.5 cm×4 cm各壁均带孔的有机塑料盒中,全身单次暴露于场强720 kV/m的EMP,前沿17 ns,脉宽40 ns,重复频率1 Hz,共100个脉冲。假暴露组小鼠的处理同暴露组,但无EMP输出。
3.小鼠体重监测和睾丸指数测定:小鼠适应性喂养3 d后进行EMP暴露。暴露前1 d进行称重,实验期间定期(每隔7 d)监测小鼠体重。暴露后不同时间剥离双侧睾丸并称重,按下述公式计算睾丸指数[5]:睾丸指数=睾丸重量(g)/小鼠体重(g)×100%。
4.小鼠精子质量测定:将双侧附睾尾横剪一刀后置于含1 ml精子培养液(美国Millipore公司)的12孔板中,在摇床上缓慢摇动30 min,37℃水浴锅内孵育20 min,制成精子悬液。取精子悬液20 μl加入180 μl精子培养液中混匀后充入一次性尿沉渣计数板(加拿大BMJ公司),显微镜下计数。取少许精子悬液涂片,预冷丙酮固定,伊红染液染色后,显微镜下计数200个完整精子中畸形的个数。取10 μl精子悬液加入37℃预热的100 μl精子低渗培养液(北京雷根公司)中,37℃孵育30 min后涂片,显微镜下观察200个完整精子的存活率。
5.小鼠睾丸HE染色及生精小管直径测定:小鼠睾丸于Bouin氏液中固定24 h后,冠状面横切,梯度酒精脱水、透明、石蜡包埋、切片(厚度4 μm)。使用常规HE染色,倒置显微镜(德国Leica公司)下观察生精小管结构,并随机选取50个长径:短径 < 1.2 :1的生精小管,用Image J 1.43 u软件以十字交叉法测量其直径。
6.支持细胞重要分泌因子的测定:干细胞因子(stem cell factor, SCF)和胶质源性神经营养因子(glial derived neurotrophic factor, GDNF)由支持细胞分泌,对精原干细胞的增殖和分化起着重要的作用。在低温环境下提取睾丸组织全蛋白(南京凯基生物公司),使用ELISA试剂盒(美国Cloud-Clone公司)和Western blot(小鼠抗β-肌动蛋白单克隆抗体(1 :5 000,美国CMCTAG公司);兔抗SCF多克隆抗体(1 :300,美国SAB公司);兔抗GDNF多克隆抗体(1 :400,美国Abcam公司)检测SCF和GDNF的含量。
7.统计学处理:采用SPSS 17.0软件进行数据分析。数据符合正态分布,用x±s表示,GraphPad Prism 5.04软件作图,两组间均数比较采用两独立样本t检验。P < 0.05为差异有统计学意义。
结果1.小鼠一般情况:EMP暴露后不同时间,两组小鼠体重均随时间的延长而增加,差异无统计学意义(P>0.05)。暴露后1、7、14和35 d两组小鼠双侧睾丸重量比较差异均无统计学意义(P>0.05),睾丸指数暴露组分别为(0.75±0.03)%、(0.71±0.04)%、(0.75±0.05)%和(0.83±0.03)%,与假暴露组(0.75±0.05)%、(0.71±0.03)%、(0.73±0.05)%和(0.74±0.08)%比较差异亦无统计学意义(P>0.05)。
2.小鼠精子质量的变化:与假暴露组相比,EMP暴露后不同时间小鼠精子数量、畸形率和存活率等精子质量差异无统计学意义(P>0.05),见表 1。
|
|
表 1 EMP暴露后不同时间两组小鼠精子质量的变化(x±s) Table 1 Effects of EMP on sperm quality of mice at different times after exposure(x±s) |
3.小鼠睾丸组织形态的变化:结果见图 1。EMP暴露后1、7、14和35 d,小鼠的睾丸组织生精上皮基膜完整,生精小管及间质组织结构正常,生精小管内各级生精细胞排列整齐、层次清楚、发育正常,管腔内可见成熟精子,与假暴露组相比无明显变化。生精小管直径结果显示,EMP暴露后1、7、14和35 d小鼠生精小管平均直径,暴露组分别为(196.85±16.65)、(196.79±14.33)、(196.35±22.71)和(198.60±25.88)μm;假暴露组分别为(204.31±27.13)、(197.07±18.11)、(194.37±21.45)和(200.59±19.36)μm,两组比较差异无统计学意义(P>0.05)。上述结果提示EMP暴露对睾丸的组织形态无明显影响。
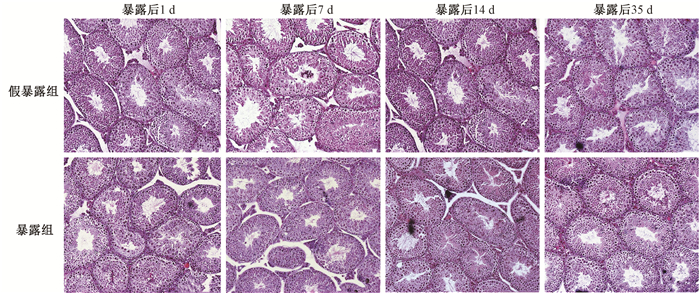
|
图 1 电磁脉冲暴露后不同时间对小鼠生精小管形态结构的影响 HE染色 ×100 Figure 1 Effects of EMP on the morphology of seminiferous tubules in mice at different times after exposure HE staining ×100 |
4.小鼠睾丸SCF和GDNF含量的变化:ELISA检测结果见表 2。与假暴露组相比,EMP暴露后1、7、14和35 d,小鼠睾丸组织中SCF和GDNF含量比较差异无统计学意义(P>0.05)。Western blot检测结果显示,与假暴露组相比,EMP暴露后1、7、14和35 d,小鼠睾丸组织中SCF和GDNF蛋白水平无明显变化(P>0.05,图 2),与ELISA结果一致。上述结果表明,本条件下EMP暴露对睾丸支持细胞的分泌功能无明显影响。
|
|
表 2 EMP暴露后不同时间两组小鼠睾丸支持细胞分泌功能的变化(pg/ml, x±s) Table 2 Effects of EMP on the secretory function of Sertoli cells in mice at different times after exposure(pg/ml, x±s) |
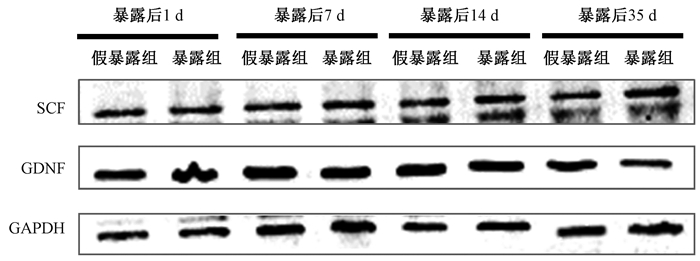
|
注:EMP.电磁脉冲;SCF.干细胞因子;GDNF.胶质源性神经营养因子 图 2 EMP暴露后不同时间小鼠睾丸分泌SCF和GDNF含量电泳图 Figure 2 Western blot results of SCF and GDNF in testis of mice at different times after EMP exposure |
讨论
生殖健康是人类繁衍的基础,但近年来,青年男性精液质量呈普遍下降趋势[6]。对雄性动物而言,睾丸是产生精子、分泌雄性激素、维系雄性特征的最重要器官[7],其结构和功能的改变将直接或间接影响精子的质量,而精子质量则与男性生殖功能密切相关。
既往研究表明,睾丸是电磁辐射的敏感靶器官之一[5],一定参数的电磁辐射暴露可导致睾丸结构和功能的改变[7-9]。EMP暴露对雄性生殖功能的影响也成为电磁生物学者们关注的热点。近年来,随着高场强EMP在食品灭菌、除尘等领域的逐渐应用,其对从业人员的健康影响也开始得到关注,但至今为止,关于高场强EMP的生物学效应,特别是对生殖的影响只有零星报道。因此,本研究以精子质量、睾丸形态结构及支持细胞分泌的活性物质为主要检测指标,探讨高场强720 kV/m EMP暴露对小鼠生殖的影响。
精子质量的观察指标通常包括精子数量、畸形率和存活率等。本实验结果显示,720 kV/m EMP单次暴露后1、7、14和35 d,小鼠精子数量、畸形率和存活率与假暴露组相比未发生明显改变,提示本实验条件下EMP暴露对精子质量无明显影响。刘合等[8]研究表明,场强873 kV/m,脉宽200 ns的宽频EMP单次暴露100个脉冲后6 h可导致大鼠睾丸组织细胞、精子存活率和精子活力出现不同程度损伤,但都可以随着照后时间的延长而得以修复,生精细胞的凋亡率在暴露后3~7 d恢复正常,精子存活率在暴露后1 d恢复至正常水平,精子活力在暴露后10 d基本恢复正常,提示873 kV/m EMP对精子质量可产生短暂的可逆性损伤。本研究结果显示,EMP暴露后1 d及更长时间精液质量未发生明显改变,推断即便本条件下EMP暴露后即刻小鼠精液质量有轻微的可逆性变化,总体对精液质量也不会有明显影响。在本实验中,应用的EMP场强为720 kV/m,与刘合等[8]所用参数较接近(873 kV/m),但两个辐射源信号脉宽差别较大,分别是40和200 ns,另外动物的种属也不同,这些可能是导致精子质量结果不一致的原因。
生精小管上皮主要由生精细胞和支持细胞构成,是精子发生的部位,其正常结构和功能的改变可直接影响生精能力。本研究结果显示,720 kV/m EMP单次暴露后小鼠生精小管及间质形态结构正常,生精小管内各级生精细胞排列整齐、层次清楚、发育正常,管腔内可见成熟精子。生精小管的直径也均未发生明显改变,结合睾丸重量与睾丸指数的结果,认为本实验条件下EMP暴露对睾丸的组织形态无明显影响。Luo等[9]研究显示,暴露于200 kV/m EMP 100或200个脉冲后,小鼠睾丸组织无明显病理改变,与本实验结果一致。而Hou等[10]研究发现,400 kV/m EMP单次暴露200个脉冲可导致小鼠血睾屏障通透性破坏,生精小管腔内出现大量凋亡或坏死的生精细胞。
支持细胞是睾丸中最早形成的、唯一与生精细胞直接接触的体细胞,不仅为生精细胞提供支架,还通过分泌多种活性物质,对精子发生起到营养和保护作用[11]。GDNF和SCF是睾丸支持细胞分泌的两种代表性活性物质,GDNF可促进未分化型精原细胞的增殖,SCF可促进精原细胞分化为圆形精子细胞[12],二者均在精子发生中发挥重要作用。据报道,60 kV/m EMP可导致大鼠原代培养的支持细胞出现不同程度的损伤,且暴露后1 h较重,随时间延长损伤逐渐减轻,至暴露后48 h可恢复正常水平[13]。本实验结果显示,720 kV/m EMP单次暴露后,小鼠睾丸组织中GDNF和SCF含量无明显改变,提示本条件下EMP暴露对睾丸支持细胞的分泌功能无显著影响。
研究表明,EMP作为一种特殊的电磁波,对生物体造成损伤的强弱与EMP的电场强度、持续时间、脉冲次数、脉宽、上升前沿等相关参数有关[9],既往报道多未给出脉宽、上升前沿等关键参数,无法进行实质性比较。文献[8, 13]和本实验室前期实验[3, 14]均发现,一定参数的低场强EMP暴露对雄性生殖具有不良影响。但本研究结果显示,本实验条件下的高场强EMP暴露对小鼠雄性生殖没有明显影响,其原因可能与EMP使用的脉冲次数较少(100次)且是单次暴露有关,此外,EMP其他物理参数,如上升前沿、脉宽、重复频率等对生物效应的影响也应该引起研究者们的重视。
综上,720 kV/m EMP单次暴露100个脉冲后1、7、14和35 d,成年雄性小鼠的一般健康状况、精子质量、睾丸形态结构及支持细胞分泌功能等均无改变,提示本研究条件下EMP暴露对小鼠的睾丸结构和生殖功能无明显影响,增加脉冲次数或反复多次暴露是否会对生物体生殖系统产生影响有待进一步研究。
利益冲突 无作者贡献声明 郭玲、薛一哲负责实验操作、数据采集、统计分析和论文撰写;李伟、丁桂荣负责指导课题设计和修改论文;张俊平、张克英、芮刚、来盼盼协助实验操作;林加金负责暴露参数计算与核实;林加金、郭国祯负责论文修改
| [1] |
Ding GR, Qiu LB, Wang XW, et al. EMP-induced alterations of tight junction protein expression and disruption of the blood-brain barrier[J]. Toxicol Lett, 2010, 196(3): 154-160. DOI:10.1016/j.toxlet.2010.04.011 |
| [2] |
Wang XW, Ding GR, Shi CH, et al. Mechanisms involved in the blood-testis barrier increased permeability induced by EMP[J]. Toxicology, 2010, 276(1): 58-63. DOI:10.1016/j.tox.2010.07.003 |
| [3] |
Li JH, Jiang DP, Wang YF, et al. Influence of electromagnetic pulse on the offspring sex ratio of male BALB/c mice[J]. Environ Toxicol Pharmacol, 2017, 54: 155-161. DOI:10.1016/j.etap.2017.06.015 |
| [4] |
Ding GR, Li KC, Wang XW, et al. Effect of electromagnetic pulse exposure on brain micro vascular permeability in rats[J]. Biomed Environ Sci, 2009, 22(3): 265-268. DOI:10.1016/S0895-3988(09)60055-6 |
| [5] |
Silva AM, Correia S, Casalta-Lopes JE, et al. The protective effect of regucalcin against radiation-induced damage in testicular cells[J]. Life Sci, 2016, 164: 31-41. DOI:10.1016/j.lfs.2016.09.003 |
| [6] |
Agarwal A, Mulgund A, Hamada A, et al. A unique view on male infertility around the globe[J]. Reprod Biol Endocrinol, 2015, 13: 37. DOI:10.1186/s12958-015-0032-1 |
| [7] |
王亚峰, 苗霞, 杨明娟, 等. 电磁脉冲暴露对雄性BALB/c幼鼠生殖系统发育的影响[J]. 辐射研究与辐射工艺学报, 2013, 31(5): 7-12. Wang YF, Miao X, Yang MJ, et al. Effects of electromagnetic pulse exposure on the development of reproduction system of m ale BALB/c mice[J]. J Radiat Res Radiat Process, 2013, 31(5): 7-12. |
| [8] |
刘合, 雷鸣嘉, 张杰, 等. 宽频电磁脉冲辐照引起大鼠生殖系统的损伤与修复[J]. 辐射研究与辐射工艺学报, 2017, 35(1): 13-20. Liu H, Lei MJ, Zhang J, et al. Effect of wide-band electromagnetic pulses on the reproductive system of rat and subsequent recovery[J]. J Radiat Res Radiat Process, 2017, 35(1): 13-20. DOI:10.11889/j.1000-3436.2017.rrj.35.010203 |
| [9] |
Luo Y, Wang X, Chen Y, et al. Effects of electromagnetic radiation on morphology and TGF-β3 expression in mouse testicular tissue[J]. Toxicology, 2013, 310: 8-14. DOI:10.1016/j.tox.2013.05.004 |
| [10] |
Hou WG, Zhao J, Li Z, et al. Effects of electromagnetic pulse irradiation on the mouse blood-testicle barrier[J]. Urology, 2012, 80(1): 225.e1-6. DOI:10.1016/j.urology.2012.04.015 |
| [11] |
李莉, 赵昱, 龚淼, 等. 铁过载损伤小鼠睾丸支持细胞[J]. 基础医学与临床, 2016, 36(3): 321-326. Li L, Zhao Y, Gong M, et al. Iron overload injures sertoli cells of mouse[J]. Basic Clin Med, 2016, 36(3): 321-326. |
| [12] |
杜乐, 周艳, 林艳云, 等. 1950 MHz GSM-Talk信号对睾丸支持细胞增殖和分泌功能的影响[J]. 辐射研究与辐射工艺学报, 2014, 32(6): 15-21. Du L, Zhou Y, Lin YY, et al. Effects of 1950 MHz GSM-Talk signal on sertoli cells proliferation and secretion[J]. J Radiat Res Radiat Process, 2014, 32(6): 15-21. DOI:10.11889/j.1000-3436.rrj.2014.32.060202 |
| [13] |
吴惠, 王德文, 王水明, 等. 不同波段电磁辐射致大鼠睾丸支持细胞的损伤效应[J]. 生物物理学报, 2011, 27(1): 38-46. Wu H, Wang DW, Wang SM, et al. The damaging effects of different bands electromagnetic radiation on the rat sertoli cells[J]. Aata Biophys Sinica, 2011, 27(1): 38-46. |
| [14] |
Yang MJ, Liu JY, Wang YF, et al. Effects of electromagnetic pulse on polydactyly of mouse fetuses[J]. Theriogenology, 2013, 80(1): 18-23. DOI:10.1016/j.theriogenology.2013.03.004 |
 2019, Vol. 39
2019, Vol. 39


