2. 北京大学肿瘤医院暨北京市肿瘤防治研究所胸部肿瘤内一科 恶性肿瘤发病机制及转化研究教育部重点实验室 100036
2. Key Laboratory of Carcinogenesis and Translational Research(Ministry of Education), Department of Thoracic Oncology, Peking University Cancer Hospital & Institute, Beijing 100142, China
非小细胞肺癌(non-small cell lung cancer,NSCLC)占肺癌的80%~85%,大多数患者在诊断时已发生远处转移,其5年生存率仅为15%左右[1-2]。随着肺癌驱动基因研究的逐步深入,肺癌靶向治疗取得了较大进展,其中表皮生长因子受体酪氨酸激酶抑制剂(epidermal growth factor receptor tyrosine kinase inhibitors,EGFR-TKIs)已广泛应用于伴EGFR基因突变晚期非小细胞肺癌的治疗。然而,EGFR-TKIs治疗后不可避免经过的耐药现象,成为靶向治疗临床上棘手的问题。目前,针对EGFR-TKIs治疗出现获得性耐药的机制已经开展大量研究,但对获得性耐药的失败部位及模式的分析仅有少量报道。庄梦琪和韩俊庆[3]曾对山东大学肿瘤医院52例进行靶向治疗后进展的NSCLC患者进行分析,得到的结论是EGFR-TKIs耐药主要进展部位依次为肺及中枢神经系统,在靶向药物治疗中,应加强对肺部及中枢神经系统的监测。本研究回顾性分析北京大学肿瘤医院胸内一科接受EGFR-TKIs治疗的晚期NSCLC患者出现获得性耐药的失败模式,并分析其临床意义,初步分析失败后接受放疗对生存的影响,为后期探索可行的局部治疗策略提供依据。
资料与方法1.研究对象:入组标准:①年龄18~80岁。②病理组织学或细胞学检查证实为非小细胞肺癌。③组织/血液检测到与疗效相关的EGFR敏感突变(如G791X、19外显子缺失、L858R、L861Q)。④接受EGFR-TKIs治疗后出现获得性耐药。⑤至少具有一个可测量的病灶。⑥随访资料全面。⑦疾病进展时符合Jackman等[4]制定的获得性耐药的定义。排除标准:①妊娠期和哺乳期的妇女。②有严重不可控制的感染。③有严重肝、肾功能异常或心脏病史及精神障碍者。
2.资料收集:采集上述入组患者的一般资料、EGFR突变状态、治疗情况、获得性耐药时进展部位及个数、进展病灶的最大直径、耐药后治疗方案等。根据患者头颅MRI、胸及腹部CT/MRI、浅表淋巴结超声、全身骨扫描或PET-CT等检查完成进展病灶的资料采集。
3.评效及随访:入组患者均在开始EGFR-TKIs治疗1个月后定期评估疗效。按照美国癌症研究所提出的实体瘤反应评价标准1.1版(Response Evaluation Criteria in Solid Tumors RECIST 1.1)[5]进行疗效评价,分为完全缓解(CR)、部分缓解(PR)、稳定(SD)和进展(PD)。评效CR、PR、SD的患者每2个月接受1次胸部CT和其他相关影像学检查,评效PD的患者根据临床具体进展类型改变治疗方案并定期随访。总生存期(overall survival, OS)定义为从诊断日期开始至死亡或末次随访日期。无进展生存期(progression-free survival, PFS)定义为首次接受靶向治疗开始至疾病进展。失败后再治疗的PFS定义为首次靶向治疗失败后再次治疗开始至疾病进展或末次随访日期,失败后再治疗的OS定义为首次靶向治疗失败后再次治疗开始至死亡或末次随访日期。随访信息由患者门诊复诊病历及电话随访获得,末次随访日期为2016年7月31日,本组患者随访率为100%。截至末次随访日期死亡84例(75.7%),存活27例(24.3%)。
4.统计学处理:所有数据资料采用SPSS 22.0软件进行处理。计数资料的组间比较采用χ2检验,采用Kaplan-Meier法进行生存分析。P < 0.05为差异有统计学意义。
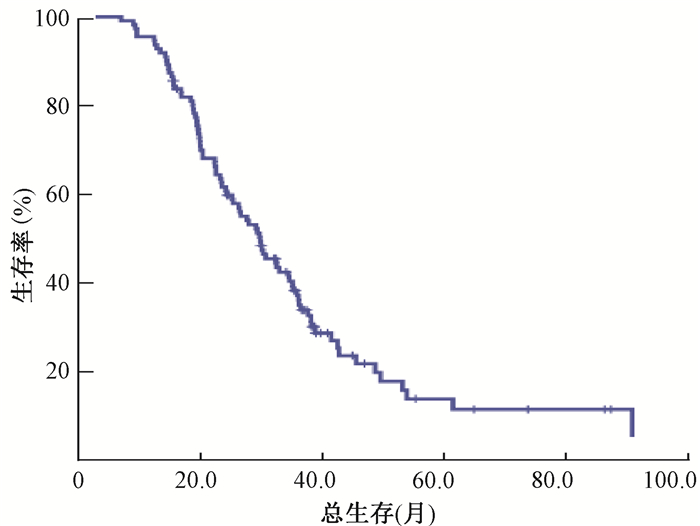
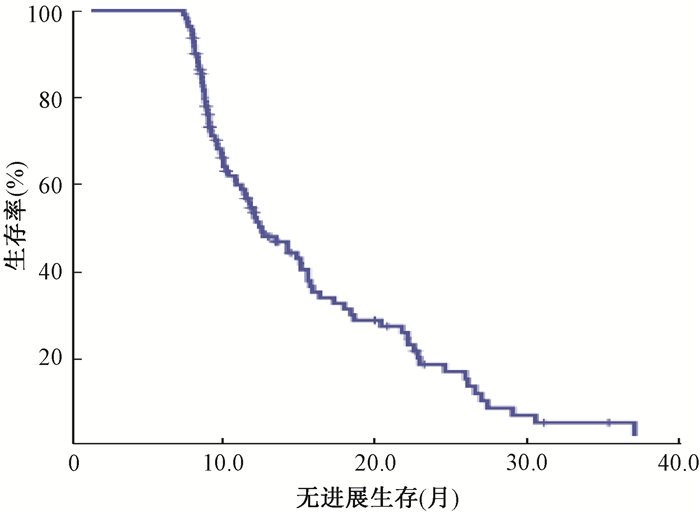
结果1.临床资料:筛选2009年1月至2013年6月北京大学肿瘤医院胸内一科收治的NSCLC患者1 526例,其中248例使用EGFR-TKIs,符合入组条件患者111例。中位随访时间27.7个月(6.6~85.3个月),中位生存期29.8个月(7.1~90.7个月),中位无进展生存期10.3个月(6.2~30.5个月)。患者年龄35~80岁,中位年龄59岁。生存结果示于图 1、2,各项临床特征列于表 1。
|
图 1 全组患者总生存 Figure 1 Overall survival for the whole group |
|
图 2 全组患者无进展生存 Figure 2 Progression free survival for the whole group |
|
|
表 1 患者临床特征 Table 1 The basic characteristics of patients |
2. EGFR-TKIs治疗相关资料:全组患者接受EGFR-TKIs为一线治疗64例(57.7%),二线及以上治疗47例(42.3%);靶向治疗时存在脑转移34例(30.6%);单纯靶向治疗者92例(82.9%),靶向治疗同时进行放疗者11例(9.9%),同时化疗者4例(3.6%),详见表 2。
|
|
表 2 EGFR-TKIs治疗相关资料 Table 2 EGFR-TKIs treatment related data |
3.失败模式与生存分析
(1) 失败模式:111例患者中,原有病灶进展65例(58.6%),新出现病灶23例(20.7%),原有病灶进展同时出现新发病灶23例(20.7%),3组患者中位OS分别为29.8、25.3、35.2个月,差异无统计学意义(P>0.05,表 3)。
|
|
表 3 患者失败模式分析 Table 3 Analysis of failure pattern |
(2) 失败部位:失败部位在胸腔内57例(51.4%),远处转移21例(18.9%),胸腔内失败伴远处转移33例(29.7%),3组患者生存无明显差异,中位OS分别为30.7、30.3、24.2个月(P>0.05)。单个部位失败70例(63.1%),≥2个部位失败41例(36.9%),两组患者中位OS分别为29.4、30.7个月(P>0.05);单个部位失败患者中胸腔内失败43例(61.4%),脑部失败8例(11.4%),其他部位失败19例(27.1%),中位OS分别为30.1、29.2、25.3个月,差异无统计学意义(P>0.05,表 3)。
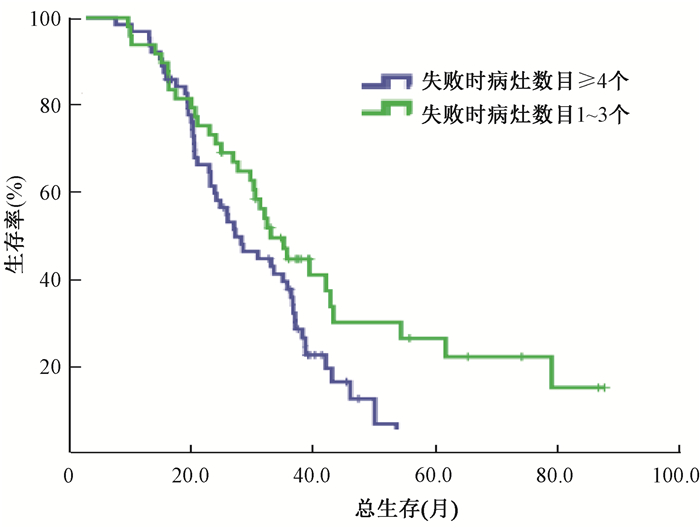
(3) 失败时病灶数目:≥4的病灶失败者63例(56.8%),失败病灶数目为1、2、3的分别为25例(22.5%)、17例(15.3%)、6例(5.4%);寡进展患者(失败时病灶数目1~3个)与≥4个进展者比较,生存期延长,中位OS分别为32.5、26.7个月,差异有统计学意义(χ2=4.888,P < 0.05);在寡进展患者中,1、2、3个病灶失败者中位OS分别为35.1、26.3、30.1个月,差异无统计学意义(P>0.05)。见图 3及表 4。
|
图 3 EGFR-TKIs治疗失败时不同病灶数患者的总生存 Figure 3 Overall survival for patients with different number of lesions during EGFR-TKIs failure |
|
|
表 4 患者失败病灶分析 Table 4 Analysis of failure lesions in patients |
(4) 失败时病灶大小:失败时最大病灶≤4 cm者96例(86.5%),最大病灶>4 cm者15例(13.5%),两组生存无明显差异(中位OS分别为29.9、26.3个月,P>0.05,表 4)。
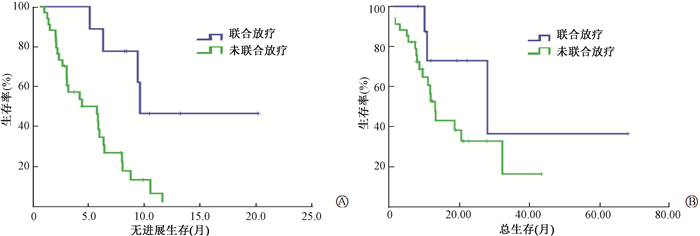
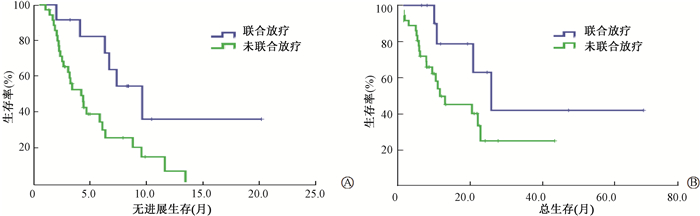
(5) 对失败后联合放疗情况进行分析:仅胸腔内失败患者43例,失败后接受胸部放疗者9例(20.9%),未放疗者34例(79.1%),联合胸部放疗患者再次治疗PFS明显延长,两组中位PFS分别为9.6、5.7个月(χ2=9.013,P < 0.05),失败后再治疗的中位OS也较未联合胸部放疗者延长,但差异无统计学意义(28.1、13.2个月,P>0.05)。48例寡进展患者中接受放疗12例(25.0%),未放疗36例(75.0%),接受放疗者再次治疗PFS明显延长,中位PFS分别为9.6、4.2个月,差异有统计学意义(χ2=5.482,P < 0.05),失败后再治疗的中位OS也有所改善,分别为26.0、11.8个月,差异无统计学意义(P>0.05)。见图 4、5及表 5。
|
图 4 仅胸腔内失败的患者再次治疗的无进展生存(A)及总生存(B) Figure 4 Progression free survival (A) and Overall survival (B) of re-treatment in patients with intrathoracic failure |
|
图 5 寡进展患者再次治疗的无进展生存(A)及总生存(B) Figure 5 Progression free survival (A) and overall survival (B)of re-treatment in patients with oligo-progress |
|
|
表 5 失败后联合放疗情况分析 Table 5 Analysis of combined radiotherapy after failure |
讨论
随着分子生物学研究的不断深入,EGFR-TKIs在晚期NSCLC分子靶向治疗方面取得了突破性进展,使患者的中位无进展生存期和总生存期延长。但是临床随访中发现在使用EGFR-TKIs治疗平均10~14个月后,往往最终会出现疾病进展[6-7],临床称之为获得性耐药。而明确EGFR-TKIs治疗后失败部位将对非小细胞肺癌后续治疗模式具有重要的指导意义。
本研究回顾性分析了北京大学肿瘤医院单中心111例晚期NSCLC患者接受靶向治疗后的失败模式及对生存的影响,包括失败部位、是否原有病灶失败或出现新的病灶导致失败,并观察失败时病灶数目、病灶最大直径,以及失败后联合放疗的情况,探讨局部治疗在靶向治疗耐药的后续治疗价值。全组患者中位生存期29.8个月,与之前研究结果相仿,在EGFR基因突变阳性的患者中TKI治疗有效率高达70%~80%,其中位生存时间达20~30个月[7-10]。本组患者耐药后58.6%出现原有病灶进展,20.7%出现新发病灶;而63.1%的患者为单个部位失败,且主要失败部位在胸腔内。可见患者失败原因主要还是原有病灶的进展,且胸腔内失败最多,本组患者胸腔失败率为51.4%。这与国外研究结果相似,Al-Halabi等[11]的研究中,EGFR-TKI治疗期间局部进展最多见于原始病灶进展(47%),原始病灶进展与新发转移灶共存(32.6%),单纯出现新发转移病灶则较为少见(20.4%)。美国Omuro等[12]研究表明,对吉非替尼有应答的NSCLC患者中57%(14/21)首次失败部位在胸腔内。
已经进展的EGFR突变型肿瘤,在停用TKI治疗一段时间后,可以再次对EGFR-TKI治疗产生反应[13]。在患者疾病进展后,继续给予EGFR-TKI治疗,仍有临床获益[14]。在NSCLC患者应用EGFR-TKIs治疗至疾病进展后,临床医生没有停用EGFR-TKIs的一个原因是,停用EGFR-TKIs后可能出现NSCLC“反弹进展”或者是“爆发式”生长,可能是由于对EGFR-TKIs敏感的快速生长的NSCLC细胞生长加速[15]。Chaft等[16]在一项回顾性研究中,EGFR突变型肺癌患者应用吉非替尼或厄洛替尼治疗耐药后,停用EGFR-TKIs平均8 d后,约23%(14/61)的患者出现严重的疾病进展,需要住院治疗或者死亡。
Yang等[17]提出的晚期NSCLC患者EGFR-TKIs获得性耐药的后续治疗,就是基于疾病进展模式的个体化治疗。在其他部位病灶控制的前提下,仅仅一处或少数区域的病灶进展,可以考虑继续靶向治疗联合局部治疗。在本研究中,寡进展患者与≥4个病灶进展者比较,生存期明显延长,中位OS分别为32.5、26.7个月,可能与该组患者进展相对缓慢,多数继续口服靶向药物,且部分患者联合了局部放疗相关。本研究继续对失败后联合放疗情况进行分析,发现仅胸腔内进展及寡进展患者在失败后接受放疗者PFS均较未放疗者明显延长,分别为9.6个月vs. 5.7个月,9.6个月vs. 4.2个月,两组患者再治疗的OS也较未放疗组有所延长,但无统计学意义。类似结果亦有报道,Yu等[18]在2013年JTO的研究显示,局部治疗(放疗及手术)配合EGFR-TKIs的继续治疗策略对于EGFR-TKIs耐药患者有效,无进展生存期为10个月,自局部治疗起总生存为41个月。Weickhardt等[19]研究显示,对于中枢神经系统进展或中枢神经系统以外孤立进展的EGFR突变的晚期非小细胞肺癌患者,局部治疗联合EGFR-TKIs均能显示出良好的PFS。既然一线治疗后疾病进展多发生于基线时已存在的病灶,因此在针对一线治疗后残存的肿瘤病灶行巩固治疗有可能推迟疾病进展时间。基于以上设想,Gomez等[20]探讨了积极的局部巩固治疗用于系统治疗后无进展的晚期NSCLC患者中的获益。与维持治疗相比,局部巩固放疗显著延长PFS 8个月(11.9个月vs. 3.9个月,HR 0.35),显著推迟新发转移灶出现时间6.2个月(11.9个月vs. 5.7个月),进一步证实了局部巩固治疗可以延长一线治疗无进展生存,并能改善总生存。Xu等[21]的研究表明,靶向治疗联合巩固性局部消融治疗显著延长患者PFS及OS;同部分局部消融治疗及无消融治疗组相比,原发灶及寡转移病灶的局部消融治疗显著降低了疾病进展风险及死亡风险(HR 0.47、0.32、0.56、0.42)。而王建芳等[22]的研究则分析了埃克替尼联合胸部原发灶放疗的疗效及安全性,结果表明,联合治疗组PFS显著延长,ORR明显升高,且不良反应可耐受。
经过10余年的研究,1代EGFR-TKIs耐药机制已基本明确,当患者出现耐药时,建议再次活检以明确耐药机制,其中,T790 M突变是最常见的耐药机制,约占患者的50%甚至更高[23]。3代EGFR-TKI AZD9291的Ⅰ期及Ⅱ期临床研究AURA结果已经发表,EGFR-TKI耐药后T790 M突变的患者接受AZD9291治疗的ORR为61%~70%,mPFS为9.6~9.9个月;但对于T790 M突变阴性患者,AZD9291的ORR和中位PFS分别仅为21%和2.8个月[24-25]。而在本研究中,由于当时条件限制,多数患者未能进行T790 M基因检测。在这种情况下,EGFR-TKI耐药后仅胸腔内进展及寡进展的患者联合局部放疗的中位PFS高达9.6个月,显著高于未联合组,此结果与T790 M阳性患者改服3代TKI疗效相仿。局部治疗,尤其是放射治疗,随着放疗技术的不断进展,能够以更安全更有效的方式使患者获益,在EGFR-TKI耐药进展的后线治疗中有着十分重要的意义。
综上所述,对于一代EGFR-TKI原发耐药的患者根据指南建议进行T790 M基因检测,如果阳性可以改用3代EGFR-TKI进行治疗。但是如果T790 M突变阴性或没有条件进行相应检测的这部分患者,在出现胸腔内进展或寡进展时,进行局部干预是非常重要的。在本研究中,仅胸腔内进展及寡进展联合放疗患者,PFS较未放疗者明显延长,是否能转化为OS的延长尚需进一步研究。因此,有必要开展前瞻性临床研究,进一步证实1代EGFR-TKIs原发耐药后联合放疗的意义。
利益冲突 所有作者与单位未因此项研究接受过第三方资助或服务,没有引起利益冲突的其他关系作者贡献声明 武亚娟负责论文设计和撰写;赵军提供病例资料;姜蕾蕾负责初期论文起草;石安辉提供研究思路和论文审校;尤静负责随访及数据统计学处理;朱广迎指导论文撰写
| [1] |
Ferlay J, Soerjomataram I, Dikshit R, et al. Cancer incidence and mortality worldwide:sources methods and major patterns in GLOBOCAN 2012[J]. Int J Cancer, 2015, 136(5): E359-E386. DOI:10.1002/ijc.29210 |
| [2] |
Shi Y, Au JS, Thongprasert S, et al. A prospective, molecular epidemiology study of EGFR mutations in Asian patients with advanced non-small-cell lung cancer if adenocarcinoma histology(PIONEER)[J]. J Thorc Oncol, 2014, 9(2): 154-162. DOI:10.1097/JTO.0000000000000033 |
| [3] |
庄梦琪, 韩俊庆.晚期非小细胞肺癌靶向药物治疗失败模式的临床分析[D].济南: 山东大学, 2014. Zhuang MQ, Han JQ. Recurrence patterns in patients with advanced non-small cell lung cancer after treated with epidermal growth factor receptor tyrosine kinase inhibitors[D]. Jinan: Shandong University, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10422-1014310093.htm |
| [4] |
Jackman D, Pao W, Riely GJ, et al. Clinical definition of acquired resistance to epidermal growth factor receptor tyrosine kinase inhibitors in non-small-cell-lung cancer[J]. J Clin Oncol, 2010, 28(2): 357-360. DOI:10.1200/JCO.2009.24.7049 |
| [5] |
Eisenhauer EA, Therasse P, Bogaerts J, et al. New response evaluation criteria in solid tumours:revised RECIST guideline (version 1.1)[J]. Eur J Cancer, 2009, 45(2): 228-247. DOI:10.1016/j.ejca.2008.10.026 |
| [6] |
Mok TS, Wu YL, Thongprasert S, et al. Gefitinib or carboplatin-paclitaxel in pulmonary adenocarcinoma[J]. N Engl J Med, 2009, 361(10): 947-957. DOI:10.1056/NEJMoa0810699 |
| [7] |
Paz-Ares L, Soulières D, Melezínek I, et al. Clinical outcomes in non-small-cell lung cancer patients with EGFR mutations:pooled analysis[J]. J Cell Mol Med, 2010, 14(1-2): 51-69. DOI:10.1111/j.1582-4934.2009.00991.x |
| [8] |
Morita S, Okamoto I, Kobayashi K, et al. Combined survival analysis of prospective clinical trials of gefitinib for non-small cell lung cancer with EGFR mutations[J]. Clin Cancer Res, 2009, 15(13): 4493-4498. DOI:10.1158/1078-0432.CCR-09-0391 |
| [9] |
Rosell R, Moran T, Queralt C, et al. Screening for epidermal growth factor receptor mutations in lung cancer[J]. N Engl J Med, 2009, 361(10): 958-967. DOI:10.1056/NEJMoa0904554 |
| [10] |
Petrelli F, Borgonovo K, Cabiddu M, et al. Efficacy of EGFR tyrosine kinase inhibitors in patients with EGFR-mutated non-small-cell lung cancer:a meta-analysis of 13 randomized trials[J]. Clin Lung Cancer, 2012, 13(2): 107-114. DOI:10.1016/j.cllc.2011.08.005 |
| [11] |
Al-Halabi H, Sayegh K, Digamurthy SR, et al. Pattern of failure analysis in metastatic EGFR-mutant lung cancer treated with tyrosine kinase inhibitors to identify candidates for consolidation stereotactic body radiation therapy[J]. J Thorac Oncol, 2015, 10(11): 1601-1607. DOI:10.1097/JTO.0000000000000648 |
| [12] |
Omuro AM, Kris MG, Miller VA, et al. High incidence of diseaserecurrence in the brain and leptomeninges in patients with nonsmall cell lung carcinoma after response to gefitinib[J]. Cancer, 2005, 103(11): 2344-2348. DOI:10.1002/cncr.21033 |
| [13] |
Oxnard GR, Janjigian YY, Arcila ME, et al. Maintained sensitivity to EGFR tyrosine kinase inhibitors in EGFR-mutant lung cancer recurring after adjuvant erlotinib or gefitinib[J]. Clin Cancer Res, 2011, 17(19): 6322-6328. DOI:10.1158/1078-0432.CCR-11-1080 |
| [14] |
Oxnard GR, Lo P, Jackman DM, et al. Delay of chemotherapy through use of post-progression erlotinib in patients with EGFR-mutant lung cancer[C]. 48th Annual Meeting of the American Society of Clinical Oncology (ASCO), Chicago, 2012.
|
| [15] |
Nguyen KS, Kobayashi S, Costa DB, et al. Acquired resistance to epidermal growth factor receptor tyrosine kinase inhibitors in non-small-cell lung cancer dependent on the epidermal growth factor receptor pathway[J]. Clin Lung Cancer, 2009, 10(4): 281-289. DOI:10.3816/CLC.2009.n.039 |
| [16] |
Chaft JE, Oxnard GR, Sima CS, et al. Disease flare after tyrosine kinase inhibitor discontinuation in patients with EGFR-mutant lung cancer and acquired resistance to erlotinib or gefitinib:implications for clinical trial design[J]. Clin Cancer Res, 2011, 17(19): 6298-6303. DOI:10.1158/1078-0432.CCR-11-1468 |
| [17] |
Yang JJ, Chen HJ, Yan HH, et al. Clinical modes of EGFR tyrosine kinase inhibitor failure and subsequent management in advanced non-small cell lung cancer[J]. Lung Cancer, 2013, 79(1): 33-39. DOI:10.1016/j.lungcan.2012.09.016 |
| [18] |
Yu HA, Sima CS, Huang J, et al. Local therapy with continued EGFR tyrosine kinase inhibitor therapy as a treatment strategy in EGFR-mutant advanced lung cancers that have developed acquired resistance to EGFR tyrosine kinase inhibitors[J]. J Thorac Oncol, 2013, 8(3): 346-351. DOI:10.1097/JTO.0b013e31827e1f83 |
| [19] |
Weickhardt AJ, Scheier B, Burke JM, et al. Local ablative therapy of oligoprogressive disease prolongs disease control by tyrosine kinase inhibitors in oncogene-addicted non-small-cell lung cancer[J]. J Thorac Oncol, 2012, 7(12): 1807-1814. DOI:10.1097/JTO.0b013e3182745948 |
| [20] |
Gomez DR, Blumenschein GR Jr, Lee JJ, et al. Local consolidative therapy versus maintenance therapy or observation for patients with oligometastatic non-small-cell lung cancer without progression after first-line systemic therapy:a multicentre, randomised, controlled, phase 2 study[J]. Lancet Oncol, 2016, 17(12): 1672-1682. DOI:10.1016/S1470-2045(16)30532-0 |
| [21] |
Xu Q, Zhou F, Liu H, et al. Consolidative local ablative therapy improves the survival of patients with synchronous oligometastatic NSCLC harboring EGFR activating mutation treated with first-line EGFR-TKIs[J]. J Thorac Oncol, 2018, 13(9): 1383-1392. DOI:10.1016/j.jtho.2018.05.019 |
| [22] |
王建芳, 孙彩萍, 刘建江, 等. 埃克替尼联合放疗治疗晚期非小细胞肺癌的随机对照研究[J]. 中华放射医学与防护杂志, 2017, 37(4): 269-272, 281. Wang JF, Sun CP, Liu JJ, et al. Randomized controlled trial of icotinib concurrent with thoracic radiotherapy for treating advanced non-small cell lung cancer(NSCLC)[J]. Chin J Radiol Med Prot, 2017, 37(4): 269-272, 281. DOI:10.3760/cma.j.issn.0254-5098.2017.04.006 |
| [23] |
Camidge DR, Pao W, Sequist LV, et al. Acquired resistance to TKIs in solid tumours:learning from lung cancer[J]. Nat Rev Clin Oncol, 2014, 11(8): 473-481. DOI:10.1038/nrclinonc.2014.104 |
| [24] |
Jänne PA, Yang JC, Kim DW, et al. AZD9291 in EGFR inhibitor-resistant non-small-cell lung cancer[J]. N Engl J Med, 2015, 372(18): 1689-1699. DOI:10.1056/NEJMoa1411817 |
| [25] |
Goss G, Tsai CM, Shepherd FA, et al. Osimertinib for pretreated EGFR Thr790Met-positive advanced non-small-cell lung cancer (AURA2):a multicentre, open-label, single-arm, phase 2 study[J]. Lancet Oncol, 2016, 17(12): 1643-1652. DOI:10.1016/S1470-2045(16)30508-3 |
 2019, Vol. 39
2019, Vol. 39


