乳腺癌是我国女性最常见的恶性肿瘤,保乳术后放射治疗是早期乳腺癌的标准治疗模式。由于解剖位置的因素,左乳癌患者在放疗时部分心脏结构不可避免地受到照射,放射性心脏损伤已成为乳腺癌非肿瘤性因素死亡的主要原因之一[1]。如何在放疗中减少心脏受量,降低心血管事件的发病风险成为近年来关注和研究的热点。临床上乳腺癌的放疗计划种类较多,但大多数在进一步降低心脏受照剂量时往往会导致靶区剂量的亏损或均匀度的显著下降,从而增加肿瘤复发的风险或降低保乳效果[2]。本研究利用混合调强放疗兼顾适形放疗和调强放疗技术的特点,考虑到患者的呼吸运动影响,将多叶准直器(MLC)遮挡技术引入其中,探寻左乳癌保乳术后临床放射治疗中,在保证原计划靶区剂量特征优势的前提下进一步减少心脏受照剂量的实用方法。
资料与方法1.一般临床资料:选择2016年6月至2017年2月在苏州大学附属第二医院放疗科收治的左侧乳腺癌保乳术后全乳放疗患者18例,年龄30~62岁(中位年龄43岁)。所有患者均经病理证实并签署知情同意书。
2. CT扫描与图像获取:患者取仰卧位于乳腺托架上,患侧上肢外举至于支架上,调整乳腺托架各参数使患侧乳房充分暴露。在自由呼吸状态下,采用美国GE公司Discovery CT590 RT大孔径CT进行3DCT扫描,扫描范围从颏下到膈下5 cm,扫描层厚为2.5 mm。3DCT扫描结束后保持患者体位不变行4DCT扫描,并根据呼吸信号将每个呼吸周期的CT图像平均分为10个呼吸时相,其中CT0%代表吸气末,CT50%代表呼气末。将3DCT和4DCT图像传至Pinnacle 9.8治疗计划系统,以3DCT图像为基准,4DCT的各个时相与其进行配准。
3.靶区与危及器官勾画:先由高年资医师在4DCT各个时相进行临床靶体积(CTV)的勾画,范围包括患侧乳腺及胸壁,不包括皮肤、胸大小肌、肋骨和肋间肌(除非这些部位受侵)[3]。将各时相的CTV拷贝至3DCT图像确定出内靶区(ITV),ITV边缘外扩5 mm定义为计划靶区(PTV),前界限皮肤表面下5 mm。勾画患侧肺、对侧乳腺及心脏作为患者的危及器官,同时根据文献报道[4]勾画出心脏主要的亚结构:左心房(left atrium, LA)、右心房(center atrium, RA)、左心室(left ventricle, LV)、右心室(center ventricle, RV)、左前降支冠状动脉(left anterior descending coronary artery, LADA)及右侧冠状动脉(center coronary artery, RCA),见图 1。
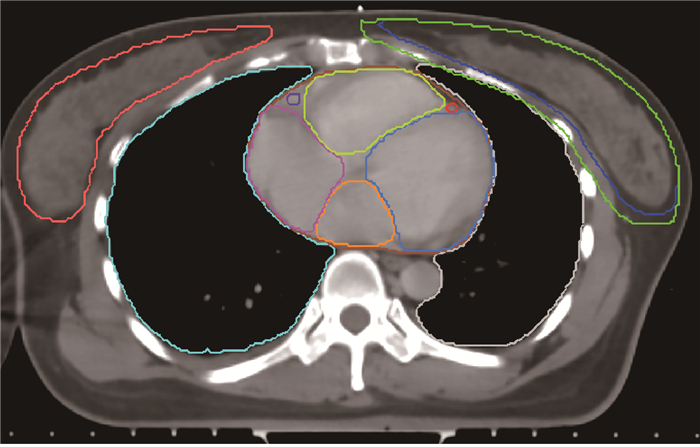
|
注:蓝色为内靶区,绿色为计划靶区,棕色为全心脏,金色为左心房,粉色为右心房,浅蓝色为左心室,黄色为右心室,红色为左前降支冠状动脉,紫色为右侧冠状动脉,橙色为右侧乳腺,灰色为左肺,天蓝色为右肺 图 1 左乳癌保乳术后放疗靶区和危及器官勾画示例 Figure 1 Left breast cancer breast-conserving postoperative radiotherapy target area and organ at risk delineation example |
4.计划设计:在治疗计划系统中采用医科达Synergy加速器,6 MV X射线为每位患者制定混合调强放疗(hybrid intensity-modulated radiotherapy, H_IMRT)计划以及为了降低心脏受照剂量而采用MLC遮挡技术的混合调强放疗(heart sparing hybrid intensity-modulated radiotherapy, HSH_IMRT)计划。处方剂量为50 Gy,分25次照射,所有计划完成时95%的PTV体积达到处方剂量,110%处方剂量覆盖的靶区体积不超过5%。危及器官的剂量限制为:心脏V30 < 10%,V40 < 5%;患侧肺V20 < 25%,平均剂量Dmean < 15 Gy;对侧乳腺Dmean < 1 Gy[3]。计划设计过程经过反复调整,一直优化到无明显改善为止。
H_IMRT计划由1对切线对穿射野的适形计划和1个两野的逆向调强计划混合组成。适形计划部分采用两个不带楔形板,总剂量为40 Gy的适形切线射野,前向MLC外扩1.5~2.0 cm。逆向调强计划部分采用两个与适形计划角度相同或相近的射野,在适形计划剂量的基础上进行优化,限制总子野数为25,剂量总量为10 Gy,用以修正靶区剂量的均匀度,见图 2。HSH_IMRT计划将原H_IMRT计划中两个适形切线射野在射野方向观视图(beam eye view, BEV)下,将与心脏重叠的MLC往射野内移动0.5~1.0 cm,以减少射野内的心脏体积,在原有的两个调强射野方向偏开5°~10°增加两个调强射野。在适形计划剂量的基础上进行优化,限制总子野数为25个,给予靶区调强成分的照射剂量,适形计划与调强计划的剂量比重与H_IMRT计划相同。
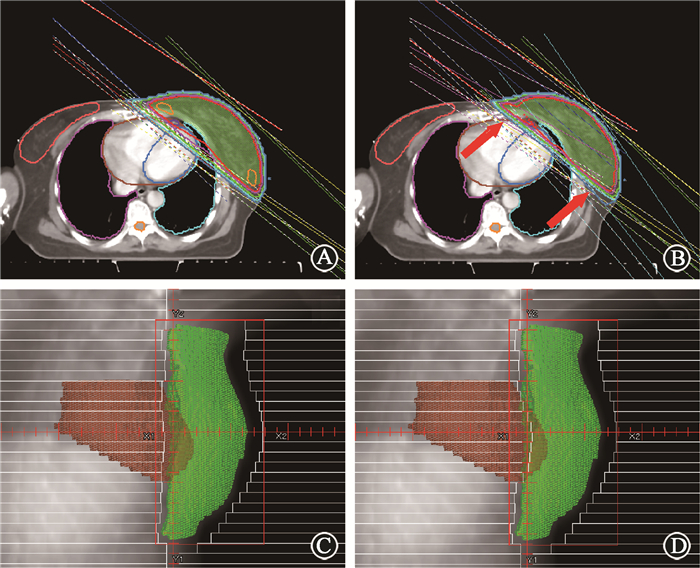
|
注:棕色区域为心脏,绿色区域为PTV 图 2 两种计划的射野设置 A、B.分别为左乳癌保乳术后H_IMRT和HSH_IMRT计划的射野与剂量分布图示例;C、D.分别为H_IMRT和HSH_IMRT计划中适形野的射野方向观图示例 Figure 2 Field setting for two radiotherapy plans A-B. The examples of the field and the dose distribution of the H_IMRT and HSH_IMRT plans for left breast cancer after breast conserving operation, respectively; C-D. The BEV for the conformal field in the H_IMRT and HSH_IMRT plans |
5.治疗计划验证:采用Compass系统(比利时IBA公司)对患者计划进行3D剂量的验证,该系统由悬挂于加速器机头的MatriXX二维电离室矩阵和基于CT图像进行剂量重建的软件系统组成。MatriXX电离室矩阵由1 020个平行板电离室组成,有效测量面积为24.4 cm×24.4 cm,电离室的灵敏体积为0.07 cm3,相邻电离室中心间距为7.62 mm。使用前将MatriXX固定在加速器机头并将角度传感器固定在机架上,依次进行冷、热本底测量,几何位置校准及绝对剂量的校准,然后执行治疗计划。利用电离室矩阵实测出的射野通量图,结合模型预测响应及之前在系统中建立的加速器剂量模型计算出患者的3D剂量分布,对治疗计划进行剂量验证。
6.计划评价指标:为了比较HSH_IMRT与H_IMRT计划的质量,采集了靶区PTV和主要危及器官的剂量学参数。包括靶区D2%、D98%、Dmean、均匀指数(HI)、适形指数(CI);心脏V10、V20、V30、V40、Dmean;左心室、右心房、左心室、右心室、左前降支冠状动脉及右侧冠状动脉的Dmax、Dmean;患侧肺V20、Dmean。根据国际辐射单位与测量委员会(ICRU)83号报告建议,选取D2%(近似最大剂量)、D98%(近似最小剂量)和D50%(中位剂量)计算靶区的均匀指数:HI=(D2%-D98%)/D50%,HI越小说明靶区的剂量分布均匀性越好。靶区适形指数CI=(PTVref/VPTV)×(PTVref/Vref),PTVref为参考等剂量线包绕的PTV体积,VPTV为PTV体积,Vref为参考等剂量线包绕的总体积,CI越接近1说明该计划剂量分布适形性越好。
7.统计学处理:应用SPSS 19.0软件进行分析。以H_IMRT的计划结果和剂量验证结果为对照,数据符合正态分布,以x±s表示。分别将HSH_IMRT的靶区和危及器官剂量学参数与其进行配对t检验。P < 0.05为差异有统计学意义。
结果1.计划可行性:本研究所采用的H_IMRT和HSH_IMRT计划结果在靶区和危及器官的剂量学参数、射野的数目与分布、计划执行效率等方面均能满足临床要求,获得临床医师的认可。
2.靶区剂量:治疗计划结果显示与H_IMRT相比较,HSH_IMRT靶区PTV的D2%降低,D98%增加,剂量均匀性更好,CI值的差异无统计学意义(P>0.05);剂量验证结果显示与H_IMRT相比,HSH_IMRT除靶区PTV的D2%降低以外,其余参数的差异无统计学意义(P>0.05),见表 1,2。在两种计划剂量验证结果中靶区Dmean测量值与治疗计划系统(TPS)计算值差异的平均值< 2.5%,靶区的γ通过率平均值都在95%以上。
|
|
表 1 18例左乳腺癌患者保乳术后H_IMRT与HSH_IMRT计划靶区剂量计算结果比较(x±s) Table 1 Comparison of target dose calculations′ results between H_IMRT and HSH_IMRT for 18 patients with left breast cancer after breast conserving surgery(x±s) |
|
|
表 2 18例左乳腺癌患者保乳术后H_IMRT与HSH_IMRT计划靶区剂量验证结果比较(x±s) Table 2 Comparison of target dose validation results between H_IMRT and HSH_IMRT for 18 patients with left breast cancer after breast conserving surgery(x±s) |
3.危及器官受量:治疗计划结果显示,与H_IMRT相比较,HSH_IMRT中全心脏的V10、V20、V30、V40及Dmean均有明显的降低,Dmean较,前者降低23.67%;左心房、右心房、左心室、右心室、左前降支冠状动脉和右侧冠状动脉的Dmax均有降低,Dmean较前者分别下降4.05%、7.25%、23.86%、24.83%、16.23%和8.44%。剂量验证结果显示,HSH_IMRT中全心脏的V10、V20、V30、V40及Dmean比H_IMRT有明显降低,其中Dmean降低24.88%;左心房、右心房、左心室、右心室、左前降支冠状动脉和右侧冠状动脉的Dmean分别下降5.56%、9.64%、23.51%、26.82%、13.79%和7.22%;除左心室与右心室外,心脏其他结构的Dmax均有降低。此外,治疗计划与剂量验证的结果均显示,在HSH_IMRT中患侧肺的V20和Dmean较H_IMRT降低,见表 3。在两种计划剂量验证结果中各危及器官的Dmean测量值与TPS计算值差异的平均值< 2.0%,靶区的γ通过率平均值都在95%以上。
|
|
表 3 18例左乳腺癌患者保乳术后H_IMRT与HSH_IMRT危及器官剂量比较(x±s) Table 3 Dose comparison of organs in H_IMRT and HSH_IMRT after breast conserving surgery in 18 patients with left breast cancer(x±s) |
讨论
随着筛查手段的普及和对相关治疗技术的不断深入研究,乳腺癌患者生存期得到明显延长,放射性心脏损伤是乳腺癌放射治疗重要的临床并发症,成为乳腺癌非肿瘤性因素死亡的主要原因之一。Darby等[5]发现心脏平均剂量每增加1 Gy,发生冠状动脉疾病事件的概率就呈线性地增长7.4倍,并且没有明显的阈值,这种增长从接受辐射后的几年开始并持续至少20年。心脏不良反应已被视为乳腺癌,特别是左侧乳腺癌放疗患者的重要并发症,是制约长期疗效的关键因素[6]。由于心脏放射性损伤潜伏期长且目前暂无有效的治疗方法,故其预防显得十分重要,在进行乳腺放疗时应尽量减少心脏的受照剂量,以期降低远期心脏病的死亡风险。
本研究选取的H_IMRT技术将静态照射与调强照射两种方式相结合,靶区大部分的处方剂量通过静态适形射野沿内外切线野的方向给予,避免了大面积的肺组织和心脏受到低剂量照射,剩余处方剂量通过调强射野优化,增加了靶区剂量的均匀度。同时,静态适形射野前界的外放可减少靶区因呼吸运动等影响导致的“漏照”,提高了治疗的准确度[7-8]。正因为H_IMRT技术的明显优势,目前国内的各大医院已经陆续开展此种技术,其中以4个射野的H_IMRT最为常见[9]。本研究基于左乳癌保乳术后患者在自由呼吸状态下的4DCT图像确定肿瘤靶区,将原H_IMRT计划的两个适形射野的MLC叶片对心脏组织进行部分遮挡以减少其受照的体积与剂量,同时增加两个调强射野来进行整体优化,以弥补适形射野中MLC叶片遮挡造成的靶区内外两侧剂量的不足。治疗计划验证所采用的Compass系统是一种3D剂量验证工具,能够提供计划系统计算结果与验证结果的剂量偏差以及感兴趣结构的体积γ通过率,在近几年放疗计划的质量控制中得到了广泛的应用[10]。
本研究中,治疗计划计算结果以及三维剂量验证结果均显示,通过整体的射野参数优化,HSH_IMRT能够在保持原有H_IMRT计划的剂量学特征优势前提下,降低大部分心脏亚结构的最大剂量和平均剂量,并显著减少全心脏所受照射的体积剂量和平均剂量。此外,本研究发现,将与心脏重叠的MLC往射野内移动距离过大时,虽然能更多地减少心脏的受量,但处方剂量的调强部分很难弥补因对靶区过度遮挡产生的剂量亏损,从而造成靶区剂量覆盖率的降低或者均匀度的下降,失去在混合调强计划中引入MLC遮挡技术所带来的优势,因此在临床计划设计中应根据患者靶区的形状、大小及其与心脏相对位置的个体差异对MLC叶片移动的距离进行适当调整。
心脏放射性损伤与心脏照射的剂量和体积相关,但究竟是与高剂量的小体积照射还是与受照的平均剂量关系更为密切,以及是否存在发生放射性心脏损伤的剂量阈值目前尚不明确[11]。从当前的研究结果看,心脏的Dmean越低越好。由于目前在左侧乳腺癌保乳术后的临床放疗过程中心脏还不能完全避免受到照射,因此仍需要加强放射性心脏损伤机制及防护措施的研究,减少心脏损伤的发生,从而改善乳腺癌患者的预后与生存质量。
利益冲突 无作者贡献声明 赵培峰负责实验设计、实施和论文撰写;周钢负责研究方案指导及结果统计分析;孙彦泽负责放疗计划设计;邹莉负责患者靶区及危及器官的勾画;田野在实验设计和论文撰写过程中给予了指导
| [1] |
Chen J, Mehta JL. Angiotensin Ⅱ-mediated oxidative stress and procollagen-1 expression in cardiac fibroblasts:blockade by pravastatin and pioglitazone[J]. Am J Physiol Heart Circ Physiol, 2006, 291(4): H1738-1745. DOI:10.1152/ajpheart.00341.2006 |
| [2] |
Bartlett FR, Yarnold JR, Donovan EM, et al. Multileaf collimation cardiac shielding in breast radiotherapy:Cardiac doses are reduced, but at what cost?[J]. Clin Oncol (R Coll Radiol), 2013, 25(12): 690-696. DOI:10.1016/j.clon.2013.09.002 |
| [3] |
殷蔚伯, 李晔雄, 王绿化, 等. 肿瘤放射治疗手册[M]. 北京: 中国协和医科大学出版社, 2010: 252-267. Yin WB, Li YX, Wang LH, et al. Cancer radiation therapy handbook[M]. Beijing: Peking Union Medical College Press, 2010: 252-267. |
| [4] |
Duane F, Aznar MC, Bartlett F, et al. A cardiac contouring atlas for radiotherapy[J]. Radiother Oncol, 2017, 122(3): 416-422. DOI:10.1016/j.radonc.2017.01.008 |
| [5] |
Darby SC, Ewertz M, McGale P, et al. Risk of ischemic heart disease in women after radiotherapy for breast cancer[J]. N Engl J Med, 2013, 368(11): 987-998. DOI:10.1056/NEJMoa1209825 |
| [6] |
Jagsi R, Griffith KA, Koelling T, et al. Rates of myocardial infarction and coronary artery disease and risk factors in patients treated with radiation therapy for early-stage breast cancer[J]. Cancer, 2007, 109(4): 650-657. DOI:10.1002/cncr.22452 |
| [7] |
周钢, 田野, 陆雪官, 等. 乳腺癌保乳术后适形及调强的三种放疗计划比较[J]. 中华放射医学与防护杂志, 2009, 29(4): 412-413. Zhou G, Tian Y, Lu XG, et al. Comparison of three radiotherapy plans for conformal and intensity modulation after breast conserving surgery[J]. Chin J Radiol Med Protect, 2009, 29(4): 412-413. DOI:10.3760/cma.j.issn.0254-5098.2009.04.018 |
| [8] |
Mayo CS, Urie MM, Fitzgerald TJ, et al. Hybrid IMRT for treatment of cancers of the lung and esophagus[J]. Int J Radiat Oncol Biol Phys, 2008, 71(5): 1408-1418. DOI:10.1016/j.ijrobp.2007.12.008 |
| [9] |
黄鹏, 田源, 胡志辉, 等. 利用聚类分析方法辅助核对患者放疗计划[J]. 中华放射肿瘤学杂志, 2016, 25(11): 1218-1222. Huang P, Tian Y, Hu ZH, et al. Clustering analysis:assistance to verification of radiotherapy treatment plans[J]. Chin J Radiat Oncol, 2016, 25(11): 1218-1222. DOI:10.3760/cma.j.issn.1004-4221.2016.11.016 |
| [10] |
Boggula R, Jahnke L, Wertz H, et al. Patient-specific 3D pretreatment and potential 3D online dose verification of Monte Carlo-calculated IMRT prostate treatment plans[J]. Int J Radiat Oncol Biol Phys, 2011, 81(4): 1168-1175. DOI:10.1016/j.ijrobp.2010.09.010 |
| [11] |
Stewart FA, Hoving S, Russell NS. Vascular damage as an underlying mechanism of cardiac and cerebral toxicity in irradiated cancer patients[J]. Radiat Res, 2010, 174(6): 865-869. DOI:10.1667/RR1862.1 |
 2019, Vol. 39
2019, Vol. 39


