随着放射治疗技术的快速发展,胸部肿瘤放射治疗的方式越来越多样化,这些与靶区高度适形的放疗技术能在临床中得以广泛应用的基础是患者的精确定位与精确摆位,因此应用可靠的图像引导技术来监测患者的治疗精度是必需的[1]。现在常用的图像引导技术有二维X射线平片和三维锥形束CT(CBCT), 它们可以提供有用的内部解剖结构信息(例如骨与软组织),并且CBCT是判断摆位误差和内部器官运动的金标准,但在长疗程中患者不可忽略的辐射剂量与日常工作中工作人员的工作负荷,这些技术较难在临床得到高频率使用[2]。近年来,三维光学表面影像用来帮助摆位和评估运动逐渐成熟并已应用于临床[3-7],它的主要优势是快速并且无电离辐射。2016年10月,本中心新引进的美国瓦里安公司EDGE直线加速器配备了光学表面监测系统(optical surface monitoring system,OSMS)。为了更好地使用该系统,本中心开展了OSMS在胸部肿瘤调强放疗的应用研究,探讨该系统的精度与准确性、与日常体表标记引导摆位相比有无优势、评价摆位误差与CBCT是否一致,现作一报道。
资料与方法1.患者资料:选取2017年10至2018年4月华中科技大学同济医学院附属同济医院肿瘤科收治的胸部肿瘤患者28例,其中男性18例,女性10例;年龄33~76岁,中位年龄60岁;肺癌15例,食管癌9例,前纵隔肿瘤4例。所有患者均经病理证实,放疗前均签署放射治疗知情同意书。
2.主要设备:美国瓦里安公司EDGE直线加速器配备OSMS系统、Eclipse治疗计划系统;瑞典医科达公司的MOSAIQ系统;荷兰飞利浦公司的Brilliance CT Big Bore模拟定位机,德国LAP公司的三维可移动激光灯系统。
3.体位固定与定位图像采集:患者采用真空袋进行固定,应用飞利浦Brilliance BigBore CT进行图像采集然后传至Eclipse治疗计划系统进行靶区勾画与计划设计,计划设计完成后把计划与结构传至EDGE直线加速器与OSMS系统。
4. OSMS系统:OSMS是以摄像头为基础的3D表面影像系统,用于治疗前和治疗中的观察和重建患者的3D表面结构。它由3个安装在天花板上的摄像头组成,2个安装在治疗床两侧,另一个在治疗床尾正上面;摄像头由中间的投影仪与两侧的感受器组成,投影仪投影红外线斑点至患者体表,然后感受器获取斑点与患者的位置信息。OSMS系统的稳定性与准确性应用ad-hoc平板来校准(包括日检与月检),根据本中心的QA测试系统精度 < 1 mm/0.5°。
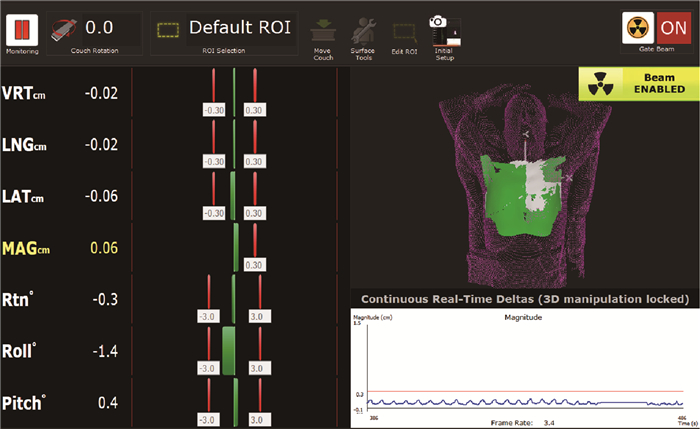
|
注:屏幕左侧表示实时表面影像与参考影像的配准误差;中间绿色条栏表示预设的容差(例如0.3 cm/3°);右侧栏参考影像以紫色网格表示,感兴趣区以白色表示,实时表面影像以绿色覆盖在参考影像与感兴趣上 图 1 OSMS监测时屏幕截图 Figure 1 Screen capture of OSMS monitoring |
5. CBCT图像采集与配准:首先根据患者体表“+”标记和激光灯进行摆位,然后行CBCT扫描,CBCT图像与定位CT图像进行配准,配准框包括肿瘤靶区及其附近骨结构;配准方式为骨配准,可获得x、y与z轴的平移误差与旋转误差。如果平移误差≤3 mm,自动移动加速器床校正误差;如果同轴平移误差>3 mm而旋转误差 < 3°,自动移动加速器床校正误差;如果同轴平移误差>3 mm且旋转误差>3°,重新摆位重新获取CBCT图像配准并记录数据。前3次CBCT验证结束后,分析前3次的误差结果,根据误差的均值进行校正,并修改中心标记,以后每周进行1次CBCT扫描。
6.统计学处理:计量资料符合正态分布,以x±s表示。采用SPSS 19.0软件对数据进行分析。对于个体患者,系统误差为其摆位误差的均值,随机误差为其摆位误差的标准差;对于患者群体,Σ为所有个体系统误差的标准差;σ为所有个体随机误差的均方根;计数资料之间的比较采用χ2检验,采用双变量相关分析两组摆位误差关系,应用GraphPad Prism统计软件的Bland-Altman法评估两种系统的一致性,并计算一致性界限(LOA, 95%的可信区间)。P < 0.05为差异有统计学意义。
结果1.系统误差与随机误差:28例患者分别采集了286次CBCT摆位误差数据与286次OSMS误差数据,两种影像系统在x、y与z轴的平移与旋转方向的系统误差与随机误差见表 1,2。
|
|
表 1 CBCT与计划CT配准在x、y与z轴的系统误差与随机误差 Table 1 Systematic errors and random errors in the direction of translation and rotation of x, y and z axis from CT-cone beam computed tomography (CBCT) registration |
|
|
表 2 表面影像与参考影像配准在x、y与z轴的系统误差与随机误差 Table 2 Systematic errors and random errors in the direction of translation and rotation of x, y and z axis from surface imaging-reference imaging registration |
2.两种影像系统摆位误差之间的Pearson相关分析:两种系统在平移方向表现为中度相关关系(r=0.79、0.62、0.53, P < 0.05),而在旋转方向表现为弱相关(r=0.40、0.28、0.36, P < 0.05),详见表 3。
|
|
表 3 x、y与z轴上CBCT误差与OSMS误差的相关分析 Table 3 Correlation analysis of setup errors in x, y and z axis of two image systems |
3.两种影像系统摆位误差累积频率分布比较:以3 mm为阈值,在y轴OSMS平移误差≤3 mm的为93%,而CBCT为86.7%,两者比较,差异有统计学意义(χ2=6.217, P=0.018);以5 mm为阈值,OSMS平移误差≤5 mm的为100%,而CBCT为97.6%,两者比较,差异有统计学意义(χ2=7.086, P=0.007);以CBCT为金标准,OSMS系统可能低估了部分y轴的摆位误差;而x与z轴无统计学意义(P>0.05)。在旋转误差方面,以2°为阈值,两种影像系统显示的旋转无区别,以1°为阈值,在x与y轴两者差异有统计学意义(χ2=19.638、19.855,P<0.01),OSMS系统高估了x轴与y轴的旋转误差,见表 4。
|
|
表 4 两种影像系统摆位误差的平移与旋转误差累积频率分布比较 Table 4 Comparison of the cumulative frequency distributions of setup errors between translation and rotation errors in two image systems |
4.两种影像系统摆位误差的一致性检验:两种影像系统摆位误差差异的均值< 0.5 mm,LOA在x、y与z轴的平移与旋转方向分别为(-2.0~2.3)、(-3.4~3.6)、(-3.3~2.4)mm与(-2.0~1.6)°、(-2.0~1.4)°、(-1.6~1.6)°;临床应用中可以接受该差异,见表 5。
讨论准确且可重复的治疗摆位是实现精确放疗的基础,应用IGRT来校正日常的摆位误差与监测分次内的器官运动,不仅可以减少PTV的外扩边界,还可以减少正常组织的放射损伤[2]。图像引导放射治疗(IGRT)采用的方式可分为两类:电离辐射,如电子射野影像系统(EPID)与CBCT;非电离辐射,如超声[8]、电磁扫描[9]与光学表面影像。根据可合理达到的尽可能低的剂量原则(ALARA),应尽量减少电离辐射的使用,因此,近年来非电离辐射的IGRT方式在临床应用中逐步成熟,应用光学表面影像来验证患者的位置和监测患者的运动已有初步的临床报道[10-13]。Pallotta等[3]报道光学表面影像监测胸部肿瘤患者的摆位误差,x、y与z轴的平移与旋转误差分别为(-0.3±2.7)、(0.0±3.8)、(-1.3±2.7)mm与(0.1±1.2)°、(-0.3±1.2)°、(0.3±1.2)°,与体表标记相比,光学表面影像可以提高50%的分次治疗精度。Wiant等[14]采用光学表面影像实时监测乳腺癌患者分次内运动,如果分次治疗时间为10 min,x、y与z轴的平移与旋转误差分别为(0.11±1.96)、(-0.44±1.98)、(0.36±2.15)mm与(-0.06±0.56)°、(0.08±0.73)°、(0.03±0.75)°,认为光学表面影像可准确监测分次内运动,误差大小与治疗时间正相关,治疗时间越长,相应计划靶体积(PTV)外扩边界越大,因此建议治疗时间尽量不超过15 min。Betgen等[5]报道采用光学表面影像监测保乳术后患者的放疗,分次间的Σ/σ在x、y与z轴分别为2.2 mm/2.0 mm、5.0 mm/3.5 mm、3.3 mm/2.7 mm,认为分次间的误差变化较大,需要实时的图像引导在线纠正摆位误差。Krengli等[2]报道前列腺癌患者应用光学表面影像监测摆位误差,Σ/σ分别为(1.2~2.0)mm/(0.3~0.7)mm,认为该系统可以准确地监测分次间的误差,指导摆位并且摆位误差大小临床可接受。Alderliesten等[6]报道应用光学表面影像指导肺癌的无框架立体定向体部放疗(SBRT),对于女性患者来说,该系统监测肿瘤运动是一个很准确的工具,Σ/σ分别为1.3 mm/1.7 mm,LOA为(-3.3~4.3)mm;而男性的Σ/σ分别为3.1 mm/3.3 mm,LOA为(-5.9~9.5)mm,与CBCT相关性较弱。可能因男性胸廓较厚,表面影像离靶区距离较远,表面影像较难真实反映靶区情况,认为应用表面影像指导男性患者治疗还需进一步大样本研究。上述研究主要与乳腺癌、肺癌与盆腔肿瘤相关,光学表面影像对于患者的位置验证是一种可靠的方法,并可能提高摆位精度,与现在常用的IGRT相比,它的优势是快速、无创、无电离辐射,并且不受监测频率与时间的限制,临床治疗中可以大量使用。
|
|
表 5 两种影像系统摆位误差的一致性检验 Table 5 Consistency test of setup errors of two image systems |
Alderliesten等[15]报道左侧保乳术后患者放疗采用深吸气屏气技术(DIBH)技术,应用OSMS与CBCT验证摆位误差,发现两组摆位误差在x、y与z轴的平移方向具有很好的相关性(r=0.70、0.90、0.82),而在旋转方向相关性较弱(r=0.37、0.19、0.22),各方向的Σ≤1.7 mm、σ≤1.5 mm,LOA在x、y与z轴的平移方向为(-3.4~4.8)、(-4.2~3.9)与(-5.2~2.3)mm。本研究的结果与之类似,两组摆位误差在平移方向有较强的相关性(r=0.79、0.62、0.53),而旋转方向相关性较弱(r=0.30、0.28、0.36);平移方向的Σ≤1.3 mm,σ≤1.9 mm;旋转方向的Σ≤0.7°,σ≤0.7°;LOA在x、y与z轴的平移与旋转方向分别为(-2.0~2.3)、(-3.4~3.6)、(-3.3~2.4)mm与(-2.0~1.6)°、(-2.0~1.4)°、(-1.6~1.6)°;Bartoncini等[4]报道应用表面影像系统与EPID研究前列腺癌的摆位误差,并对两组摆位误差累积频率进行比较:以3 mm为阈值,两组累积频率在x、y与z轴分别为90% vs. 55%、32% vs. 29%与32% vs. 38%;以5 mm为阈值,分别为95% vs.78%、58% vs.53%与53% vs.59%,认为表面影像系统可准确指导摆位,尤其是在x轴方向,但摆位误差的阈值至少为5 mm。而本研究的结果以3 mm为阈值,CBCT与OSMS的摆位误差累积频率在x、y与z轴分别为91.6% vs.95.8%、86.7% vs.93%与97.2% vs.96.2%,整体的摆位误差结果优于Bartoncini等[4]研究。分析原因有:①部位不同:本研究为胸部,而Bartoncini等[4]研究为盆腔。胸部轮廓的变化主要受呼吸运动的影响,有研究用4DCT评价胸廓的运动幅度大约为1 mm[16];而腹盆腔轮廓的变化与胃肠道的状态和膀胱充盈的程度有关,分次间的变化不稳定,导致摄像头获取体表轮廓变化大这样显示的摆位误差也大。②长疗程中分次间体重的变化对盆腔轮廓影响更大。本研究中有部分分次OSMS低估了实际的摆位误差,但一致性检验发现两种影像系统摆位误差最大差值≤4 mm、旋转误差≤2°,在实际临床应用中是可接受的误差范围。
本研究的结果优于较多研究报道,分析主要原因有:①本研究采用由3个摄像单元组成的监测系统可以更大范围的获取体表轮廓,准确地显示摆位误差,克服了单摄像头不能获取患者左右两侧体表轮廓的缺点,而上述研究大部分采用单摄像头。Gopan和Wu[17]的研究也得出相似的结论。②参考影像的选择,本研究首次治疗采用Dicom参考影像,后续治疗采用校正误差后的Vrt参考影像:由于CT定位与治疗有一定的时间间隔,患者在整个长疗程中体表轮廓可能会发生变化,故分次间的光学表面监测不宜采用同一参考影像,建议每周CBCT校正误差后获取本周的参考影像指导本周的摆位与治疗。Wikström等[18]认为CBCT校正误差后获取的参考影像配准精度高。本研究因模拟定位室未安装OSMS系统,因而不能在模拟定位时建立光学表面参考影像,如果定位能获取光学表面参考影像并结合定位CT的参考影像来指导患者摆位可能更有优势。关于参考影像的选择不同的研究有不同的选择,这样导致误差的结果也不一样,还需要进一步的研究。③感兴趣区的选择,本研究感兴趣区的选择:男性患者选择包括正前胸与左右双侧面的部分胸壁,注意不能包括活动度较大的腋窝与固定真空袋的边缘,女性患者选择包括正前胸的乳房基部与乳房皱褶下胸壁,不能包括下垂和不稳定的乳腺组织。Alderliesten等[6, 15]研究发现感兴趣区的选择不同导致摆位误差的结果也不一样,感兴趣区包双侧胸廓或仅包患侧胸廓误差结果不一样,女性因体表特殊结构做为感兴趣区更易配准,而男性平坦的胸廓较难配准。Wiersma等[19]认为感兴趣区的选择需谨慎,感兴趣区的表面特征比感兴趣区的大小更重要。
本研究患者治疗前摆位参考体表标记,没有直接应用OSMS来指导摆位,考虑患者胸廓是动态的,实际应用中也较难设置OSMS的所有误差值归零,所以只能推算理论上OSMS指导下的摆位误差,OSMS摆位误差减去CBCT摆位误差就是单独应用OSMS指导下摆位的理论误差值。Pallotta等[3]评价OSMS优越性的方法为CBCT误差绝对值减去OSMS理论误差绝对值,如果为正值说明该系统优于体表标记法,如果为负值则反之;同样也可以直接分析哪些患者与哪些分次获益。后续将进一步研究相关问题和直接应用OSMS来指导摆位观察其效果。
综上所述,OSMS与CBCT验证摆位误差的一致性结果较好,差值范围临床可接受。OSMS是一种有效的低成本IGRT工具,不仅可以减少患者放疗过程中的辐射剂量,不额外增加治疗时间,而且可快速准确验证患者位置,提高摆位精度,可用于胸部肿瘤调强放疗的治疗摆位。
利益冲突 无作者贡献声明 付秀根与钟伟伟负责实验的具体实施及论文书写;袁响林、郑祖安与晁腾飞提出研究思路进行实验设计;卢晓光、高文颂与尹龙斌参与数据采集和分析
| [1] |
Balter JM, Kessler ML. Imaging and alignment for image-guided radiation therapy[J]. J Clin Oncol, 2007, 25(8): 931-937. DOI:10.1200/JCO.2006.09.7998 |
| [2] |
Krengli M, Loi G, Pisani C, et al. Three-dimensional surface and ultrasound imaging for daily IGRT of prostate cancer[J]. Radiat Oncol, 2016, 11(1): 159. DOI:10.1186/s13014-016-0734-3 |
| [3] |
Pallotta S, Vanzi E, Simontacchi G, et al. Surface imaging, portal imaging, and skin marker set-up vs. CBCT for radiotherapy of the thorax and pelvis[J]. Strahlenther Onkol, 2015, 191(9): 726-733. DOI:10.1007/s00066-015-0861-z |
| [4] |
Bartoncini S, Fiandra C, Ruo RMG, et al. Target registration errors with surface imaging system in conformal radiotherapy for prostate cancer:study on 19 patients[J]. Radiol Med, 2012, 117(8): 1419-1428. DOI:10.1007/s11547-012-0823-9 |
| [5] |
Betgen A, Alderliesten T, Sonke JJ, et al. Assessment of set-up variability during deep inspiration breath hold radiotherapy for breast cancer patients by 3D-surface imaging[J]. Radiother Oncol, 2013, 106(2): 225-230. DOI:10.1016/j.radonc.2012.12.016 |
| [6] |
Alderliesten T, Sonke JJ, Betgen A, et al. 3D surface imaging for monitoring intrafraction motion in frameless stereotactic body radiotherapy of lung cancer[J]. Radiother Oncol, 2012, 105(2): 155-160. DOI:10.1016/j.radonc.2012.08.016 |
| [7] |
Li G, Ballangrud A, Chan M, et al. Clinical experience with two frameless stereotactic radiosurgery (fSRS) systems using optical surface imaging for motion monitoring[J]. J Appl Clin Med Phys, 2015, 16(4): 149-162. DOI:10.1120/jacmp.v16i4.5416 |
| [8] |
Robinson D, Liu D, Steciw S, et al. An evaluation of the Clarity 3D ultrasound system for prostate localization[J]. J Appl Clin Med Phys, 2012, 13(4): 3753. DOI:10.1120/jacmp.v13i4.3753 |
| [9] |
Kupelian P, Willoughby T, Mahadevan A, et al. Multi-institutional clinical experience with the Calypso System in localization and continuous, real-time monitoring of the prostate gland during external radiotherapy[J]. Int J Radiat Oncol Biol Phys, 2007, 67(4): 1088-1098. DOI:10.1016/j.ijrobp.2006.10.026 |
| [10] |
Mancosu P, Fogliata A, Stravato A, et al. Accuracy evaluation of the optical surface monitoring system on EDGE linear accelerator in a phantom study[J]. Med Dosim, 2016, 41(2): 173-179. DOI:10.1016/j.meddos.2015.12.003 |
| [11] |
Stanley DN, McConnell KA, Kirby N, et al. Comparison of initial patient setup accuracy between surface imaging and three point localization:A retrospective analysis[J]. J Appl Clin Med Phys, 2017, 18(6): 58-61. DOI:10.1002/acm2.12183 |
| [12] |
Ma Z, Zhang W, Su Y, et al. Optical surface management system for patient positioning in interfractional breast cancer radiotherapy[J]. Biomed Res Int, 2018, 2018: 6415497. DOI:10.1155/2018/6415497 |
| [13] |
Zhao B, Maquilan G, Jiang S, et al. Minimal mask immobilization with optical surface guidance for head and neck radiotherapy[J]. J Appl Clin Med Phys, 2018, 19(1): 17-24. DOI:10.1002/acm2.12211 |
| [14] |
Wiant DB, Wentworth S, Maurer JM, et al. Surface imaging-based analysis of intrafraction motion for breast radiotherapy patients[J]. J Appl Clin Med Phys, 2014, 15(6): 4957. DOI:10.1120/jacmp.v15i6.4957 |
| [15] |
Alderliesten T, Betgen A, Elkhuizen PH, et al. Estimation of heart-position variability in 3D-surface-image-guided deep-inspiration breath-hold radiation therapy for left-sided breast cancer[J]. Radiother Oncol, 2013, 109(3): 442-447. DOI:10.1016/j.radonc.2013.09.017 |
| [16] |
Kinoshita R, Shimizu S, Taguchi H, et al. Three-dimensional intrafractional motion of breast during tangential breast irradiation monitored with high-sampling frequency using a real-time tumor-tracking radiotherapy system[J]. Int J Radiat Oncol Biol Phys, 2008, 70(3): 931-934. DOI:10.1016/j.ijrobp.2007.10.003 |
| [17] |
Gopan O, Wu Q. Evaluation of the accuracy of a 3D surface imaging system for patient setup in head and neck cancer radiotherapy[J]. Int J Radiat Oncol Biol Phys, 2012, 84(2): 547-552. DOI:10.1016/j.ijrobp.2011.12.004 |
| [18] |
Wikström K, Nilsson K, Isacsson U, et al. A comparison of patient position displacements from body surface laser scanning and cone beam CT bone registrations for radiotherapy of pelvic targets[J]. Acta Oncol, 2014, 53(2): 268-277. DOI:10.3109/0284186X.2013.802836 |
| [19] |
Wiersma RD, Tomarken SL, Grelewicz Z, et al. Spatial and temporal performance of 3D optical surface imaging for real-time head position tracking[J]. Med Phys, 2013, 40(11): 111712. DOI:10.1118/1.4823757 |
 2019, Vol. 39
2019, Vol. 39


