图像引导放疗(image-guided radiotherapy, IGRT)是继三维适形放疗(3D-CRT)和调强放疗(IMRT)之后的又一新技术[1]。ExacTrac X射线(ETX)图像引导系统采用正交的kV级X射线验证系统,不仅在头部立体定向放疗中有较大的技术优势,而且还可以应用于体部肿瘤放疗的图像引导,特别是与骨性结构关系密切的体部大分割放疗。本研究对37例体部肿瘤放射治疗的271次ETX图像摆位误差以及残余误差的进行了回顾性分析,通过分析平移和旋转误差分布情况,论证体部肿瘤放疗使用6D放射治疗床校准摆位误差的必要性;通过分析摆位误差纠正后的残余误差分布情况,评估体部肿瘤放疗使用6D放射治疗床校准摆位误差的有效性。
资料与方法1.一般临床资料:统计2016年1月至2018年6月间在中国医学科学院肿瘤医院放疗科应用ETX图像引导放疗的体部肿瘤患者。全部37例入组病例中,胸腰椎骨转移10例,肺癌或者肺转移8例,骨盆骨转移6例,直肠癌5例,肝癌或者肝转移4例,胰腺癌2例,前列腺癌1例,宫颈癌局部复发1例。全部37例病例中,男性和女性分别为28例和9例,年龄15~81岁(中位数59岁), 身体质量指数(BMI)16.8~38.1(中位数24.7), 卡氏评分70~90。
2.患者体位固定及CT模拟定位:所有患者均采用仰卧位,双手抱肘置于额上,左手在下右手在上,Civco胸腹部固定架,科莱瑞迪热塑体膜固定,头部垫B型头枕。所有患者均在自主呼吸的状态下接受CT模拟定位机(Philips Brilliance Big Bore或者Siemens SOMATOM Definition AS 40)定位扫描,层厚和层距3~5 mm。
3.放射治疗计划设计:CT模拟定位图像通过网络系统传输至Pinnacle(Version 9.10)计划系统(荷兰飞利浦公司),然后进行靶区勾画及放疗计划设计。放疗计划设计采用静态多叶准直器调强放疗(IMRT)或者旋转调强放疗(VMAT)技术,分次剂量2~15 Gy。放疗计划获得放疗物理师和临床医师通过后,再通过MOSAIQ网络系统将放疗计划传输加速器,并将双斜位DRR图像传输至ETX图像引导系统。
4.加速器及图像引导系统:放射治疗设备为美国瓦里安公司的Trilogy医用电子直线加速器,所有病例的射线能量均选择6 MV X射线。图像引导系统为德国博医来公司的ExacTrac系统,软件版本ExacTrac 6.0.6;硬件上设计了红外线定位摆位系统和可以进行数字减影的视频监测系统,设计了一对埋入地面以下的kV级X射线管和与之对应的两个非晶硅平板探测器,设计了可以进行旋转和平移误差校正的6D治疗床。该型号加速器与图像引导系统合称为NOVALIS加速器。
5.图像配准方式及参数设置:图像配准为参考CT图像重建的双斜位DRR图像(图 1)与ETX系统采集的kV级正交图像(图 2)进行配准融合,配准融合方式为骨性融合。以椎体为配准标志的VOI包含等中心附近至少3个椎体,以盆腔为配准标志的VOI包含整个骨盆,配准标志不能包含可以移动的骨性结构,比如股骨和上肢骨。椎体转移肿瘤的修正阈值设置为1 mm/1°[2-3],其他体部肿瘤的修正阈值设置为1.5 mm/1°。通过6D治疗床校正摆位误差后,需要再次进行验证确认校正到位,即确认加速器治疗床的机械精度能够达到误差校正的要求。对于受呼吸运动影响较大的肺癌或肺转移和肝癌或肝转移病例,和受胃肠膀胱充盈程度影响较大的胰腺癌及前列腺癌病例,均进行双重图像引导验证,即在进行ETX图像引导并进行6D治疗床校正位置平移和旋转误差后,需要再次进行锥形束CT(CBCT)图像引导,采用灰度配准的方式配准,保证靶区位置的准确。
|
图 1 DRR图像 Figure 1 DRR image |
|
图 2 双斜位ETX验证像 Figure 2 Double oblique ETX image |
6.统计学处理:应用微软Excel软件分析全部病例所有图像引导的配准融合摆位误差数据,以及摆位误差纠正后的残余误差数据。数据经正态性检验符合正态分布,采用x±s表示,应用SPSS 18.0软件进行独立样本t检验。P < 0.05为差异有统计学意义。
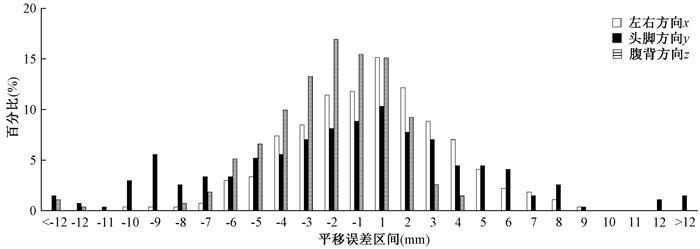
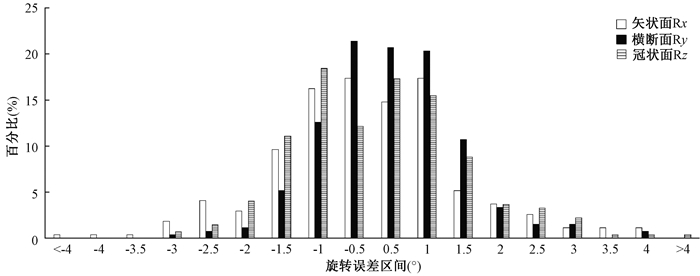
结果1.平移误差和旋转误差分布:全部37例病例,共进行271次ETX图像引导放疗,每次ETX图像引导放疗均进行了x(左右方向)、y(头脚方向)和z(腹背方向)3个方向的平移误差校正,和Rx(矢状面),Ry(横断面),Rz(冠状面)3个平面的旋转误差校正。患者摆位误差的区间分布情况见图 3和图 4。
|
注:横坐标-2表示误差在(-2, -1]区间, -1表示误差在(-1, 0)区间, 1表示误差在[0, 1)区间, 2表示误差在[1, 2)区间, 依此类推 图 3 平移误差分布图 Figure 3 Distribution of transition errors |
|
注:横坐标-1表示误差在(-1,-0.5]区间,-0.5表示误差在(-0.5,0)区间,0.5表示误差在[0,0.5)区间,1表示误差在[0.5,1)区间,依此类推 图 4 旋转误差分布图 Figure 4 Distribution of rotation errors |
2.残余误差分布:验证并校正摆位误差后,需再次验证残余误差是否在误差允许的阈值,若超过阈值范围须重新校正误差并重新验证残余误差,直至残余误差在允许的范围。分析平移误差残余量和旋转误差残余量,患者摆位误差个体平均值的区间分布情况见图 5和图 6。
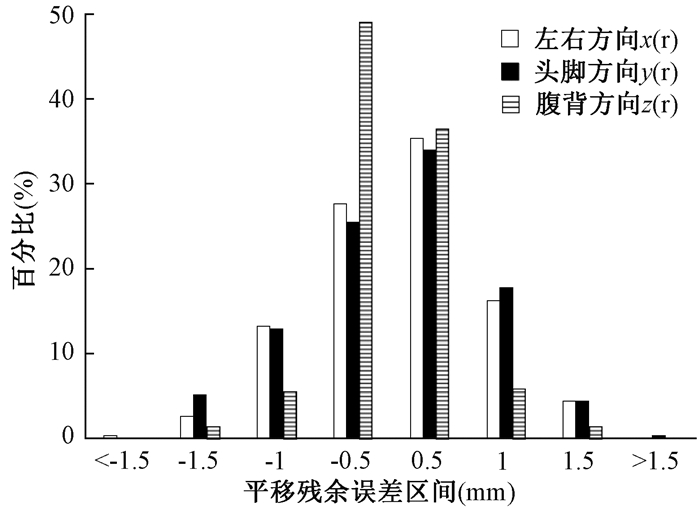
|
图 5 平移残余误差分布图 Figure 5 Distribution of translation residual error |
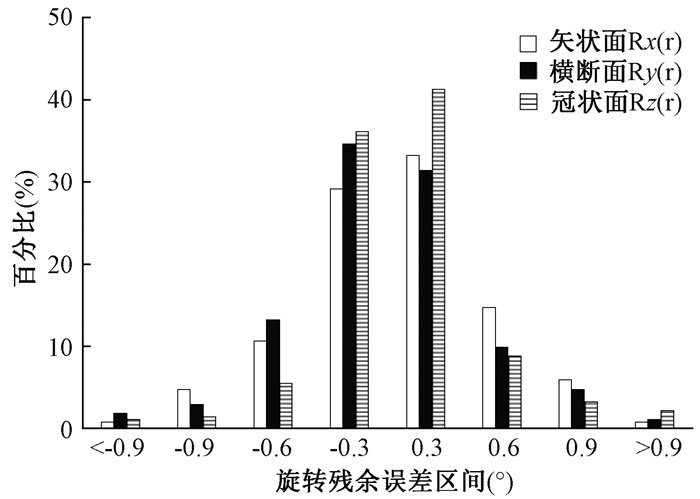
|
图 6 旋转残余误差分布图 Figure 6 Distribution of rotation residual error |
3. ETX图像引导六自由度摆位误差:根据“四参数模型”[4]计算摆位误差和残余误差值,个体病例误差平均值的标准差,代表该组病例摆位误差的系统误差∑大小。个体病例误差标准差的均方根,代表该组病例摆位随机误差σ的大小。对所有37例病例的摆位误差和残余误差结果进行独立样本t检验,二者比较,差异有统计学意义(t=4.488~7.216,P<0.05,表 1)。
|
|
表 1 ETX图像引导的六自由度摆位误差(x±s) Table 1 Six degree-of-freedom setup errors for ETX image(x±s) |
4.与骨性结构关系密切病例的CBCT双重验证误差结果:有6例靶区位置与骨性结构关系密切的病例也进行了CBCT双重验证,该组病例采用了骨性配准的方式进行靶区配准。x(左右方向)、y(头脚方向)和z(腹背方向)3个方向的平移误差分别为(0.6±0.7)、(0.6±0.8)和(0.5±0.8)mm。
5.受呼吸运动和胃肠膀胱充盈程度影响较大病例的CBCT双重验证误差结果:入组的37例病例中,含肺癌或肺转移8例,肝癌或者肝转移4例,胰腺癌2例,前列腺癌1例。该组15例病例受呼吸运动和胃肠膀胱等内脏充盈程度的影响较大,在应用ETX图像引导并进行6D治疗床校正位置平移和旋转误差后,均再次进行CBCT图像引导验证,采用灰度配准的方式进行靶区配准。x(左右方向)、y(头脚方向)和z(腹背方向)3个方向的平移误差分别为(1.4±1.4)、(2.5±2.6)和(1.4±1.5)mm。
6.临床靶区(CTV)至计划靶区(PTV)的外放间隙:根据Stroom等[5]的方法,CTV到PTV间隙平均应为MPTV=2∑+0.7σ,其中∑为系统误差(个体误差平均值的标准差),σ为随机误差(个体误差标准差的均方根)。用表 1数据得到x(左右方向)、y(头脚方向)和z(腹背方向)的PTV外放边界分别为5.96、10.74和5.50 mm。
讨论多叶准直器静态调强和旋转调强等新的放射治疗技术具有剂量梯度大、剂量分布易受摆位误差影响的特点[6],要求日常的放射治疗必须有很高的靶区精度和摆位精度。文献报道体部肿瘤的平移摆位误差可达5~40 mm[7-10]。本研究在x(左右方向)、y(头脚方向)和z(腹背方向)3个方向的摆位误差分别可达(2.27±2.02)、(4.49±2.52)和(2.27±1.37)mm,因而体部肿瘤放疗的平移摆位误差校正是非常有必要的。有文献报道旋转误差导致的剂量误差很小,可以忽略[11-12]。Astreinidou等[13]认为平均为1°的旋转误差不会影响95%的CTV接受的处方剂量;Gutfeld等[14]认为>2°的旋转误差会使靶区剂量发生3%~5%的变化,需要对其进行校正。本研究中旋转误差Rx(矢状面)、Ry(横断面)、Rz(冠状面)>2°的百分比分别为12.9%、4.8%、8.9%,体部肿瘤的放射治疗不仅需要校正平移误差,还需要校正旋转误差,特别是采用大分割模式的体部肿瘤放疗。
入组病例中有6例靶区位置与骨性结构关系密切的病例,先采用ETX验证校正摆位误差,然后再使用CBCT进行二次验证,两种验证方式均采用骨性结构配准,二者在x(左右方向)、y(头脚方向)和z(腹背方向)3个方向的平移误差差别仅为(0.6±0.7)、(0.6±0.8)和(0.5±0.8)mm,差别为亚毫米级别。入组病例中有15例靶区位置受体内器官运动或充盈程度影响较大的肺、肝、胰腺或者前列腺病例,CBCT验证采用灰度配准方式,两种验证模式在x(左右方向)、y(头脚方向)和z(腹背方向)3个方向的摆位误差的差别分别为(1.4±1.4)、(2.5±2.6)、(1.4±1.5)mm,差别产生的原因是ETX的配准标志为骨性结构,而CBCT的配准标志为肿瘤。该组病例采用双重验证的好处是既利用了ETX系统的6D床对基于脊柱的人体进行了六维校正,又发挥了CBCT的高密度分辨力的优势,保证了靶区位置的准确性。而且,脊柱作为支撑人体的主要结构,受呼吸运动和心脏跳动位移形变的影响很小,且基于骨结构(椎体)的摆位可减少放疗期间的系统误差[15-16]。
据王艳阳等[17]报道,kV-CBCT的x(左右方向)、y(头脚方向)和z(腹背方向)3个方向上图像引导后残余误差矢量值分别为(0.2±0.4)、(0.1±0.4)和(-0.4±0.3)mm。而Létourneau等[18]基于体模研究的结果显示3个方向上的残余误差矢量为(-0.4±0.6)、(0.0±0.6)和(-0.6±0.5)mm。本研究应用ETX图像引导系统在3个方向上的残余误差矢量值为(0.05±0.56)、(0.04±0.58)和(-0.02±0.37)mm。ETX图像引导的残余误差比CBCT引导的残余误差值的大小有明显的优势,ETX图像引导系统的摆位误差校正更加有效,患者校正后的体位更加准确。
单次CBCT验证的剂量约为30~50 mGy,而单次ETX验证的剂量仅为0.33~0.55 mGy[19],大大减小了患者的受照剂量,对于采用常规分割的模式,又对靶区位置要求苛刻的病种如椎体转移瘤,整个疗程每天采用ETX图像引导放疗,可大幅减少患者所受的额外剂量。另外,应用ETX图像引导系统验证时间短于kV-CBCT摆位验证的时间,可以提高工作效率,减少患者治疗期间自主运动的可能性[20]。
综上所述,ETX图像引导系统能够进行六维的摆位误差校正,与CBCT相比,ETX系统校正后的残余误差更小,能更加有效地校正体部肿瘤放疗的摆位误差,保证了放射治疗的精准度。而且,ETX图像引导系统有较好的时间优势和剂量学优势。但CBCT三维容积图像验证具有高密度分辨力,在临床应用中应根据实际情况选择合适的体位验证方式。
利益冲突 所有作者未因该研究接受不正当利益,在此对研究的独立性和科学性予以保证作者贡献声明 张彦新负责论文设计与撰写;方浩、陈冰、张伟、覃仕瑞负责数据采集;王谦、陈诚、李洪菊负责数据整理;符贵山、戴建荣指导论文修改
| [1] |
戴建荣, 胡逸民. 图像引导放疗的实现方式[J]. 中华放射肿瘤学杂志, 2006, 15(2): 132-135. Dai JR, Hu YM. Realization of image-guided radiotherapy[J]. Chin J Radiat Oncol, 2006, 15(2): 132-135. DOI:10.3760/j.issn.1004-4221.2006.02.019 |
| [2] |
Anand AK, Venkadamanickam G, Punnakal AU, et al. Hypofractionated stereotactic body radiotherapy in spinal metastasis-with or without epidural extension[J]. Clin Oncol (R Coll Radiol), 2015, 27(6): 345-352. DOI:10.1016/j.clon.2015.01.035 |
| [3] |
Wang X, Zhao Z, Luo D, et al. Submillimeter alignment of more than three contiguous vertebrae in spinal SRS/SBRT with 6-degree couch[J]. J Appl Clin Med Phys, 2017, 18(5): 225-236. DOI:10.1002/acm2.12153 |
| [4] |
Hugo GD, Yan D, Liang J. Population and patient-specific target margins for 4D adaptive radiotherapy to account for intra- and inter-fraction variation in lung tumour position[J]. Phys Med Biol, 2007, 52(1): 257-274. DOI:10.1088/0031-9155/52/1/017 |
| [5] |
Stroom JC, de Boer HC, Huizenga H, et al. Inclusion of geometrical uncertainties in radiotherapy treatment planning by means of coverage probability[J]. Int J Radiat Oncol Biol Phys, 1999, 43(4): 905-919. DOI:10.1016/S0360-3016(98)00468-4 |
| [6] |
Kaiser A, Schultheiss TE, Wong JY, et al. Pitch, roll, and yaw variations in patient positioning[J]. Int J Radiat Oncol Biol Phys, 2006, 66(3): 949-955. DOI:10.1016/j.ijrobp.2006.05.055 |
| [7] |
Bel A, Keus R, Vijlbrief RE, et al. Setup deviations in wedged pair irradiation of parotid gland and tonsillar tumors, measured with an electronic portal imaging device[J]. Radiother Oncol, 1995, 37(2): 153-159. DOI:10.1016/0360-3016(89)90078-3 |
| [8] |
Ohara K, Okumura T, Akisada M, et al. Irradiation synchronized with respiration gate[J]. Int J Radiat Oncol Biol Phys, 1989, 17(4): 853-857. |
| [9] |
Shimizu S, Shirato H, Kagei K, et al. Impact of respiratory movement on the computed tomographic images of small lung tumors in three-dimensional (3D) radiotherapy[J]. Int J Radiat Oncol Biol Phys, 2000, 46(5): 1127-1133. DOI:10.1016/S0360-3016(99)00352-1 |
| [10] |
Ekberg L, Holmberg O, Wittgren L, et al. What margins should be added to the clinical target volume in radiotherapy treatment planning for lung cancer?[J]. Radiother Oncol, 1998, 48(1): 71-77. DOI:10.1016/S0167-8140(98)00046-2 |
| [11] |
Remeijer P, Geerlof E, Ploeger L, et al. 3-D portal image analysis in clinical practice:an evaluation of 2-D and 3-D analysis techniques as applied to 30 prostate cancer patients[J]. Int J Radiat Oncol Biol Phys, 2000, 46(5): 1281-1290. DOI:10.1016/S0360-3016(99)00468-X |
| [12] |
Fu W, Yang Y, Li X, et al. Dosimetric effects of patient rotational setup errors on prostate IMRT treatments[J]. Phys Med Biol, 2006, 51(20): 5321-5331. DOI:10.1088/0031-9155/51/20/016 |
| [13] |
Astreinidou E, Bel A, Raaijmakers CP, et al. Adequate margins for random setup uncertainties in head-and-neck IMRT[J]. Int J Radiat Oncol Biol Phys, 2005, 61(3): 938-944. DOI:10.1016/j.ijrobp.2004.11.016 |
| [14] |
Gutfeld O, Kretzler AE, Kashani R, et al. Influence of rotations on dose distributions in spinal stereotactic body radiotherapy (SBRT)[J]. Int J Radiat Oncol Biol Phys, 2009, 73(5): 1596-1601. DOI:10.1016/j.ijrobp.2008.12.025 |
| [15] |
Lavoie C, Higgins J, Bissonnette JP, et al. Volumetric image guidance using carina vs. spine as registration landmarks for conventionally fractionated lung radiotherapy[J]. Int J Radiat Oncol Biol Phys, 2012, 84(5): 1086-1092. DOI:10.1016/j.ijrobp.2012.02.012 |
| [16] |
Keith R.分次间和分次治疗中靶区动度对临床和物理方面的影响[A]//Cox JD, Chang JY, Komaki R.肺癌图像引导放射治疗[M].刘明, 翟福山, 主译.南京: 江苏科学技术出版社, 2009: 83-98. Keith R. Effects of target area movement on clinical and physical aspects in secondary and sub-treatment[A]//Cox JD, Chang JY, Komaki R. Image guided radiotherapy for lung cancer[M].Liu M, Zhai FS. Translation. Najing: Jiangsu Science and Technology Press, 2009: 83-98. |
| [17] |
王艳阳, 傅小龙, 徐志勇, 等. 千伏锥形束CT引导放疗系统最小误差与剩余误差分析[J]. 中华放射医学与防护杂志, 2006, 28(4): 166-169. Wang YY, Fu XL, Xu ZY, et al. Analysis of the minimal detected error and residual error for kilovoltage cone-beam CT guided radiotherapy system[J]. Chin J Radiol Med Prot, 2006, 28(4): 166-169. DOI:10.3760/cma.j.issn.0254-5098.2008.02.022 |
| [18] |
Létourneau D, Wong JW, Oldham M, et al. Cone-beam-CT guided radiation therapy:technical implementation[J]. Radiother Oncol, 2005, 75(3): 279-286. DOI:10.1016/j.radonc.2005.03.001 |
| [19] |
De Los Santos J, Popple R, Agazaryan N, et al. Image guided radiation therapy (IGRT) technologies for radiation therapy localization and delivery[J]. Int J Radiat Oncol Biol Phys, 2013, 87(1): 33-45. DOI:10.1016/j.ijrobp.2013.02.021 |
| [20] |
高绪峰, 唐德文, 王培, 等. ExacTrac和CBCT IGRT在肺癌IMRT应用研究[J]. 中华放射肿瘤学杂志, 2015, 24(5): 560-563. Gao XF, Tang DW, Wang P, et al. Application of ExacTrac and cone-beam computed tomography image-guided radiotherapy in intensity-modulated radiotherapy for lung cancer[J]. Chin J Radiat Oncol, 2015, 24(5): 560-563. DOI:10.3760/cma.j.issn.1004-4221.2015.05.022 |
 2019, Vol. 39
2019, Vol. 39


