2. 郑州大学第五附属医院放疗科 450000;
3. 郑州大学第五附属医院肿瘤科 450000
2. Department of Radiotherapy, The Fifth Affiliated Hospital of Zhengzhou University, Zhengzhou 450000, China;
3. Department of Oncology, The Fifth Affiliated Hospital of Zhengzhou University, Zhengzhou 450000, China
恶性胶质母细胞瘤(glioblastoma,GBM)是中枢神经系统中最常见的原发性肿瘤,约占所有脑和中枢神经系统肿瘤的30%[1]。根治性手术、放疗和化疗是临床治疗GBM常用的方法,尽管在一定程度上改善了患者病情,但对GBM患者的治疗效果较差,且极易产生不良预后[2-4]。据相关统计显示,GBM患者确诊后的中位生存时间仅为4.9个月[5],而放疗耐受性的产生是导致GBM失败的主要原因[6]。鉴于临床中还缺乏有效的方法提高GBM细胞对放疗的敏感性,因此,迫切需要对GBM辐射治疗抗性产生的潜在机制进行深入研究,为开发新的放射增敏剂提供理论支持。
近年来,miR-124在肿瘤放疗及化疗敏感性中的作用广泛被报道[7-8],然而,miR-124在GBM放射敏感性中的功能和调控机制还有待深入研究。本研究通过建立辐射抗性GBM细胞模型,分析miR-124在辐射抗性细胞中的表达及对肿瘤细胞放射敏感性的影响,并通过对miR-124下游靶基因进行预测,进一步探究miR-124调控GBM细胞放射敏感性的作用机制,为放疗耐受GBM患者的临床治疗提供新的生物靶点。
材料与方法1.材料:人脑胶质瘤细胞LN229和人肾上皮细胞293T(美国ATCC细胞库)、胎牛血清、RPMI 1640培养基、胰蛋白酶(美国GIBCO公司);脂质体2000试剂、2xSYBR green master mix(美国Invitrogen公司);miRNA First-Stand cDNA Synthesis Kit(美国GeneCopoeia公司);Annexin V-FITC/PC双染流式细胞凋亡检测试剂盒;定点突变试剂盒(北京TaKaRa公司);二喹啉甲酸(BCA)蛋白检测试剂盒、增强的化学发光(ECL)试剂、Dual Luciferase® Reporter Assay System试剂盒(美国Promega公司);STAT3、β-肌动蛋白抗体、小鼠抗人二抗(美国Santa Cruz公司)。
2.实验方法:细胞培养和抗放射性细胞建立293T和LN229细胞培养在含10%胎牛血清(FBS)的RPMI 1640培养基中,并置于37℃、5% CO2的恒温培养箱中培养。每2天更换一次培养基,待细胞汇合度达85%以上时弃去培养基,磷酸盐缓冲液(PBS)洗涤后加入胰蛋白酶消化。将细胞悬液转移到新的离心管中,1 000 r/min,离心半径8 cm,离心5 min后弃去上清,加入完全培养基重悬细胞。在细胞处于对数生长期时,给予一定剂量的X射线照射,之后换液,继续培养并密切观察细胞状态进行传代,待细胞状态恢复良好后,进行下一次照射,重复以上操作,并逐渐加大每次的照射剂量,直到成功构建具有稳定遗传特性的放射抵抗细胞株LN229R。
3.细胞转染:miR-124模拟物(miR-124)及阴性对照(miR-NC)、STAT3重组过表达质粒(STAT3)由上海GenePharma公司合成。将培养至对数生长期的LN229R接种于6孔板中,采用脂质体转染法将上述寡核苷酸或质粒转染到细胞中。
4. qRT-PCR检测mRNA和miRNA表达:采用TRIzol法提取细胞中的总RNA,利用miRNA First-Stand cDNA Synthesis Kit将miRNA反转录成互补的cDNA,U6 snRNA作为内参基因。反转录引物序列如下:miR-124,5′ GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACCGGCATT 3′;U6,5′ GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACTATGGAAC 3′。以反转录生成的cDNA为模板,按照RT-PCR试剂盒说明进行扩增,反应结束后根据标准曲线和Ct值计算miR-124相对表达水平,用2-ΔΔCt表示。qRT-PCR引物序列如下:miR-124,正义5′GCTAAGGCACGCGGTG 3′和反义5′GTGCAGGGTCCGAGGT 3′;U6,正义5′ TGCGGGTGCTCGCTTCGGCAGC 3′和反义5′ CCAGTGCAGGGTCCGAGGT 3′。
5.克隆形成实验分析细胞的放射敏感性:将转染后48 h的细胞接种至6 cm的培养皿中,分别给予0 Gy(对照组)、2、4、6、8 Gy 5个不同剂量的X射线照射,每组剂量点设3个重复样本。照射结束后继续培养细胞14 d,用1%结晶紫染液对细胞进行染色后,倒置显微镜下计数50个细胞以上的克隆数,并计算克隆形成率(PE)。再根据PE计算细胞的存活率(SF),SF=照射组PE/对照组PE×100%。根据不同剂量存活率均值,采用单击多靶模型进行曲线拟合,利用Graphpad 5.0软件绘制存活曲线,得出平均致死剂量(D0)、外推值(N)、准阈剂量(Dq)、SF2和放射增敏比(SER)值。
6.流式细胞术测细胞凋亡:转染后48 h用胰蛋白酶消化细胞,调整细胞密度为1×105/ml接种于6孔板中,1 000 r/min,离心半径8 cm,离心5 min后弃去上清,PBS洗涤3次,加入100 μl的结合缓冲液重悬细胞,之后依次加入5 μl的Annexin V和PI染色,在流式细胞仪上分析细胞凋亡情况。
7.双荧光素酶报告分析:本研究首先利用TargetScan软件预测发现在STAT3 3′UTR区域中1302~1309位点处存在与miR-124互补结合的核苷酸。为进一步验证miR-124与STAT3的靶向关系,扩增了STAT3 3′UTR中含miR-124结合位点的序列,并克隆到pGL3-basic荧光素酶质粒中构建野生型STAT3(STAT3-WT)重组质粒。使用点突变试剂盒突变STAT3-WT上的miR-124结合位点,构建突变型STAT3(STAT3-MUT)重组质粒。培养293T细胞并接种于24孔板中,待细胞汇合度达85%时,按照脂质体2000试剂操作步骤将STAT3-WT或STAT3-MUT报告质粒与miR-124、miR-NC、anti-miR-124或anti-miR-NC共转染到293T细胞中,48 h后利用Dual Luciferase® Reporter Assay System检测STAT3-WT或STAT3-MUT报告质粒的荧光素酶活性。
8. Western blot检测蛋白表达:转染后48 h收集LN229R细胞,加入RIPA裂解液裂解细胞,12 000 r/min,离心半径8 cm,离心10 min后取上清,利用BCA蛋白检测试剂盒测定蛋白浓度。用10% SDS-PAGE电泳分离蛋白,并转移至聚偏氟乙烯(PVDF)膜上,加入5%的脱脂奶粉于4℃条件下过夜封闭,之后加入STAT3和β-肌动蛋白抗体在37℃条件下孵育2 h,磷酸盐吐温缓冲液(PBST)洗涤3次,加入相应二抗孵育,后采用ECL试剂进行显影,采用Image J软件分析各组细胞中STAT3蛋白的相对表达量。
9.主要观察指标:miR-124对LN229R放射敏感性的影响;miR-124与STAT3靶向关系分析以及miR-124调控LN229R细胞放射敏感性的作用机制。
10.统计学处理:实验数据符合正态分布,用x±s表示。采用SPSS 20.0软件进行分析。两组数据间比较符合正态分布,采用独立样本t检验;多组比较经方差齐性检验采用单因素方差分析,组间比较采用SNK-q检验。P < 0.05为差异有统计学意义。
结果1. miR-124在化疗敏感和耐受的LN229R细胞中的表达:采用克隆形成实验对LN229R的放射敏感性进行分析,在8 Gy的放射剂量下,LN229R细胞的存活分数(0.036±0.005 0)显著高于LN229组(0.008±0.000 7),差异有统计学意义(t=4.762,P<0.05),曲线参数D0、Dq、SF2值均升高(表 1),说明LN229R细胞具有较强的放射耐受性。采用qRT-PCR检测LN229和LN229R细胞中miR-124的表达水平。LN229R细胞中的miR-124的表达水平(0.32±0.03)显著低于LN229组(1.02±0.09),差异有统计学意义(t=12.780,P<0.05)。由此证实miR-124可能参与调控LN229细胞对放射的敏感性。
|
|
表 1 放射敏感和耐受的LN229细胞在不同放射剂量下的拟合曲线的参数值 Table 1 The parameters of survival curves of LN229 and LN229R cells after radiation |
2.过表达miR-124对LN229R细胞放射敏感性和细胞凋亡率的影响:为进一步研究miR-124对LN229R细胞放射敏感性的影响,首先将miR-NC和miR-124模拟物转染到细胞中,采用qRT-PCR对转染效率进行评估。结果显示,miR-124模拟物转染组细胞中miR-124的表达水平(4.02±0.39)显著高于miR-NC转染组(0.95±0.06),差异有统计学意义(t=13.476,P<0.05),说明通过转染miR-124模拟物可建立miR-124过表达细胞模型。之后采用克隆形成实验对克隆形成数据进行曲线拟合发现,与miR-NC转染组相比,辐射剂量为8 Gy时,miR-124过表达可明显降低LN229R细胞的存活率[(0.033±0.005 0)vs.(0.003±0.000 4),t=5.655,P<0.05, 图 1],曲线参数D0、Dq、SF2值均降低(表 2)。流式细胞术检测结果显示,与miR-NC组相比,miR-124过表达组细胞凋亡率明显升高[(4.69±0.51)% vs.(22.34±2.42)%,t=12.361,P<0.05,图 1]。以上结果证实,miR-124过表达可增强LN229R细胞对放射的敏感性。
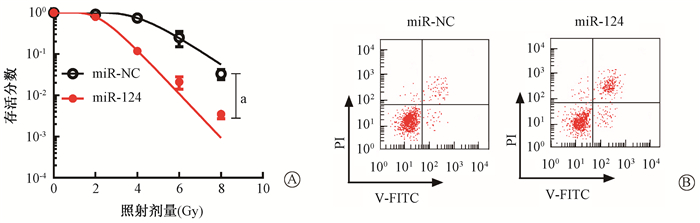
|
注:a照射剂量为8 Gy时,与miR-NC组相比,t=5.655,P<0.05 图 1 miR-124过表达对LN229R细胞放射敏感性的影响 A.细胞克隆存活率;B.细胞凋亡 Figure 1 The effect of miR-124 on LN229R cells radiosensitivity A.Cell survival; B.Cell apoptosis |
|
|
表 2 miR-124过表达对克隆形成实验拟合曲线参数值的影响 Table 2 The effect of miR-124 overexpression on the parameters of survival curves derived from clone formation experiment |
3. miR-124与STAT3靶向关系验证:利用TargetScan软件预测发现在STAT3 3′UTR区域中1302~1309位点处存在与miR-124互补结合的核苷酸(图 2)。采用双荧光素酶报告分析验证miR-124和STAT3的靶向关系,与miR-NC组相比,miR-124过表达显著抑制了STAT3-WT荧光素酶活性[(0.98±0.07)vs.(0.38±0.04),t=12.890,P<0.05],但对STAT3-MUT荧光素酶活性无影响(P>0.05);与anti-miR-NC组相比,miR-124抑制显著促进了STAT3-WT荧光素酶活性[(1.04±0.08)vs.(3.52±0.34),t=12.298,P<0.05],但对STAT3-MUT荧光素酶活性无影响(P>0.05)。由此得知,miR-124能够与STAT3靶向结合。

|
图 2 miR-124与STAT3的靶向结合序列 Figure 2 The targeting sites between miR-124 and STAT3 |
4. miR-124对STAT3蛋白表达的调控:为研究STAT3能否参与调控LN229R细胞的放射敏感性,首先采用Western blot对放射敏感和耐受细胞中STAT3蛋白表达水平进行测定,STAT3在LN229R细胞中的蛋白表达水平显著高于LN229细胞[(2.69±0.31)vs.(1.04±0.07),t=8.993,P<0.05],由此初步证实STAT3可能参与调控LN229细胞的放射敏感性。之后进一步探究了miR-124对STAT3蛋白表达的调控,与miR-NC组相比,外源过表达miR-124显著抑制STAT3蛋白表达[(0.96±0.08)vs.(0.37±0.04),t=11.425,P<0.05];相反,与anti-miR-NC组(0.97±0.03)相比,下调miR-124明显促进了STAT3蛋白表达[(1.01±0.09)vs.(2.42±0.28),t=8.304,P<0.05]。以上结果证明,STAT3在LN229R细胞中高表达,且miR-124可负调控STAT3蛋白表达。
5. STAT3逆转miR-124对LN229R细胞的放射增敏作用:采用Western blot法测定STAT3表达,与pcDNA转染组相比,STAT3转染可显著增加STAT3蛋白表达,说明STAT3可用于之后的过表达功能分析[(1.01±0.02)vs.(2.56±0.14),t=10.6,P<0.05]。利用克隆形成实验对克隆形成数据进行生存曲线拟合,结果如图 3所示,与pcDNA组相比,在8 Gy照射剂量下,STAT3过表达可显著增加LN229R细胞的存活分数[(0.041±0.005)vs.(0.085±0.005),t=10.6,P<0.05],且曲线参数D0、Dq、SF2均升高(表 3),说明STAT3过表达可降低LN229R细胞对放射的敏感性。为进一步研究miR-124是否通过靶向抑制STAT3表达发挥放射增敏作用,分别将miR-124、miR-124+pcDNA和miR-124+STAT3转染到LN229R细胞中,采用qRT-PCR法测定各组细胞中STAT3蛋白表达水平,与miR-123+pcDNA组相比,STAT3转染可逆转miR-124对LN229R细胞中STAT3表达的抑制作用[(1.06±0.05)vs.(3.26±0.17),t=6.141,P<0.05]。利用克隆形成实验对克隆形成数据进行生存曲线拟合,结果如图 3所示,与miR-124+pcDNA组相比,外源回补STAT3显著增加了LN229R细胞的存活分数[(0.002±0.001)vs.(0.051±0.005),t=9.246,P<0.05](图 3),且曲线参数D0、Dq、SF2均升高(表 4)。以上结果证实,外源回补STAT3可逆转miR-124对LN229R细胞的放射增敏作用,由此说明,miR-124通过靶向抑制STAT3表达改善了LN229R细胞对放射的敏感性。
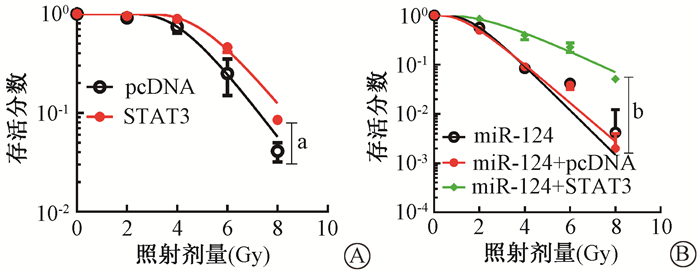
|
注:照射剂量为8 Gy时,a与pcDNA组相比,t=10.6,P<0.05;b与miR-124+pcDNA组相比,t=9.246,P<0.05 图 3 外源回补STAT3对LN229R细胞放射敏感性(A)及STAT3对miR-124改善的LN229R细胞放射敏感性(B)的影响 Figure 3 The effects of STAT3 on the radiosensitivity of LN229R cells (A) and miR-124-transfected LN229R cells (B) |
|
|
表 3 上调STAT3对克隆形成实验拟合曲线的参数值的影响 Table 3 The effect of STAT3 overexpression on parameter value of curve derived from clone formation experiment |
|
|
表 4 上调STAT3对miR-124降低的克隆形成实验拟合曲线的参数值的影响 Table 4 The effect of STAT3 overexpression on the parameters of survival curve of miR-124 transfected cells derived from clone formation experiment |
讨论
放疗在脑肿瘤的治疗中发挥着核心作用,在过去几十年,手术辅助放疗是临床中对GBM患者进行治疗的标准方法。尽管放射疗法及各种新型化疗药物的临床应用提高了治疗效果,但患者的生存率仍然较低,其中放疗抵抗被认为是导致GBM治疗失败的原因之一,因此,有必要寻找一种新型的放疗增敏剂以提高GBM患者的临床治疗效果。随着分子生物学技术的不断发展,miRNAs在肿瘤放疗耐受性中的作用被广泛研究。如Zhen等[9]研究显示,在受照的GBM细胞中,miR-10b过表达通过促进细胞增殖并抑制凋亡增强肿瘤细胞对放射的耐受性;Guo等[10]证实,miR-26a通过靶向抑制ATM蛋白表达改善GBM细胞对放射敏感性,也预示了miR-26b可能作为潜在的生物靶点改善GBM患者的放射治疗效果。
微小RNA(microRNA,miRNA)是通过与靶基因的3′-非翻译区(3′-untranslated region,3′-UTR)完全或不完全互补结合调节基因表达的小非编码RNA[11],在基因表达的调控中发挥重要的负调控作用[12]。miRNA可调节大约60%的蛋白质编码基因,并可通过调控细胞的生长、分化、凋亡以及细胞周期等在肿瘤发展中起重要作用。根据它们调控的基因或途径,miRNA可以在癌症中起肿瘤抑制剂或癌基因的作用,近年来,越来越多的证据表明miRNA可影响肿瘤细胞对化疗或放射的敏感性,这一发现也为GBM的临床诊断和治疗提供了新的思路[13-14]。miR-124最早被报道在神经元细胞中高度表达[15],但之后的研究表明,该miRNA在多种癌症组织中(如结直肠癌[16]、乳腺癌[17]、口腔癌[18])均表现出明显的下调,并发挥抑癌活性。MiR-124是哺乳动物神经系统最具特征性的一种小分子RNA,在人类基因组中具有高度的保守性[19]。近年来研究表明,miR-124可通过调控肿瘤细胞增殖、凋亡、侵袭、迁移、上皮-间质转化(EMT)等生物学过程参与肿瘤的发生发展,并发挥抑癌因子作用,在某些癌症中miR-124还可参与肿瘤化疗或放射抗性产生过程。如miR-124可通过靶向阻断EMT诱导剂PRRX1表达增强结肠直肠癌细胞的放射敏感性[20];通过外源过表达miR-124可降低宫颈癌细胞的克隆形成及放射增敏比,促进放射后细胞的凋亡率,最终改善宫颈癌对放射的敏感性[21]。为研究miR-124对GBM患者放射敏感性的影响,在本研究中,首先对miR-124在LN229或LN229R细胞中的表达水平进行检测,结果显示,在LN229R细胞中miR-124的表达水平显著下调,由此初步证实miR-124可能参与GBM放射耐受性产生过程。进一步的功能分析揭示miR-124过表达可增强LN229R细胞的放射敏感性并生存并促进细胞凋亡。在之前的研究中,Deng等[22]证实,miR-124上调能够促进GBM细胞及小鼠移植瘤对放射的敏感性,该结论也与本研究结果相一致。
STAT3是研究较为广泛的致癌因子,在多种肿瘤组织和细胞中高表达。大量研究证实,STAT3的异常高表达可通过激活下游相关基因表达或诱导肿瘤细胞自噬,参与调控肿瘤的放射敏感性。例如,在受照的食管鳞状细胞癌细胞(ESCC)中,STAT3抑制剂stattic和NSC74859可通过抑制细胞增殖和集落形成,并促进细胞凋亡和DNA双链断裂改善ESCC的放射敏感性[23-24];利用慢病毒干扰技术敲低STAT3可降低Bcl-2、VEGF和p53表达,最终增强喉鳞癌细胞对放射的敏感性[25]。为进一步研究miR-124是否通过调控下游靶基因表达诱导放射耐受的GBM细胞凋亡,并降低细胞生存率,进而影响肿瘤细胞对放射的敏感性,对miR-124的靶基因进行预测和分析,结果证实STAT3是miR-124的一个靶基因,且外源回补STAT3可逆转miR-124对细胞生存的抑制。
综上所述,miR-124在LN229R细胞中表达量降低;上调miR-124可通过靶向抑制STAT3改善GBM细胞的辐射敏感性,由此为GBM放射增敏的个性化治疗提供理论支持。
利益冲突 全体作者无利益冲突,排名无争议,未因进行该研究而接受任何不正当的职务和财务利益作者贡献声明 马建负责实验和论文撰写;王新军、付旭东负责数据统计;周少龙、田碧协助完成实验;闫琳参与研究设计与指导,提出修改意见
| [1] |
Dolecek TA, Propp JM, Stroup NE, et al. CBTRUS statistical report:primary brain and central nervous system tumors diagnosed in the United States in 2005-2009[J]. Neuro Oncol, 2013, 15(5): 646-647. DOI:10.1093/neuonc/nos218 |
| [2] |
Carlsson SK, Brothers SP, Wahlestedt C. Emerging treatment strategies for glioblastoma multiforme[J]. EMBO Mol Med, 2015, 6(11): 1359-1370. DOI:10.15252/emmm.201302627 |
| [3] |
Omuro A, DeAngelis LM. Glioblastoma and other malignant gliomas:a clinical review[J]. JAMA, 2013, 310(17): 1842-1850. DOI:10.1001/jama.2013.280319 |
| [4] |
Wang Y, Jiang T. Understanding high grade glioma:molecular mechanism, therapy and comprehensive management[J]. Cancer Lett, 2013, 331(2): 139-146. DOI:10.1016/j.canlet.2012.12.024 |
| [5] |
Ohgaki H, Dessen P, Jourde B, et al. Genetic pathways to glioblastoma a population-based study[J]. Cancer Res, 2004, 64(19): 6892-6899. DOI:10.1158/0008-5472.CAN-04-1337 |
| [6] |
Atkins RJ, Ng W, Stylli SS, et al. Repair mechanisms help glioblastoma resist treatment[J]. J Clin Neurosci, 2015, 22(1): 14-20. DOI:10.1016/j.jocn.2014.09.003 |
| [7] |
Chen SM, Chou WC, Hu LY, et al. The effect of microRNA-124 overexpression on anti-tumor drug sensitivity[J]. PLoS One, 2015, 10(6): e0128472. DOI:10.1371/journal.pone.0128472 |
| [8] |
Lin SM, Xia Q, Zhang YQ, et al. miR-124 regulates radiosensitivity of colorectal cancer cells by targeting PRRX1[J]. J Sout Med Univ, 2016, 36(8): 1110-1116. |
| [9] |
Zhen L, Li J, Zhang M, et al. MiR-10b decreases sensitivity of glioblastoma cells to radiation by targeting AKT[J]. J Biol Res (Thessalon), 2016, 23(1): 14. DOI:10.1186/s40709-016-0051-x |
| [10] |
Guo P, Lan J, Ge J, et al. MiR-26a enhances the radiosensitivity of glioblastoma multiforme cells through targeting of ataxia-telangiectasia mutated[J]. Exp Cell Res, 2014, 320(2): 200-208. DOI:10.1016/j.yexcr.2013.10.020 |
| [11] |
Bartel DP. MicroRNAs:target recognition and regulatory functions[J]. Cell, 2009, 136(2): 215-233. DOI:10.1016/j.cell.2009.01.002 |
| [12] |
Lim LP, Lau NC, Garrett-Engele P, et al. Microarray analysis shows that some microRNAs downregulate large numbers of target mRNAs[J]. Nature, 2005, 433(7027): 769-773. DOI:10.1038/nature03315 |
| [13] |
Díaz-López A, Moreno-Bueno G, Cano A. Role of microRNA in epithelial to mesenchymal transition and metastasis and clinical perspectives[J]. Cancer Manag Res, 2014, 6: 205-216. DOI:10.2147/CMAR.S38156 |
| [14] |
Zhao L, Bode AM, Cao Y, et al. Regulatory mechanisms and clinical perspectives of miRNA in tumor radiosensitivity[J]. Carcinogenesis, 2012, 33(11): 2220-2227. DOI:10.1093/carcin/bgs235 |
| [15] |
Makeyev EV, Zhang J, Carrasco MA, et al. The microRNA miR-124 promotes neuronal differentiation by triggering brain-specific alternative pre-mRNA splicing[J]. Mol Cell, 2007, 27(3): 435-448. DOI:10.1016/j.molcel.2007.07.015 |
| [16] |
Zhou L, Xu Z, Ren X, et al. MicroRNA-124(miR-124) inhibits cell proliferation, metastasis and invasion in colorectal cancer by downregulating Rho-associated protein kinase 1(ROCK1)[J]. Cell Physiol Biochem, 2016, 38(5): 1785-1795. DOI:10.1159/000443117 |
| [17] |
Zhang F, Wang B, Long H, et al. Decreased miR-124-3p expression prompted breast cancer cell progression mainly by targeting Beclin-1[J]. Clin Lab, 2016, 62(6): 1139-1145. |
| [18] |
Li X, Fan Q, Li J, et al. MiR-124 down-regulation is critical for cancer associated fibroblasts-enhanced tumor growth of oral carcinoma[J]. Exp Cell Res, 2017, 351(1): 100-108. DOI:10.1016/j.yexcr.2017.01.001 |
| [19] |
Lagos-Quintana M, Rauhut R, Meyer J, et al. New microRNAs from mouse and human[J]. RNA, 2003, 9(2): 175-179. |
| [20] |
Zhang Y, Zheng L, Huang J, et al. MiR-124 radiosensitizes human colorectal cancer cells by targeting PRRX1[J]. PLoS One, 2014, 9(4): e93917. DOI:10.1371/journal.pone.0093917 |
| [21] |
王梦洁, 孟碧, 高飞, 等. miR-124对宫颈癌Hela细胞放射敏感性的影响及其机制探讨[J]. 现代肿瘤医学, 2018, 26(6): 818-821. Wang MJ, Meng B, Gao F, et al. Effect of miR-124 on the radiosensitivity of cervical cancer Hela cells and its mechanism[J]. Mod Oncol, 2018, 26(6): 818-821. DOI:10.3969/j.issn.1672-4992.2018.06.002 |
| [22] |
Deng X, Ma L, Wu M, et al. miR-124 radiosensitizes human glioma cells by targeting CDK4[J]. J Neuro-Oncol, 2013, 114(3): 263-274. DOI:10.1007/s11060-013-1179-2 |
| [23] |
Zhang Q, Zhang C, He J, et al. STAT3 inhibitor stattic enhances radiosensitivity in esophageal squamous cell carcinoma[J]. Tumor Biol, 2015, 36(3): 2135-2142. DOI:10.1007/s13277-014-2823-y |
| [24] |
Zhang C, Yang X, Zhang Q, et al. STAT3 inhibitor NSC74859 radiosensitizes esophageal cancer via the downregulation of HIF-1α[J]. Tumor Biol, 2014, 35(10): 9793-9799. DOI:10.1007/s13277-014-2207-3 |
| [25] |
Li X, Wang H, Lu X, et al. STAT3 blockade with shRNA enhances radiosensitivity in Hep-2 human laryngeal squamous carcinoma cells[J]. Oncol Rep, 2010, 23(2): 345-353. |
 2019, Vol. 39
2019, Vol. 39


