在胸部肿瘤的放射治疗中出现的副作用有放射性肺纤维化(radiation-induced lung fibrosis, RILF)[1]。其特征是改变细胞组成和破坏肺内环境的稳定,导致细胞外基质过度积累,最终导致肺功能丧失[2]。上皮细胞-间充质转化(EMT),是指上皮细胞转化为具有间质表型细胞的生物学过程[3],其特征在于细胞间连接的溶解、运动性增强和胞外基质合成[4]。EMT在胚胎发育、伤口愈合和癌症等进展中发挥重要作用[5-6]。神经纤毛蛋白-1(neuropilin-1, NRP1)是由Wild等[7]在1995年发现的,位于神经纤维轴突上的非酪氨酸激酶跨膜糖蛋白。NRP1研究涉及神经系统发育、血管形成、肿瘤发生发展等领域[8]。研究显示NRP1转基因小鼠具有过多的毛细血管[9-10],而NRP1敲除小鼠显示血管发育显著缺陷[11]。
本研究利用人源和鼠源的肺泡上皮细胞系,建立敲低和过表达NRP1的细胞模型,观察NRP1对电离辐射诱导EMT各种标志物的影响,进一步阐明NRP1对辐射诱导EMT的作用机制,为临床胸部肿瘤放疗中防治放射性肺纤维化提供新的实验依据。
材料与方法1.细胞系:所需细胞购自中国科学院上海细胞库,包括人Ⅱ型肺泡上皮细胞系A549和小鼠肺上皮细胞系MLE-12。
2.试剂:购自美国GIBCO公司的DMEM高糖型培养基、胎牛血清,以及购自美国Invitrogen公司的青霉素与链霉素。BCA蛋白浓度检测试剂盒购自上海碧云天生物技术有限公司,兔/鼠二抗购自美国Bioworld Technology公司,TRIzol购自美国Invitrogen公司,反转录试剂盒和qPCR试剂盒均购自大连宝生物公司,RFect转染试剂购自江苏常州百代生物公司,siRNA片段由上海吉玛制药技术公司合成。
3.照射条件:采用美国PRECISION X-RAY公司制造的X-RAD320生物辐照仪,细胞单次照射剂量为10 Gy,源靶距70 cm,剂量率1.0 Gy/min。
4. NRP1low-A549和NRP1high-A549细胞模型构建:利用慢病毒转染法,即首先利用本实验室保存的NRP1抑制(RetroQ-NRP1)和过表达质粒(pLNCX2-NRP1)转染293T细胞,每隔12 h收取一次病毒液,共收取4次,收取的病毒液3 000 r/min,离心半径为5.96 cm,离心10 min后将上清液保存于-80℃。然后将病毒液与培养液按1:4比例混合,再加入转染增强剂(polybrere)对A549细胞感染2 d,第3天开始换正常培养液,待细胞长满后分别利用G418和pure对NRP1high-A549和NRP1low-A549细胞进行筛药,筛选1周至对照组细胞全死为止,剩余存活细胞为所需细胞模型。
5. siNRP1-MLE-12细胞模型构建:利用脂质体转染法构建siNRP1-MLE-12细胞模型,首先构建siNRP1片段(5′CCAGAUUACAGCAUCCAAUTT 3′, 5′AUUGGAUGCUGUAAUCUGGTT 3′),将siNRP1片段与OPT-MEM混合5 min,RFect与OPT-MEM混合后与第一步试剂充分混匀,室温静置20 min,最后将混合物加入6孔板培养细胞中,孵箱中培养24 h。
6. Western blot检测:在6孔板中培养各组细胞,分别于单次10 Gy X射线照射后0、12、24和48 h收取细胞,并提取总蛋白。利用BCA试剂盒检测蛋白浓度,确定上样量。然后进行10%聚丙烯酰胺凝胶电泳(SDS-PAGE),然后将凝胶转印至硝酸纤维素膜(PVDF)上,室温下用5%脱脂奶粉封闭2 h;用2%脱脂奶粉稀释一抗,4℃孵育至过夜;用等渗缓冲盐溶液(TBST)洗涤后加辣根过氧化酶标记二抗,室温下孵育2 h,在TBST缓冲液洗膜后,利用增强化学发光法(ECL)试剂盒显影。
7. qPCR检测:在6孔板中培养各组细胞,利用RNA抽提剂(TRIzol)分别于10 Gy X射线照射后0、12、24和48 h收取细胞,分别利用三氯甲烷、异丙醇和75%乙醇处理收取的细胞并提取RNA。然后检测各组RNA浓度,并利用反转录试剂盒将各组RNA反转录成cDNA,稀释4倍。将稀释的cDNA与引物、SYBR Green和去RNA酶水(dH2O)混合配成20 μl PCR反应液进行RT-PCR检测。
8.鬼笔环肽染色法:将细胞盖玻片用磷酸盐缓冲液(PBS)清洗两次,每次5 min。利用4%多聚甲醛溶液固定,然后用PBS清洗盖玻片两次。利用含0.5%Trixton X-100透化缓冲液透化15 min。利用配置好的鬼笔环肽工作液, 避光条件下染色30 min。利用配制好的DAPI工作液,避光条件下染色5 min。最后滴加荧光抗猝灭剂100 μl, 置于荧光显微镜下观察细胞骨架结构。
9.统计学处理:采用SPSS 24.0软件进行数据分析。结果经正态性检验符合正态分布,以x±s表示。不同组间比较采用方差分析和独立样本t检验。P < 0.05为差异有统计学意义。
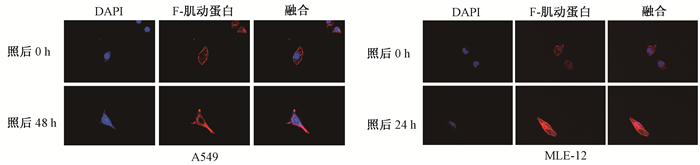
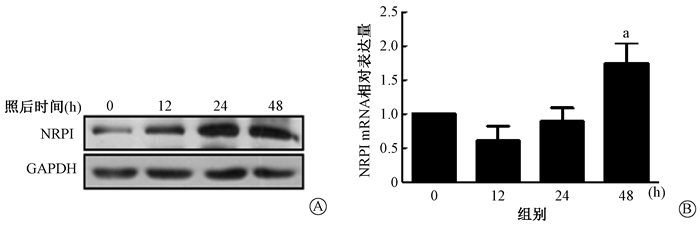
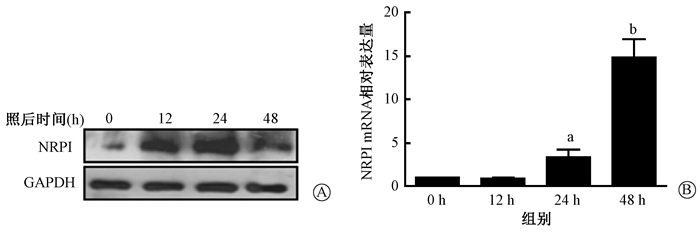
结果1.电离辐射对细胞形态学及NRP1表达的影响:结果如图 1所示,红色部分为细胞骨架的F-肌动蛋白(F-actin),蓝色部分为DAPI染色的细胞核。与辐照后0 h相比,A549细胞在照射后48 h细胞骨架收缩且较密集,细胞显示纺锤丝;同样MLE-12细胞照射后24 h细胞骨架收缩且致密。野生型A549和MLE-12细胞电离辐射作用后NRP1 mRNA和蛋白表达显著升高(t=3.344、5.947, P < 0.05;t=12.547, P < 0.01),如图 2、3所示。
|
图 1 野生型A549和MLE-12细胞辐照后细胞骨架蛋白(F-actin)变化 鬼笔环肽染色×40 Figure 1 Radiation-induced alterations of cytoskeletal protein (F-actin) in A549 and MLE-12 cells Phalloidin staining ×40 |
|
注:a与0 h比较, t=3.344, P < 0.05 图 2 A549细胞在10 Gy X射线照射后不同时间NRP1的表达变化 A.蛋白水平;B. mRNA水平 Figure 2 Expressions of NRP1 protein and mRNA in A549 cells at different time after 10 Gy X-ray irradiation A. Western blot assay of NRP1 protein; B. Relative NRP1 mRNA level |
|
注:a与0 h比较, t=5.947, P < 0.05;b与0 h比较, t=12.547, P < 0.01 图 3 单次10 Gy X射线照射后野生型MLE-12细胞NRP1表达变化 A.蛋白水平;B. mRNA水平 Figure 3 Expressions of NRP1 protein and mRNA in MLE-12 cells aft er 10 Gy X-ray irradiation A. Western blot assay of NRP1 protein; B. NRP1 mRNA in A549 cells |
2.电离辐射诱导肺上皮细胞发生EMT
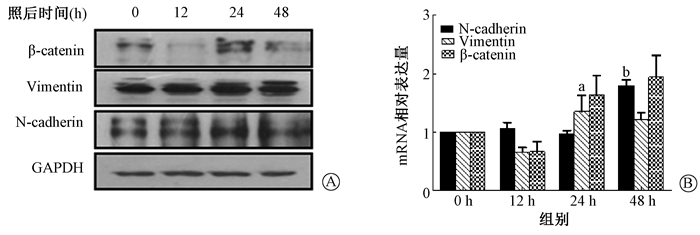
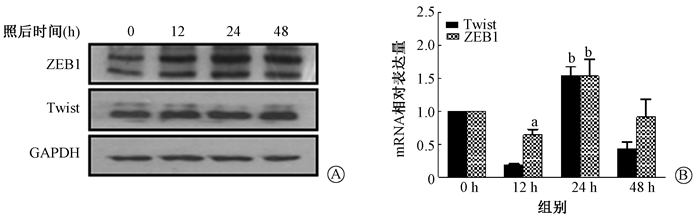
(1) 野生组A549细胞:Vimentin和N-cadherin在mRNA和蛋白水平照射后显著升高(t=2.917、7.361, P < 0.01),如图 4所示。ZEB1和Twist转录因子照射后mRNA和蛋白表达显著升高(t=4.852、9.278, P < 0.01),如图 5。
|
注:a与0 h比较, t=2.917, P < 0.05;b与0 h比较, t=7.361, P < 0.01 图 4 单次10 Gy X射线照射后A549细胞EMT标志物的表达变化 A.蛋白水平;B. mRNA水平 Figure 4 Expressions of EMT markers in A549 cells after 10 Gy X-ray irradiation A. Western blot assay of EMT proteins; B. Relative mRNA levels |
|
注:a与0 h比较, t=2.917, P < 0.05;b与0 h比较, t=4.852、9.278, P < 0.01 图 5 单次10 Gy X射线照射后A549细胞EMT转录因子的表达变化 A.蛋白水平;B. mRNA水平 Figure 5 Expressions of EMT transcription factors in A549 cells afterasingle 10 Gy X-ray exposure A. Western blot assay of proteins; B. Relative mRNA level |
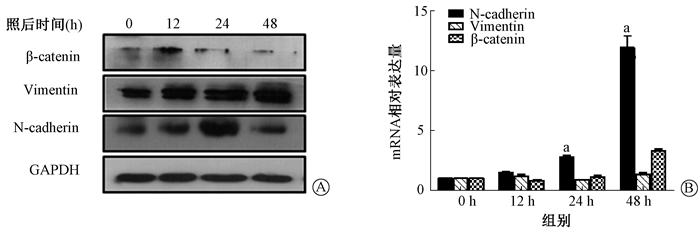
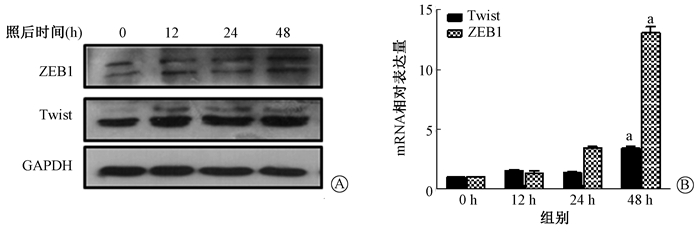
(2) 野生型MLE-12细胞:Vimentin和N-cadherin在mRNA和蛋白水平照射后显著升高(t=9.652、31.357, P < 0.01),β-catenin蛋白表达显著降低,如图 6所示。野生型MLE-12细胞中ZEB1和Twist转录因子照射后mRNA和蛋白表达呈时间依赖性升高(t=30.985、17.266, P < 0.01),如图 7。
|
注:a与0 h比较, t=9.652、31.357, P < 0.01 图 6 单次10 Gy X射线照射后MLE-12细胞EMT标志物的表达变化 A.蛋白水平;B. mRNA水平 Figure 6 Expressions of EMT markers in MLE-12 cells after single 10 Gy X-ray irradiation A. Western blot assay of proteins; B. Relative mRNA level |
|
注:a与0 h比较, t=30.985、17.266, P < 0.01 图 7 单次10 Gy X射线照射后MLE-12细胞EMT转录因子的表达变化 A.蛋白水平;B. mRNA水平 Figure 7 Expressions of EMT transcription factors in MLE-12 cells after single 10 Gy X-ray irradiation A. Western blot assay of proteins; B. Relative mRNA level |
3. NRP1基因对辐射诱导肺上皮细胞发生上皮-间质转化的影响
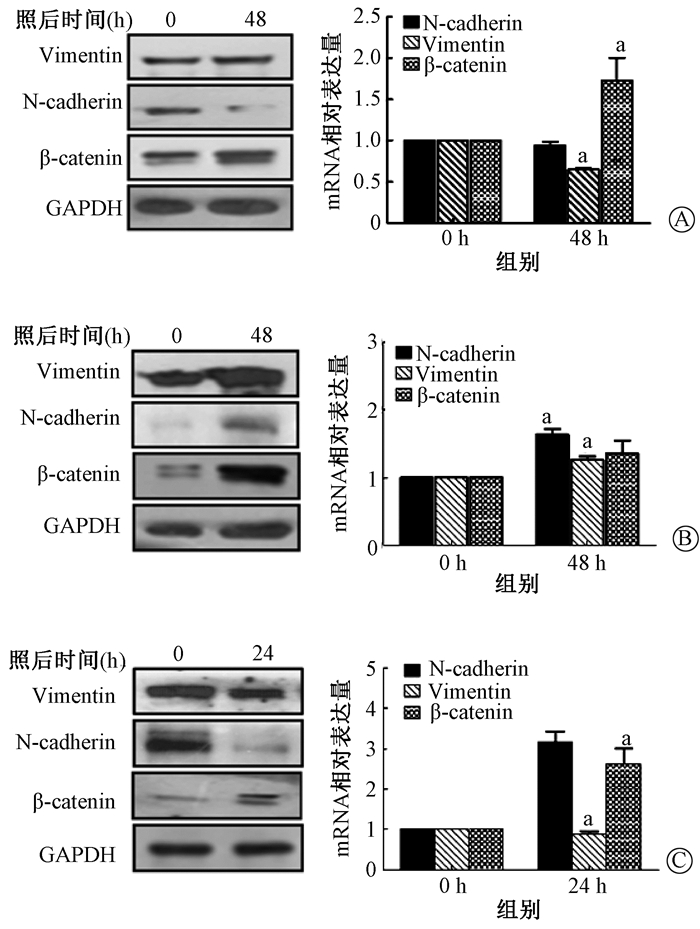
(1) NRP1对辐射诱导EMT标志物的影响:NRP1low-A549组受照后Vimentin显著降低(t=15.707,P < 0.01)、N-cadherin蛋白表达显示下降和β-catenin显著升高(t=3.993, P < 0.01)。NRP1high-A549组照射后在mRNA和蛋白水平N-cadherin和Vimentin显著升高(t=16.055、5.560, P < 0.01)。siNRP1-MLE-12细胞模型照射后Vimentin表达显著降低(t=5.745, P < 0.01),N-cadherin照射后蛋白表达显著降低,β-catenin表达显著升高(t=13.538, P < 0.01),结果见图 8。
|
注:a与0 h比较,t=15.707、3.993、16.055、5.560、5.745、13.538,P < 0.01 图 8 敲低和过表达NRP1细胞模型中EMT标志物蛋白和mRNA表达变化 A. NRP1low-A549组;B. NRP1high-A549组;C. siNRP1-MLE-12组 Figure 8 Expressions of EMT marker protein and mRNA in NRP1 knock-down and overexpression cells A. NRP1low-A549 group; B. NRP1high-A549 group; C. siNRP1-MLE-12 group |
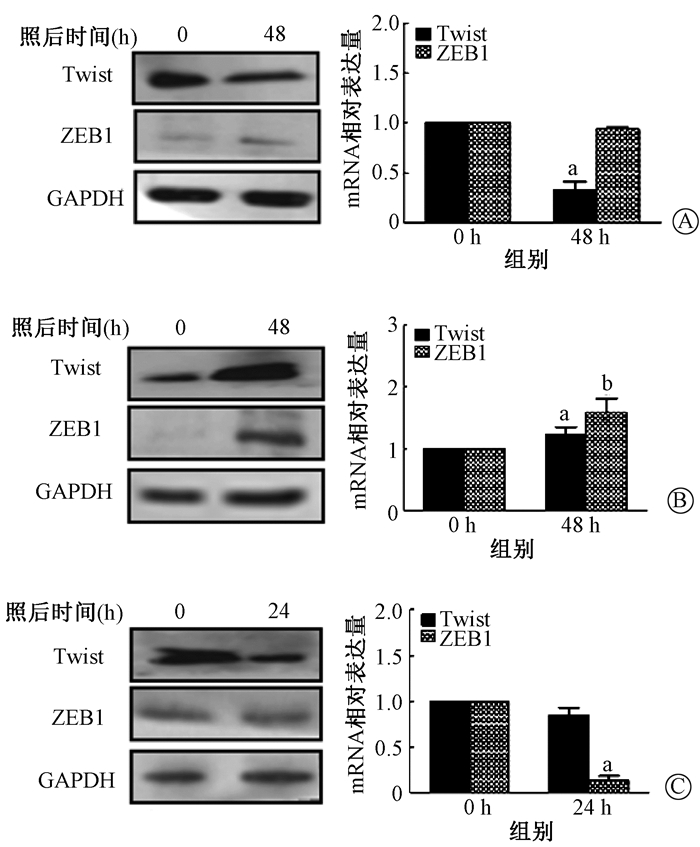
(2) NRP1对辐射诱导EMT转录因子的影响:NRP1low-A549组照射后Twist转录因子表达显著下降(t=3.987, P < 0.01)。NRP1high-A549组照射后ZEB1和Twist转录因子表达显著升高(t=11.289, P < 0.01;t=2.903, P < 0.05)。siNRP1-MLE-12细胞模型照射后ZEB1转录因子mRNA显著下降(t=13.449, P < 0.01),Twist转录因子照射后蛋白表达显著降低。结果见图 9。
|
注:a与0 h比较,t=3.987、11.289、13.449, P < 0.01;b与0 h比较, t=2.903,P < 0.05 图 9 敲低和过表达NRP1细胞模型中EMT转录因子蛋白和mRNA表达变化 A. NRP1low-A549组;B. NRP1high-A549组;C. siNRP1-MLE-12组 Figure 9 Expressions of protein and mRNA of EMT transcription factors in NRP1 knock-down and overexpression cells A. NRP1low-A549 group; B. NRP1high-A549 group; C. siNRP1-MLE-12 group |
讨论
放射治疗是各种人类肿瘤广泛使用的治疗方式,电离辐射(IR)触发活性氧的产生,从而破坏DNA并诱导癌细胞凋亡或衰老[12]。最近的研究观察到放疗对EMT有一定的影响,而且EMT在癌细胞的侵袭或转移中发挥重要作用[13]。Zhou等[14]研究发现IR后5~7 d,转化生长因子β(TGF-β)信号被激活促进肺癌细胞和结肠直肠腺癌细胞发生EMT和转移。EMT是一个复杂的生理过程,涉及许多信号分子和蛋白质,它被确定为纤维化、伤口愈合和癌症发生发展的重要机制[15]。在EMT期间,肿瘤细胞失去其上皮特征并且获得导致侵入和迁移行为的间充质表型,EMT最早发生的事件包括上皮标志物(β-连环蛋白)下调,以及间质标志物(N-钙黏蛋白和波形蛋白等)的上调。Fei等[16]研究发现2 Gy γ射线照射后,U251胶质瘤细胞呈现间充质表型,与假照射组相比,上皮标志物表达减少,间质标志物表达增加。
NRP1是内皮细胞扩增和调节VEGF信号传导的受体,内皮细胞、血管平滑肌细胞、间充质干细胞都可表达NRP1,它与TGF-β、血小板衍生因子(PDGF)等信号通路密切相关[17]。Peng等[18]研究发现在胃癌中,通过RNA干扰(RNAi)敲低了NRP1的表达,发现波形蛋白和N-钙粘蛋白的表达降低,而E-钙粘蛋白的表达增加。Prud′homme等[9]研究结果表明NRP1可以促进EMT,Fuxe等[19]研究发现NRP1通过增强TGF-β等信号传导,促进EMT的发生发展。以上研究显示,NRP1对EMT具有调节作用,但是NRP1对电离辐射诱导肺上皮细胞EMT的研究甚少。本研究采用10 Gy X射线照射NRP1low-A549组细胞模型,EMT上皮标志物β-catenin在照射后蛋白和mRNA水平表达呈时间依赖性升高,间充质标志物N-cadherin在照射后表达显著降低。而当NRP1过表达后,β-catenin在照射后表达显著下降,N-cadherin在照射后呈时间依赖性升高。将两组细胞模型对比发现,在人肺泡上皮细胞中对NRP1抑制或过表达后,当电离辐射诱发生EMT时,NRP1可以抑制或增强EMT标志物的表达。
另外,在小鼠正常肺上皮细胞(MLE-12)研究中显示出相同的实验结果,siNRP1-MLE-12细胞模型在单次10 Gy X射线照射后β-catenin表达照射后呈时间依赖性升高,而N-cadherin和Vimentin在照射后表达显著下降;野生型MLE-12细胞照射后EMT标志物表达则相反。这说明在小鼠肺上皮细胞中单次10 Gy X射线照射诱导EMT后,NRP1对辐射诱导EMT标志物表达同样具有调节作用。综上所述,在人和鼠源两种肺上皮细胞系中,NRP1对辐射诱导EMT标志物均存在调节作用。
EMT是一种失去上皮特征获得间充质表型的转化过程,这种表型转换是一个主要由转录因子如Twist等调节的可逆过程,其下调上皮标记物并上调间充质标记物[20]。Twist和ZEB1等转录因子是连接EMT和纤维化的诱导因子[21]。所以本研究构建稳定表达的NRP1low-A549和NRP1high-A549细胞模型以及siNRP1-MLE-12细胞模型,观察在人和鼠两种肺上皮细胞系中NRP1对电离辐射诱导EMT相关转录因子调节作用。本研究结果显示,NRP1抑制后Twist在单次10 Gy X射线照射后表达显著下降;然而当NRP1高表达时ZEB1和Twist表达在照射后呈时间依赖性升高。同样,siNRP1-MLE-12细胞模型在单次10 Gy X射线照射后ZEB1和Twist表达均呈时间依赖性下降;而MLE-12组细胞,Twist表达在照射后呈时间依赖性升高。说明在人和鼠两种肺上皮细胞系中,辐射诱导EMT后NRP1对其相关转录因子存在调节作用。
综上所述,本研究利用X射线照射诱导发生肺上皮细胞的EMT,结果显示,10 Gy X射线诱导肺上皮细胞发生EMT,当NRP1受抑制时,EMT上皮标志物表达增强,间充质标志物表达下降,可能与EMT转录因子的表达下降有关;而当NRP1过表达时,EMT相关标志物表达与之相反,可能与EMT转录因子的表达增强有关。说明NRP1可促进辐射诱导人和小鼠上皮细胞EMT的发生,而这种促进作用可能通过激活转录因子ZEB1和Twist的转录。但是NRP1对辐射诱导EMT作用中具体机制以及关键分子的作用,需要进一步完善。
利益冲突 本研究由署名作者按以下贡献声明独立开展,不涉及任何利益冲突作者贡献声明 陈志远进行实验并撰写论文初稿;刘霖霖、魏威、董卓、吕亚慧参与模型建立;王蕊、衣峻萱参与细胞培养;金顺子负责实验设计与经费提供,并在论文写作过程中给予指导
| [1] |
Bickelhaupt S, Erbel C, Timke C, et al. Effects of CTGF blockade on attenuation and reversal of radiation-induced pulmonary fibrosis[J]. J Natl Cancer Inst, 2017, 109(8): djw339. DOI:10.1093/jnci/djw339 |
| [2] |
Biondini D, Balestro E, Lacedonia D, et al. Pretreatment rate of decay in forced vital capacity predicts long-term response to pirfenidone in patients with idiopathic pulmonary fibrosis[J]. Sci Rep, 2018, 8(1): 5961. DOI:10.1038/s41598-018-24303-4 |
| [3] |
Yeung KT, Yang J. Epithelial-mesenchymal transition in tumor metastasis[J]. Mol Oncol, 2017, 11(1): 28-39. DOI:10.1002/1878-0261.12017 |
| [4] |
Liu W, Wang X, Wang Y, et al. SGK1 inhibition-induced autophagy impairs prostate cancer metastasis by reversing EMT[J]. J Exp Clin Cancer Res, 2018, 37(1): 73. DOI:10.1186/s13046-018-0743-1 |
| [5] |
Smith BN, Bhowmick NA. Role of EMT in metastasis and therapy resistance[J]. J Clin Med, 2016, 5(2): 17. DOI:10.3390/jcm5020017 |
| [6] |
Ma Z, Xin Z, Hu W, et al. Forkhead box O proteins:Crucial regulators of cancer EMT[J]. Semin Cancer Biol, 2018, 50: 21-31. DOI:10.1016/j.semcancer.2018.02.004 |
| [7] |
Wild JR, Staton CA, Chapple K, et al. Neuropilins:expression and roles in the epithelium[J]. Int J Exp Pathol, 2012, 93(2): 81-103. DOI:10.1111/j.1365-2613.2012.00810.x |
| [8] |
King C, Wirth D, Workman S, et al. Interactions between NRP1 and VEGFR2 molecules in the plasma membrane[J]. Biochim Biophys Acta Biomembr, 2018, 1860(10): 2118-2125. DOI:10.1016/j.bbamem.2018.03.023 |
| [9] |
Prud'homme GJ, Glinka Y. Neuropilins are multifunctional coreceptors involved in tumor initiation, growth, metastasis and immunity[J]. Oncotarget, 2012, 3(9): 921-939. DOI:10.18632/oncotarget.626 |
| [10] |
Vivekanandhan S, Yang L, Cao Y, et al. Genetic status of KRAS modulates the role of Neuropilin-1 in tumorigenesis[J]. Sci Rep, 2017, 7(1): 12877. DOI:10.1038/s41598-017-12992-2 |
| [11] |
Raimondi C, Brash JT, Fantin A, et al. NRP1 function and targeting in neurovascular development and eye disease[J]. Prog Retin Eye Res, 2016, 52: 64-83. DOI:10.1016/j.preteyeres.2016.02.003 |
| [12] |
Kavanagh JN, Redmond KM, Schettino G, et al. DNA double strand break repair:a radiation perspective[J]. Antioxid Redox Signal, 2013, 18(18): 2458-2472. DOI:10.1089/ars.2012.5151 |
| [13] |
Yu K, Li Q, Shi G, et al. Involvement of epithelial-mesenchymal transition in liver fibrosis[J]. Saudi J Gastroenterol, 2018, 24(1): 5-11. DOI:10.4103/sjg.SJG_297_17 |
| [14] |
Zhou YC, Liu JY, Li J, et al. Ionizing radiation promotes migration and invasion of cancer cells through transforming growth factor-beta-mediated epithelial-mesenchymal transition[J]. Int J Radiat Oncol Biol Phys, 2011, 81(5): 1530-1537. DOI:10.1016/j.ijrobp.2011.06.1956 |
| [15] |
Yeung KT, Yang J. Epithelial-mesenchymal transition in tumor metastasis[J]. Mol Oncol, 2017, 11(1): 28-39. DOI:10.1002/1878-0261.12017 |
| [16] |
Fei Y, Xiong Y, Shen X, et al. Cathepsin L promotes ionizing radiation-induced U251 glioma cell migration and invasion through regulating the GSK-3β/CUX1 pathway[J]. Cell Signal, 2018, 44: 62-71. DOI:10.1016/j.cellsig.2018.01.012 |
| [17] |
Kofler N, Simons M. The expanding role of neuropilin:regulation of transforming growth factor-β and platelet-derived growth factor signaling in the vasculature[J]. Curr Opin Hematol, 2016, 23(3): 260-267. DOI:10.1097/MOH.0000000000000233 |
| [18] |
Peng Y, Liu YM, Li LC, et al. MicroRNA-338 inhibits growth, invasion and metastasis of gastric cancer by targeting NRP1 expression[J]. PLoS One, 2014, 9(4): e94422. DOI:10.1371/journal.pone.0094422 |
| [19] |
Fuxe J, Vincent T, de Herreros AG. Transcriptional crosstalk between TGF-β and stem cell pathways in tumor cell invasion:role of EMT promoting Smad complexes[J]. Cell Cycle, 2010, 9(12): 2363-2374. DOI:10.4161/cc.9.12.12050 |
| [20] |
Pires BR, Mencalha AL, Ferreira GM, et al. NF-kappaB is involved in the regulation of EMT genes in breast cancer cells[J]. PLoS One, 2017, 12(1): e0169622. DOI:10.1371/journal.pone.0169622 |
| [21] |
Nagaraja SS, Nagarajan D. Radiation-induced pulmonary epithelial-mesenchymal transition:a review on targeting molecular pathways and mediators[J]. Curr Drug Targets, 2018, 19(10): 1191-1204. DOI:10.2174/1389450119666180207092234 |
 2019, Vol. 39
2019, Vol. 39


