趋化因子CXCL12又称为基质细胞衍生因子-1α (stromal cell-derived factor-1α, SDF-1α), 属于CXC(Cys-X-Cys)类趋化因子蛋白家族,最早发现表达于骨髓基质细胞,目前的研究发现CXCL12不仅广泛表达于多种正常组织器官,包括脑、心脏、肝脏和肺,在肿瘤组织中也有表达。CXCR4是存在于细胞膜表面的G蛋白耦联7次跨膜受体,选择性结合趋化因子CXCL12后,可引起G蛋白构象改变,导致下游信号通路的激活,调控机体多种生理病理过程,主要包括造血及免疫系统调节、胚胎形成及发育、恶性肿瘤的发生发展等。
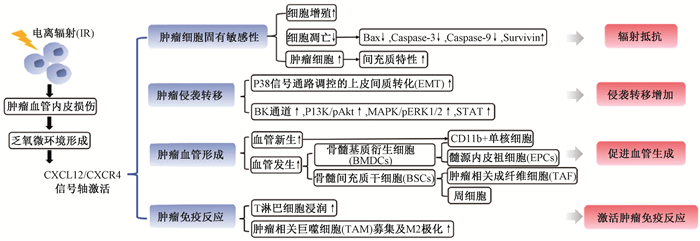
放疗后残存的肿瘤细胞常表现出对治疗的抵抗,并且更易远处转移。涉及的机制包括肿瘤乏氧微环境的形成、肿瘤干细胞特性的表达、肿瘤细胞免疫耐受等,而肿瘤血管的再生常导致肿瘤的快速复发及远处转移[1-2]。近年来,CXCL12/CXCR4信号轴被发现参与了恶性肿瘤对电离辐射抵抗的多种生物学过程[3],主要包括以下几个方面:影响肿瘤细胞固有放射敏感性;参与调节肿瘤侵袭转移过程;促进肿瘤组织血管形成;调控恶性肿瘤免疫反应。本文重点关注并讨论CXCL12/CXCR4信号轴在电离辐射诱导的恶性肿瘤生物学行为改变过程中发挥的作用。
一、CXCL12/CXCR4信号轴参与恶性肿瘤发生发展过程1.CXCL12/CXCR4信号轴调控的信号级联通路:CXCL12/CXCR4信号轴已被证实参与调控了75%以上恶性肿瘤的发生发展过程,包括乳腺癌、肺癌、食管癌、卵巢癌、结肠癌、前列腺癌、肾癌、黑色素瘤、胰腺癌等。主要参与调控恶性肿瘤细胞干性、细胞增殖、细胞存活、细胞侵袭转移、血管形成以及免疫调节等生物学过程。
肿瘤基质细胞及肿瘤细胞分泌的CXCL12蛋白,结合于CXCR4的羧基末端,细胞内受体耦联的异源三聚体G蛋白构象发生改变,激活一系列信号级联通路:①PLCβ-IP3/DAG-PKC信号通路:G蛋白解离后的Gαq亚基激活磷脂酶Cβ(PLCβ),将磷脂酰肌醇4, 5-双磷酸酯(PIP2)水解为两个第二信使:二酰基甘油(DAG)、肌醇-1, 4, 5-三磷酸酯(IP3),IP3促进内质网中钙离子(Ca2+)释放到细胞质中,DAG与Ca2+协同活化蛋白激酶C(PKC),磷酸化其他蛋白上丝氨酸和苏氨酸残基的羟基,并调节这些蛋白的功能。②RAS-Raf-MEK1/2-ERK1/2信号通路:Gαi亚基介导RAS的活化,触发Raf-MEK1/2-ERK1/2信号转导途径的激活。磷酸化的ERK1/2可以激活各种转录因子,如c-myc、c-fos、c-jun、ATF、NF-κB和AP-1。此外,Gαi亚基还激活Rac /Rho通路,诱导P38蛋白磷酸化激活。③PI3K-pAKT-mTOR/IκBk/FOXO1/FAK信号通路:解离的Gβ/Gγ二聚体的直接结合介导了磷酸肌醇3-激酶(PI3K)的激活,导致AKT的磷酸化激活,进而调控下游分子包括mTOR、IκBk、FOXO1、FAK。④JAK-STATs信号通路:与受体耦联的酪氨酸激酶JAK通过交互的酪氨酸磷酸化作用活化,并磷酸化受体上的酪氨酸残基,为具有SH2结构域的蛋白质创建结合位点,STAT与受体结合后被JAK酪氨酸磷酸化,从而导致STAT被激活并与受体解离,作为转录因子转运至细胞核内,与靶基因启动子结合,调控基因转录[4]。
以上这些CXCL12/CXCR4信号轴下游信号级联通路的激活,可以通过活化各类转录因子,进一步促进与恶性肿瘤干细胞特性、细胞增殖、细胞凋亡、侵袭转移、血管形成、免疫调节等相关的基因转录翻译增加,促进恶性肿瘤的发生发展。
2.CXCL12/CXCR4信号轴对肿瘤干细胞特性的影响:CXCL12/CXCR4信号轴在机体造血干细胞动员及归巢,神经元祖细胞分化形成神经元前体细胞、组织定向干细胞迁移至损伤部位,以及骨髓间充质干细胞募集等生理病理过程中发挥重要作用。因此,CXCL12/CXCR4信号轴在维持机体内干细胞功能方面具有重要作用。
近期的一项大规模多态性分析结果显示,对比了3 684例恶性肿瘤患者和5 114例健康人群,CXCR4 rs2228014位点基因多态性预示恶性肿瘤发生风险增加[5]。恶性肿瘤起源的克隆进化学说和肿瘤干细胞学说认为,恶性肿瘤的发生主要是由于基因组不稳定性以及小部分具有自我更新及多向分化能力的永生化细胞群体的产生。CXCR4下游信号级联通路一方面可以延长正常干细胞的寿命,另一方面,又可将DNA损伤突变传递给干细胞,诱导这些干细胞发展成为肿瘤干细胞,促进肿瘤发生发展。肿瘤干细胞(cancer stem cells, CSCs)是一类具有更新及多向分化潜能并可以产生异质性肿瘤的细胞群体。在包括胶质母细胞瘤干细胞、食管癌干细胞、胰腺癌干细胞、骨肉瘤干细胞等在内的多种恶性肿瘤干细胞中,研究者们已证实CXCL12/CXCR4信号轴可以通过激活下游信号级联通路,包括ERK1/2、AKT、mTOR等,影响肿瘤干细胞的趋化迁移、细胞增殖、细胞存活、治疗抵抗等生物学行为,CXCL12/CXCR4信号轴是维持肿瘤细胞干性以及自我更新能力所必须的[3, 6-7]。
3.CXCL12/CXCR4信号轴参与了肿瘤血管形成过程:血管形成主要包括血管新生(angiogenesis)及血管发生(vasculogenesis)两种方式,而血管发生是恶性肿瘤血管形成的主要方式。肿瘤乏氧微环境中,乏氧诱导因子-1α (hypoxia-inducible factor-1α, HIF-1α)在肿瘤细胞中积聚,调控CXCL12表达增加,可以作为趋化因子,诱导高表达CXCR4的骨髓基质衍生细胞(bone marrow-derived cells, BMSCs)与骨髓间充质干细胞(mesenchymal stem cells, MSCs)的归巢,以及分化形成内皮祖细胞和周细胞,最终促进肿瘤组织中新生血管的形成。CXCL12/CXCR4调控的肿瘤血管形成已在多种荷瘤小鼠模型中得到证实。
4.CXCL12/CXCR4信号轴促进恶性肿瘤侵袭转移:既往大量研究已经证实,CXCL12/CXCR4信号轴的激活可以增加恶性肿瘤细胞侵袭迁移能力,有助于恶性肿瘤远处转移。CXCR4高表达于多种肿瘤组织,而易发生恶性肿瘤转移的正常组织如骨髓、肺和肝脏中,均高表达CXCL12[8]。CXCL12可以通过其趋化作用,诱导恶性肿瘤细胞向高浓度梯度的部位迁移,CXCL12/CXCR4信号轴则可以通过激活其下游信号级联反应[9],例如激活PI3K/pAKT、MAPK/pERK1/2、Wnt/β-Catenin、NF-κB等信号传导通路,诱导肿瘤细胞发生上皮间质转化(EMT),调节肌动蛋白合成与重排使肿瘤细胞形成伪足,导致运动能力增加,同时释放基质金属蛋白酶等破坏细胞外基质,调控黏附分子表达进而减少肿瘤细胞间的黏附作用,诱导肿瘤细胞穿过内皮细胞,最终使恶性肿瘤细胞向具有高CXCL12浓度梯度的远处器官组织转移。
5.CXCL12/CXCR4信号轴调节肿瘤免疫反应:CXCL12/CXCR4信号轴可以通过诱导T细胞,B细胞和NK细胞的分化及成熟,参与机体免疫系统的构成,在炎症发生和免疫反应中起重要作用。阻断CXCL12/CXCR4信号轴可以导致炎症性疾病,自身免疫性疾病和癌症的发生[10]。
CXCR4拮抗剂BL-8040能够有效地动员多能造血干细胞,同时增加CD4+和CD8+T细胞、NKTs、NKs和DCs的数量,表现出迅速的免疫重建潜力,以及更好的抗肿瘤疗效[11]。此外,BL-8040还可以选择性地减少肿瘤组织中免疫抑制性T细胞(Tregs)的募集,最终增加抗肿瘤免疫应答[12]。CXCR4抑制剂AMD3100可显著调节NK细胞亚群从骨髓向血液和脾脏迁移以促进其进一步成熟[13]。联合免疫治疗和抗CXCR4治疗,可以诱导对化疗耐药的卵巢癌细胞的凋亡,并通过DCs的吞噬作用有效诱导抗肿瘤免疫应答,主要表现为抗肿瘤CD8+T细胞浸润增加,以及Tregs的减少[14]。
二、电离辐射通过CXCL12/CXCR4信号轴调控的恶性肿瘤生物学行为1.CXCL12/CXCR4信号轴增加肿瘤细胞固有放射敏感性:CXCL12/CXCR4信号轴的激活会导致恶性肿瘤的固有放射敏感性降低,表现为对辐射抵抗[15]。近来研究者普遍认为,肿瘤之所以对治疗抵抗,是因为肿瘤干细胞的存在,这类细胞群体在电离辐射照射后不仅可以存活,而且可以形成不同分化程度的肿瘤,并具有无限增殖的能力,是导致肿瘤放疗失败及复发的根源[2]。
研究表明,头颈部鳞状细胞癌患者肿瘤组织中CXCL12和CXCR4的过表达,预示放疗后局部区域控制率及总体存活率较差[16];阻断CXCL12/CXCR4信号轴可以有效降低大鼠原位脑肿瘤接受放疗后的肿瘤复发率[17]。脑室下区释放的CXCL12蛋白,可以增加胶质母细胞瘤干细胞(glioblastoma stem cells, GSCs)的间充质性状,导致辐射抵抗,阻断CXCL12/CXCR4信号轴可以增加GSCs的放射敏感性[18]。结直肠癌细胞中外源性加入CXCL12蛋白,可以抑制电离辐射诱导的Bax、Caspase-3和Caspase-9等细胞凋亡相关蛋白的表达,逆转肿瘤细胞活力的丧失及细胞死亡。而下调CXCR4表达可以降低凋亡抑制蛋白survivin的表达量,最终增加结直肠癌细胞的放射敏感性[19]。CXCL12/CXCR4信号轴特异性抑制剂AMD3100可以通过促进细胞凋亡,减少细胞增殖能力,增加三阴性乳腺癌MDA-MB-231细胞的放射敏感性[20];阻断CXCL12/CXCR4信号轴,可以逆转肿瘤微环境相关的前列腺癌细胞辐射抵抗,诱导肿瘤细胞死亡[21]。
2.电离辐射通过激活CXCL12/CXCR4信号轴促进恶性肿瘤转移:电离辐射杀灭肿瘤的同时,也可诱导残存肿瘤细胞侵袭力增加。研究者们分别在胶质瘤、黑色素瘤、乳腺癌、胰腺癌、大肠癌、食管癌及非小细胞肺癌细胞株中观察到辐射照射后,细胞侵袭迁移能力的增加,并检测到肿瘤细胞分泌的基质金属蛋白酶(matrix metalloproteinase, MMP)明显增加[22]。
临床组织病理学研究发现,放疗后残留的宫颈癌肿瘤组织中高表达的CXCL12是预后不良的独立危险因素[23];在细胞水平,CXCL12/CXCR4信号轴还参与了电离辐射诱导的宫颈癌、胰腺癌、胶质母细胞瘤、非小细胞肺癌的侵袭迁移的过程,干扰RNA或者特异性抑制剂AMD3100可以逆转电离辐射诱导的促恶性肿瘤转移现象[9, 24-26]。其中涉及的机制可能与上皮间质转化以及CXCL12/CXCR4信号轴调控的下游信号转导通路有关。
既往研究表明,CXCL12/CXCR4信号轴可以通过P38信号通路,介导胰腺癌细胞发生EMT及侵袭迁移力增加[27];活化Ca2+激活的K+通道(BK通道),最终导致胶质母细胞瘤细胞的迁移和脑浸润增加[28];活化PI3K/pAkt和MAPK/pERK1/2等信号级联反应,上调非小细胞肺癌细胞中基质金属蛋白酶的表达[9]。发生放射性损伤的肺上皮细胞分泌CXCL12蛋白,激活多条CXCR4下游信号转导通路,包括ERK、Akt和STAT,增加三阴性乳腺癌细胞的存活和肺转移[29]。
3.CXCL12/CXCR4信号轴参与电离辐射诱导的肿瘤血管形成:研究表明,电离辐射具有促进多种肿瘤组织血管形成的作用[30-32]。主要包括以下几个过程:①电离辐射导致肿瘤血管内皮细胞损伤。②肿瘤组织乏氧微环境形成,乏氧诱导因子-1α在肿瘤细胞质中聚集。③CXCL12/CXCR4信号轴激活。④募集骨髓基质衍生细胞(bone marrow-derived cells, BMSCs)、骨髓间充质干细胞(mesenchymal stem cells, MSCs)分化。BMSCs以及MSCs在形成肿瘤新生血管的过程中扮演重要的角色,通过阻断CXCL12/CXCR4信号轴来抑制血管形成可以增加肿瘤放疗疗效,降低放疗后肿瘤的复发概率。
(1) 骨髓基质衍生细胞(BMSCs)募集:BMDCs主要包括骨髓源性内皮祖细胞(endothelial progenitor cells, EPCs)和“血管调节/辅助”骨髓单核细胞(CD11b+)。BMDCs的募集在肿瘤血管形成过程中发挥至关重要的作用。EPCs主要通过血管发生参与肿瘤血管形成,而CD11b+单核细胞则主要通过旁分泌方式诱导血管新生[30, 33]。
电离辐射照射小鼠前列腺癌TRAMP-C1细胞,可以通过CXCL12/CXCR4信号轴募集BMDCs向肿瘤部位迁移,促进肿瘤血管发生[34]。肺癌和乳腺癌动物模型中,局部照射后上调的CXCL12可以快速募集髓样BMDCs(主要是巨噬细胞),显著增加的髓样BMDCs浸润促进了内皮细胞的增殖和肿瘤再生[31]。内皮细胞在受到缺氧刺激后,CXCL12分泌增加,细胞膜表面高表达CXCR4的髓源EPCs可以被募集到具有高浓度CXCL12的肿瘤位置,以进一步刺激血管发生。Lerman等[35]证实了电离辐射可以通过激活HIF-1α上调内皮细胞中的CXCL12表达,刺激内皮细胞迁移,以加速新血管形成。
(2) 骨髓间充质干细胞(MSCs)分化:肿瘤组织在受到包括电离辐射在内的损伤刺激情况下,可以通过释放化学信号及趋化因子募集MSCs至损伤部位,进一步分化成为肿瘤相关成纤维细胞[17],或肿瘤相关肌成纤维细胞,并分泌多种生长因子、趋化因子、细胞因子及细胞外基质等重塑肿瘤微环境。分泌高水平的CXCL12,一方面可以募集EPCs进入肿瘤组织,促进肿瘤血管发生;另一方面,直接作用于肿瘤细胞表面CXCR4,促进肿瘤生长。
在Lewis肺癌和恶性黑素瘤小鼠模型中,放疗可以促进肿瘤细胞释放CXCL12,与循环MSCs表面的CXCR4结合,诱导MSCs分化为肿瘤血管周围的周细胞,促进肿瘤血管发生。AMD3100可以靶向抑制MSCs表面CXCR4的表达,抑制MSCs归巢,减少血管发生[36]。
|
图 1 电离辐射通过激活CXCL12/CXCR4信号轴调控肿瘤生物学行为的模式图 Figure 1 The pattern diagram of ionizing radiation-regulated tumor biological behavior through the activation of CXCL12/CXCR4 signal axis |
4.CXCL12/CXCR4信号轴参与电离辐射调节的肿瘤免疫反应:电离辐射不仅可以引起机体炎症反应,也可以调节对肿瘤的免疫反应。对肿瘤进行局部放疗,有利于诱导分子免疫原性细胞死亡,释放肿瘤相关抗原,诱导主要组织相容性复合物(major histocompatibility complex-I, MHC-I)等细胞表面分子高表达,促进树突状细胞抗原提呈作用,有利于肿瘤免疫识别和T细胞浸润,增强特异性抗肿瘤T细胞免疫反应[37]。
放疗还可以通过激活趋化因子信号通路,介导效应T细胞募集至肿瘤,促进T细胞识别及杀伤肿瘤细胞[38]。而放疗的远隔效应则是将肿瘤释放的特异性抗原转变成个体化的疫苗,通过体液循环系统传递至远处未受照射的肿瘤组织,诱发远位的抗肿瘤免疫效应。
利用放射性示踪剂标记的活化T淋巴细胞进行正电子发射断层扫描成像,在接受放疗的肿瘤组织中观察到10倍高的放射性示踪剂摄取。抑制CXCL12/CXCR4信号轴可以明显减少2.8倍的摄取,表明电离辐射诱导的肿瘤组织活化T淋巴细胞浸润主要依赖于CXCR4的表达[39]。在辐射抵抗的肿瘤内皮细胞中,高表达的CXCR4有助于CXCL12+肿瘤相关巨噬细胞(tumor-associated macrophages, TAMs)募集和M2极化。靶向CXCL12+ M2 TAMs治疗可以通过诱导抗肿瘤免疫反应来进一步增加放疗效果[40]。因此,CXCL12/CXCR4信号轴在电离辐射诱导的免疫应答中可能发挥关键作用,具体作用及潜在机制目前尚未明确,值得进一步深入研究。
三、结语CXCL12/CXCR4信号轴在电离辐射诱导的一系列恶性肿瘤生物学行为中发挥了关键的调节作用,CXCL12/CXCR4信号轴的活化可以导致肿瘤对辐射抵抗、发生远处转移,促进肿瘤血管生成,以及调节肿瘤免疫反应等。阻断CXCL12/CXCR4信号轴具有减少恶性肿瘤远处转移、增加肿瘤细胞放射敏感性、抑制肿瘤组织新生血管的形成,以及调控机体抗肿瘤免疫反应的潜能。其中可能涉及的机制包括肿瘤乏氧微环境的形成、肿瘤干细胞的活化、上皮间质转化、骨髓基质衍生细胞募集、骨髓间充质干细胞分化,以及免疫细胞的浸润等,这些潜在机制均是目前肿瘤放射生物学领域研究的热点问题。
综上所述,进一步探索CXCL12/CXCR4信号轴在肿瘤放射生物学领域的具体作用及机制,可以为临床通过靶向CXCL12/CXCR4信号轴联合放疗提高恶性肿瘤治疗疗效提供理论依据和新的发展方向。
利益冲突 无
作者贡献声明 谷庆负责文献检索及论文撰写;嵇建峰协助文献检索及整理;郑晓提出构思及指导修改
| [1] |
Jarosz-Biej M, Smolarczyk R, Cichoń T, et al. Tumor microenvironment as a "Game Changer" in cancer radiotherapy[J]. Int J Mol Sci, 2019, 20(13): 3212. DOI:10.3390/ijms20133212 |
| [2] |
Schulz A, Meyer F, Dubrovska A, et al. Cancer stem cells and radioresistance:DNA repair and beyond[J]. Cancers (Basel), 2019, 11(6): E862. DOI:10.3390/cancers11060862 |
| [3] |
Eckert F, Schilbach K, Klumpp L, et al. Potential role of CXCR4 targeting in the context of radiotherapy and immunotherapy of cancer[J]. Front Immunol, 2018, 9: 3018. DOI:10.3389/fimmu.2018.03018 |
| [4] |
Cojoc M, Peitzsch C, Trautmann F, et al. Emerging targets in cancer management:role of the CXCL12/CXCR4 axis[J]. Oncol Targets Ther, 2013, 6: 1347-1361. DOI:10.2147/OTT.S36109 |
| [5] |
Wu Y, Zhang C, Xu W, et al. CXC motif chemokine receptor 4 gene polymorphism and cancer risk[J]. Medicine (Baltimore), 2016, 95(49): e5317. DOI:10.1097/MD.0000000000005317 |
| [6] |
Trautmann F, Cojoc M, Kurth I, et al. CXCR4 as biomarker for radioresistant cancer stem cells[J]. Int J Radiat Biol, 2014, 90(8): 687-699. DOI:10.3109/09553002.2014.906766 |
| [7] |
Tian Y, Song Y, Bai W, et al. CXCR4 knockdown inhibits the growth and invasion of nasopharyngeal cancer stem cells[J]. Oncol Lett, 2017, 13(4): 2253-2259. DOI:10.3892/ol.2017.5694 |
| [8] |
Zhou Y, Cao HB, Li WJ, et al. The CXCL12(SDF-1)/CXCR4 chemokine axis:Oncogenic properties, molecular targeting, and synthetic and natural product CXCR4 inhibitors for cancer therapy[J]. Chin J Nat Med, 2018, 16(11): 801-810. DOI:10.1016/S1875-5364(18)30122-5 |
| [9] |
Gu Q, He Y, Ji J, et al. Hypoxia-inducible factor 1α(HIF-1α) and reactive oxygen species (ROS) mediates radiation-induced invasiveness through the SDF-1α/CXCR4 pathway in non-small cell lung carcinoma cells[J]. Oncotarget, 2015, 6(13): 10893-10907. DOI:10.18632/oncotarget.3535 |
| [10] |
Nagasawa T, Hirota S, Tachibana K, et al. Defects of B-cell lymphopoiesis and bone-marrow myelopoiesis in mice lacking the CXC chemokine PBSF/SDF-1[J]. Nature, 1996, 382(6592): 635-638. DOI:10.1038/382635a0 |
| [11] |
Abraham M, Pereg Y, Bulvik B, et al. Single dose of the CXCR4 antagonist BL-8040 induces rapid mobilization for the collection of human CD34+cells in healthy volunteers[J]. Clin Cancer Res, 2017, 23(22): 6790-6801. DOI:10.1158/1078-0432.CCR-16-2919 |
| [12] |
Gaur P, Verma V, Gupta S, et al. CXCR4 antagonist (BL-8040) to enhance antitumor effects by increasing tumor infiltration of antigen-specific effector T-cells[J]. J Clin Oncol, 2018, 36(5 Suppl): 73-73. DOI:10.1200/JCO.2018.36.5_suppl.73 |
| [13] |
Wong P, Kariminia A, Jones D, et al. Plerixafor effectively mobilizes CD56bright NK cells in blood, providing an allograft predicted to protect against GVHD[J]. Blood, 2018, 131(25): 2863-2866. DOI:10.1182/blood-2018-03-836700 |
| [14] |
Komorowski MP, McGray AR, Kolakowska A, et al. Reprogramming antitumor immunity against chemoresistant ovarian cancer by a CXCR4 antagonist-armed viral oncotherapy[J]. Mol Ther Oncolytics, 2016, 3: 16034. DOI:10.1038/mto.2016.34 |
| [15] |
Trautmann F, Cojoc M, Kurth I, et al. CXCR4 as biomarker for radioresistant cancer stem cells[J]. Int J Radiat Biol, 2014, 90(8): 687-699. DOI:10.3109/09553002.2014.906766 |
| [16] |
De-Colle C, Menegakis A, Mönnich D, et al. SDF-1/CXCR4 expression is an independent negative prognostic biomarker in patients with head and neck cancer after primary radiochemotherapy[J]. Radiother Oncol, 2018, 126(1): 125-131. DOI:10.1016/j.radonc.2017.10.008 |
| [17] |
Liu SC, Alomran R, Chernikova SB, et al. Blockade of SDF-1 after irradiation inhibits tumor recurrences of autochthonous brain tumors in rats[J]. Neuro Oncol, 2014, 16(1): 21-28. DOI:10.1093/neuonc/not149 |
| [18] |
Goffart N, Lombard A, Lallemand F, et al. CXCL12 mediates glioblastoma resistance to radiotherapy in the subventricular zone[J]. Neuro Oncol, 2017, 19(1): 66-77. DOI:10.1093/neuonc/now136 |
| [19] |
Wang D, Jiao C, Zhu Y, et al. Activation of CXCL12/CXCR4 renders colorectal cancer cells less sensitive to radiotherapy via up-regulating the expression of survivin[J]. Exp Biol Med (Maywood), 2017, 242(4): 429-435. DOI:10.1177/1535370216675068 |
| [20] |
Zhou KX, Xie LH, Peng X, et al. CXCR4 antagonist AMD3100 enhances the response of MDA-MB-231 triple-negative breast cancer cells to ionizing radiation[J]. Cancer Lett, 2018, 418: 196-203. DOI:10.1016/j.canlet.2018.01.009 |
| [21] |
Domanska UM, Boer JC, Timmer-Bosscha H, et al. CXCR4 inhibition enhances radiosensitivity, while inducing cancer cell mobilization in a prostate cancer mouse model[J]. Clin Exp Metastasis, 2014, 31(7): 829-839. DOI:10.1007/s10585-014-9673-2 |
| [22] |
Blyth BJ, Cole AJ, MacManus MP, et al. Radiation therapy-induced metastasis:radiobiology and clinical implications[J]. Clin Exp Metastasis, 2018, 35(4): 223-236. DOI:10.1007/s10585-017-9867-5 |
| [23] |
Fu Z, Zhang P, Luo H, et al. CXCL12 modulates the radiosensitivity of cervical cancer by regulating CD44[J]. Mol Med Rep, 2018, 18(6): 5101-5108. DOI:10.3892/mmr.2018.9554 |
| [24] |
Lecavalier-Barsoum M, Chaudary N, Han K, et al. Targeting the CXCL12/CXCR4 pathway and myeloid cells to improve radiation treatment of locally advanced cervical cancer[J]. Int J Cancer, 2018, 143(5): 1017-1028. DOI:10.1002/ijc.31297 |
| [25] |
Yadav VN, Zamler D, Baker GJ, et al. CXCR4 increases in-vivo glioma perivascular invasion, and reduces radiation induced apoptosis:A genetic knockdown study[J]. Oncotarget, 2016, 7(50): 83701-83719. DOI:10.18632/oncotarget.13295 |
| [26] |
Aravindan S, Ramraj S, Kandasamy K, et al. Hormophysa triquerta polyphenol, an elixir that deters CXCR4-and COX2-dependent dissemination destiny of treatment-resistant pancreatic cancer cells[J]. Oncotarget, 2017, 8(4): 5717-5734. DOI:10.18632/oncotarget.13900 |
| [27] |
Li D, Qu C, Ning Z, et al. Radiation promotes epithelial-to-mesenchymal transition and invasion of pancreatic cancer cell by activating carcinoma-associated fibroblasts[J]. Am J Cancer Res, 2016, 6(10): 2192-2206. |
| [28] |
Edalat L, Stegen B, Klumpp L, et al. BK K+channel blockade inhibits radiation-induced migration/brain infiltration of glioblastoma cells[J]. Oncotarget, 2016, 7(12): 14259-14278. DOI:10.18632/oncotarget.7423 |
| [29] |
Feys L, Descamps B, Vanhove C, et al. Radiation-induced lung damage promotes breast cancer lung-metastasis through CXCR4 signaling[J]. Oncotarget, 2015, 6(29): 26615-26632. DOI:10.18632/oncotarget.5666 |
| [30] |
Kioi M, Vogel H, Schultz G, et al. Inhibition of vasculogenesis, but not angiogenesis, prevents the recurrence of glioblastoma after irradiation in mice[J]. J Clin Invest, 2010, 120(3): 694-705. DOI:10.1172/JCI40283 |
| [31] |
Kozin SV, Kamoun WS, Huang Y, et al. Recruitment of myeloid but not endothelial precursor cells facilitates tumor regrowth after local irradiation[J]. Cancer Res, 2010, 70(14): 5679-5685. DOI:10.1158/0008-5472.Can-09-4446 |
| [32] |
Marques FG, Poli E, Rino J, et al. Low doses of ionizing radiation enhance the angiogenic potential of adipocyte conditioned medium[J]. Radiat Res, 2019, 192(5): 517-526. DOI:10.1667/RR15438.1 |
| [33] |
Ceradini DJ, Kulkarni AR, Callaghan MJ, et al. Progenitor cell trafficking is regulated by hypoxic gradients through HIF-1 induction of SDF-1[J]. Nat Med, 2004, 10(8): 858-864. DOI:10.1038/nm1075 |
| [34] |
Chen FH, Fu SY, Yang YC, et al. Combination of vessel-targeting agents and fractionated radiation therapy:the role of the SDF-1/CXCR4 pathway[J]. Int J Radiat Oncol Biol Phys, 2013, 86(4): 777-784. DOI:10.1016/j.ijrobp.2013.02.036 |
| [35] |
Lerman OZ, Greives MR, Singh SP, et al. Low-dose radiation augments vasculogenesis signaling through HIF-1-dependent and-independent SDF-1 induction[J]. Blood, 2010, 116(18): 3669-3676. DOI:10.1182/blood-2009-03-213629 |
| [36] |
Wang HH, Cui YL, Zaorsky NG, et al. Mesenchymal stem cells generate pericytes to promote tumor recurrence via vasculogenesis after stereotactic body radiation therapy[J]. Cancer Lett, 2016, 375(2): 349-359. DOI:10.1016/j.canlet.2016.02.033 |
| [37] |
Frey B, Rückert M, Deloch L, et al. Immunomodulation by ionizing radiation-impact for design of radio-immunotherapies and for treatment of inflammatory diseases[J]. Immunol Rev, 2017, 280(1): 231-248. DOI:10.1111/imr.12572 |
| [38] |
Goto T. Radiation as an in situ auto-vaccination:current perspectives and challenges[J]. Vaccines (Basel), 2019, 7(3). DOI:10.3390/vaccines7030100 |
| [39] |
Hartimath SV, Khayum MA, van Waarde A, et al. N-[11C]Methyl-AMD3465 PET as a tool for in vivo measurement of chemokine receptor 4(CXCR4) occupancy by therapeutic drugs[J]. Mol Imaging Biol, 2017, 19(4): 570-577. DOI:10.1007/s11307-016-1028-8 |
| [40] |
Choi SH, Kim AR, Nam JK, et al. Tumour-vasculature development via endothelial-to-mesenchymal transition after radiotherapy controls CD44v6+cancer cell and macrophage polarization[J]. Nat Commun, 2018, 9(1): 5108. DOI:10.1038/s41467-018-07470-w |
 2019, Vol. 39
2019, Vol. 39


