2. 山东第一医科大学 山东省医学科学院 山东省肿瘤防治研究院 山东省肿瘤医院放射物理技术科, 济南 250117;
3. 武汉大学物理科学与技术学院 430072
2. Department of Radiation Oncology Physics, Shandong Cancer Hospital and Institute, Shandong First Medical University and Shandong Academy of Medical Sciences, Jinan 250117, China;
3. School of Physics and Technology, Wuhan University, Wuhan 430072, China
近年来,调强放疗(IMRT)已成为乳腺癌患者综合治疗的重要组成部分[1-2]。目前,乳腺癌术后放疗靶区范围主要包括锁骨上淋巴结引流区加胸壁[3-5],靶区及危及器官剂量评估需谨慎。在乳腺癌放疗过程中,呼吸、靶区缩退、心脏跳动以及体重减轻等因素均会造成靶区及正常组织的形态和位置发生变化,使实际照射量评估准确性下降[6]。因此,理论上若继续用初次计划评估靶区及正常组织受量,可能会导致计划剂量与实际照射剂量存在较大误差。本研究基于形变配准技术将乳腺癌两次计划中的剂量进行刚性、形变两种方法的累加,再评估靶区及心脏、双肺等正常组织的剂量-体积指标,并与初始调强计划进行比较,旨在量化根治术后乳腺癌靶区包括胸壁及锁骨上淋巴结的患者在IMRT靶区及危及器官剂量-体积指标的变化情况。
资料与方法1.一般资料:回顾分析山东省肿瘤医院2016年9月至2018年7月16例女性根治术后左侧乳腺癌患者,靶区范围包括锁骨上淋巴结引流区加胸壁,年龄27~66岁,中位年龄42.5岁。
2.图像获取及计划设计:患者均采取仰卧位,乳腺托架固定,双臂上举外展以充分暴露左乳。采用Philips大孔径模拟定位机(荷兰飞利浦公司)进行定位扫描,扫描范围由环甲膜至肺底,获得定位CT(CT1)。将CT1传入Varian Eclipse 13.5(美国瓦里安公司),由医师勾画全乳临床靶区CTV1,CTV1外扩得到PTV1,危及器官勾画包括心脏、双肺,所有勾画均由同一医师完成。利用Eclipse进行IMRT计划设计。放疗计划均采用6 MV X射线照射。全程均以CTV1进行50 Gy/25次放疗计划为Plan1。以CT1放射治疗30~36 Gy/15~18次后进行二程CT定位扫描,得到CT2。医师根据CT2勾画CTV2、PTV2及危及器官。两次定位方式及靶区勾画标准保持一致。二程计划剂量根据初次计划剂量均行至50 Gy/25次。全程均以CTV2进行50 Gy/25次放疗计划为Plan2。
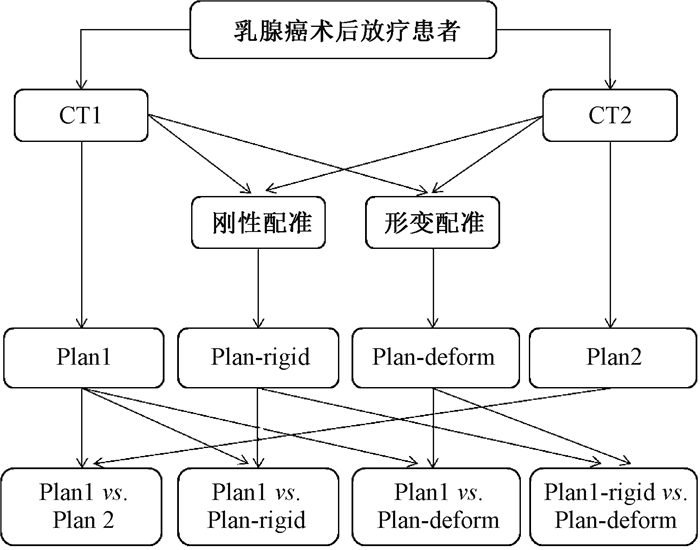
3.刚性、形变配准及剂量累加:将CT1设置为参考图像,CT2设置为目标图像,利用Varian Velocity 3.2.1软件(美国瓦里安公司)将CT2图像分别进行刚性、形变配准到CT1图像上,得到CT-rigid和CT-deform根据配准图像形变点审核、向量审核生成的向量场,将Plan2剂量刚性、形变配准到Plan1上,并与Plan1剂量加权累加后得到Plan-rigid和Plan-deform。流程见图 1。
|
图 1 患者形变配准流程图 Figure 1 Schematic of the patient deformation registration process |
4.数据指标:①靶区及危及器官体积:计算CTV、PTV、心脏和双肺体积变化率。②靶区及危及器官剂量-体积指标:记录靶区D2、D95、Dmean及PTV受照剂量>95%的体积(记为VPTV95%);心脏V20、V30、V40及Dmean;左肺V5、V10、V13、V15、V20及V30;右肺V5、V10、V13及V15。③戴斯相似系数(Dice similarity coefficient,DSC):计算形变前CTV、PTV、心脏及双肺DSC=2|A∩B|/(|A|+|B|),A为CT1靶区及危及器官体积,B为CT2靶区及危及器官体积, 形变后靶区及器官DSC的计算公式与前述相同。④均匀性指数(HI):计算靶区剂量HI=(D2-D98)/Dmean。⑤适形指数(CI):计算靶区剂量CI=(VPTV95%/ VT) × (VPTV95% / VPTV),VT为CTV体积,VPTV为PTV体积。
5.统计学处理:采用SPSS 19.0软件对数据进行统计分析。计量数据经正态性检验符合正态分布,数据以x±s表示。方差齐性检验后,应用单因素方差分析比较靶区及危及器官的体积在不同CT图像上的差异;采用Wilcoxon秩和检验对每两组计划之间的危及器官体积-指标参数、HI、CI及形变前、后DSC进行分析。P < 0.05为差异有统计学意义。
结果1.不同组别靶区、危及器官体积的比较:通过对CT1、CT2、CT-deform靶区及危及器官体积进行统计分析,CT2与CT1相比,PTV、CTV、心脏、左肺、右肺体积分别减少9.73%、6.64%、2.24%、1.48%、1.66%;CT-deform与CT1相比,PTV、CTV体积分别增加1.63%、2.00%。以上数据差异均无统计学意义(P>0.05, 表 1)。
|
|
表 1 16例患者靶区/危及器官体积变化(cm3,x±s) Table 1 The change of target/organs at risk volume of 16 patients(cm3, x±s) |
2. Plan1、Plan2、Plan-rigid、Plan-deform剂量-体积比较:对于心脏V20、V30、V40和Dmean,左肺V5、V10、V13、V15、V20和V30,右肺V5、V10、V13和V15,Plan2、Plan-rigid、Plan-deform分别与Plan1比较,差异均无统计学意义(P>0.05)。Plan-rigid与Plan-deform相比,心脏和左肺上述指标差异有统计学意义(Z=-2.556~-2.499,P < 0.05),但右肺差异无统计学意义(P> 0.05, 表 2)。
|
|
表 2 16例患者不同计划危及器官剂量-体积指标对比(x±s) Table 2 Comparison of dose-volume indices of organs at risk in different groups of 16 patients(x±s) |
3. Plan1、Plan-rigid与Plan-deform HI、CI的比较:基于刚性配准的剂量-体积参数显示,与Plan1相比,Plan-rigid和Plan-deform的靶区HI差异有统计学意义(Z=-3.517、-3.517,P < 0.05),CI差异有统计学意义(Z=-1.189、-3.517,P < 0.05)。与Plan-rigid比较,Plan-deform的靶区HI和CI差异有统计学意义(Z=-3.051、-2.327,P < 0.05, 表 3)。
|
|
表 3 16例患者不同计划靶区CI、HI比较(x±s) Table 3 Comparison of CI and HI in the target for different Plans of 16 patients(x±s) |
4.计划形变前后靶区和危及器官DSC比较:心脏、左肺及右肺的DSC在形变前后差异有统计学意义(Z=-3.208、-3.533、-3.535,P < 0.05,表 4)。
|
|
表 4 16例患者形变前后戴斯相似系数对比(x±s) Table 4 Dice similarity coefficients predeformation and postdeformation of 16 patients(x±s) |
讨论
IMRT治疗乳腺癌能够保证肿瘤靶区达到处方剂量的同时减少正常组织受量[7-9]。临床资料表明,患侧肺不同剂量的受照体积(V5~ V30)能够较好地预测放射性肺炎的发生概率[10],而心脏的平均受照剂量以及不同受照体积(V30、V40、Dmean等)能够较好地预测放射性心脏损伤的发生概率[11]。因此,准确评估危及器官的剂量,对预测乳腺癌放射损伤至关重要。在乳腺癌患者治疗的中、后期,靶区和周围正常组织的位置、形态、大小发生不同程度的改变,可能会导致靶区剂量不足以及增加正常组织受照剂量,从而影响治疗效果,且增加放射性损伤,因此对肺组织及心脏组织剂量-体积的精确评估至关重要。
本研究是在乳腺癌患者进行15~18分次治疗之后,重新进行CT扫描,重新进行IMRT计划设计,在放射治疗过程中,患者可能会出现体重下降、呼吸状态改变、放疗分次间摆位误差、患者皮肤表面定位标记线模糊不清等影响放疗精度的因素。吴伟伟等[12]对鼻咽癌调强放疗的研究中,发现由于肿瘤退缩、正常组织结构形态及位置发生变化,患者在20次放疗后进行二程调强放疗有剂量学意义。在乳腺癌全乳照射的研究中表明,在二程CT上重新进行计划设计,可以提升肿瘤靶区照射剂量,同时保护正常组织[13-14]。因此,为保证放射治疗精度, 在患者进行15~18分次治疗后,进行CT重新扫描,并进行二次计划。对比形变配准技术将两次计划剂量根据其相应CT图像的形变场分别进行刚性、形变叠加,得到Plan-rigid及Plan-deform。通过Plan-rigid、Plan-deform分别与Plan1比较发现,由于CTV、PTV、心脏以及双肺体积变化均较小,特别是CTV体积变化仅 < 10%,并且数据结果表明形变配准后所有危及器官各项剂量-体积指标基本与Plan1组保持一致,差异均无统计学意义。
本研究中利用的形变配准软件Varian Velocity是一款应用于临床的商业形变配准软件(deformable image registration,DIR),图像导入Velocity进行形变配准是基于Mattes公式的相互信息度量,并且采用改进的b样条计算算法对变形进行建模,b样条算法是利用有限内存的Broyden-Fletcher-Goldfarb-Shanno优化器寻找最优节点值,以迭代次数最多100次、修正次数最多20次作为优化算法的终止条件[15]。Moriya等[15]对3种形变配准软件对比分析发现,Velocity可以在改变剂量分布方面达到满意效果。在对Velocity形变精度评估方面,Palma等[16]的研究证明形变配准精度范围在3~5 mm;Brock[17]的研究表明,形变配准的平均绝对误差 < 2.5 mm;Schreibmann等[18]的研究证明, b样条变形可模拟呼吸在3 mm以内的肺容积变化。Hoffmann等[19]的研究证明, Velocity能够将平均目标配准误差降低到临床可接受的水平。
形变后的心脏、双肺的DSC相比形变前有所下降,差异有统计学意义,并且形变前心脏、双肺的各项剂量-体积指标差异无统计学意义,而形变后心脏、左肺的各项剂量-体积指标差异具有统计学意义,这可能是过度形变造成的,从而导致Plan-rigid、Plan-deform靶区CI均优于Plan1。形变配准会使形变目标产生两方面的改变:体积和形态。在本研究中,对比CT-deform组与CT1组的PTV、CTV心脏及双肺的体积发现,两组中的体积变化都在2%以内,说明形变配准在体积方面较有优势。但因为目标体积形态不规则、边界模糊等因素,双肺、心脏进行形变时,即使体积配准较好,但局部形态可能出现过度形变,从而造成DSC下降。DSC主要考虑的是形态契合度,一般认为DSC>0.7代表很好的一致性[20]。本研究中DSC值均高于0.8。由于本研究为回顾性研究,存在一定的局限性,将在以后的试验中验证这种过度形变的影响,但目前尚没有更好的算法可以解决过度形变的问题,因此, 参照Hoffmann等[19]的研究,认为该算法可以满足临床要求。
一般来说,基于形变配准的剂量累加法可以用来评估整个放疗过程中靶区及危及器官的剂量-体积指标。但是对于治疗过程中体位变化大、靶区受呼吸影响大的患者,会导致两次CT图像轮廓差异非常大,则不适宜用剂量形变累加法评估放疗过程中的靶区及危及器官剂量变化[21]。通过分析16例根治术后左乳癌患者靶区和危及器官的体积及剂量-体积指标变化发现,靶区的体积缩退不明显,但靶区位置受呼吸影响较大,而形变配准后危及器官剂量-体积指标基本与初次计划保持一致,并且在形变配准过程中出现了危及器官的过度形变,导致评价不准确,提示本研究中可利用初次计划对心脏、患侧肺相关剂量-体积指标进行评估。
综上,左乳癌根治术后患者进行放射治疗,因靶区和危及器官体积、形态变化较小,剂量-体积指标变化也较小,形变、刚性配准均可实现两次计划的剂量累加,而形变配准可能存在过度形变的问题,在此类患者靶区和危及器官剂量学累加时,推荐使用刚性配准。靶区和危及器官初次、二次计划疗程中剂量-体积指标变化相对较小,因此,初次计划评估的危及器官的剂量-体积指标可基本反映双肺及心脏的受量情况。当患者肿瘤靶区及体重等因素无明显变化时,可以暂缓或综合考虑多种因素之后进行二次计划。
利益冲突 所有研究者未因进行该研究而接受任何不正当的职务或财务利益,在此对研究生的独立性和科学性予以保证
作者贡献声明 苏铭负责收集和统计数据、结果分析及论文撰写;尹勇负责课题设计及学术建议;巩贯忠和邱小平负责指导论文撰写及修改;任建新、姚鑫森负责参与数据收集及病例选择
| [1] |
Liu H, Chen X, He Z, et al. Evaluation of 3D-CRT, IMRT and VMAT radiotherapy plans for left breast cancer based on clinical dosimetric study[J]. Comput Med Imaging Graph, 2016, 54: 1-5. DOI:10.1016/j.compmedimag.2016.10.001 |
| [2] |
张锋, 张卓, 邹丽娟, 等. 早期三阴乳腺癌改良根治术后放疗及预后相关因素分析[J]. 中华放射医学与防护杂志, 2018, 38(7): 510-516. Zhang F, Zhang Z, Zou LJ, et al. Analysis of the prognostic factors and the value of radiotherapy in the early stage triple-negative breast cancer[J]. Chin J Radiol Med Prot, 2018, 38(7): 510-516. DOI:10.3760/cma.j.issn.0254-5098.2018.07.006 |
| [3] |
Offersen BV, Boersma LJ, Kirkove C, et al. ESTRO consensus guideline on target volume delineation for elective radiation therapy of early stage breast cancer[J]. Radiother Oncol, 2015, 114(1): 3-10. DOI:10.1016/j.radonc.2014.11.030 |
| [4] |
Verhoeven K, Weltens C, Remouchamps V, et al. Vessel based delineation guidelines for the elective lymph node regions in breast cancer radiation therapy-PROCAB guidelines[J]. Radiother Oncol, 2015, 114(1): 11-16. DOI:10.1016/j.radonc.2014.11.008 |
| [5] |
Nielsen MH, Berg M, Pedersen AN, et al. Delineation of target volumes and organs at risk in adjuvant radiotherapy of early breast cancer:national guidelines and contouring atlas by the Danish Breast Cancer Cooperative Group[J]. Acta Oncol, 2013, 52(4): 703-710. DOI:10.3109/0284186X.2013.765064 |
| [6] |
Sonke JJ, Belderbos J. Adaptive radiotherapy for lung cancer[J]. Semin Radiat Oncol, 2010, 20(2): 94-106. DOI:10.1016/j.semradonc.2009.11.003 |
| [7] |
Hennequin C, Barillot I, Azria D, et al. Radiotherapy of breast cancer[J]. Cancer Radiother, 2016, 20(Suppl): S139-146. DOI:10.1016/j.canrad.2016.07.025 |
| [8] |
McGale P, Taylor C, Correa C, et al. Effect of radiotherapy after mastectomy and axillary surgery on 10-year recurrence and 20-year breast cancer mortality:meta-analysis of individual patient data for 8135 women in 22 randomised trials[J]. Lancet, 2014, 383(9935): 2127-2135. DOI:10.1016/S0140-6736(14)60488-8 |
| [9] |
Hijal T, Fournier-Bidoz N, Castro-Pena P, et al. Simultaneous integrated boost in breast conserving treatment of breast cancer:a dosimetric comparison of helical tomotherapy and three-dimensional conformal radiotherapy[J]. Radiother Oncol, 2010, 94(3): 300-306. DOI:10.1016/j.radonc.2009.12.043 |
| [10] |
杨留勤, 武莉萍, 陈利军, 等. 肺癌放疗中V20和V30预测肺急性放射反应分级价值的研究[J]. 中华肿瘤防治杂志, 2008, 15(4): 280-282. Yang LQ, Wu LP, Cheng LJ, et al. Value of V20 and V30 parameters for predicting acute radiation lung toxicity after 3D radiotherapy for lung cancer[J]. Chin J Cancer Prevent Treat, 2008, 15(4): 280-282. DOI:10.3969/j.issn.1673-5269.2008.04.012 |
| [11] |
李芙瑶, 吴友义, 原少斐, 等. 左侧乳腺癌术后逆向调强放疗引起放射性心脏损伤的临床研究[J]. 中国妇幼健康研究, 2016, 27(7): 856-858. Li FY, Wu YY, Yuan SP, et al. Clinical study on radiation-induced heart disease caused by inverse intensity modulated radiotherapy in postoperative left-sided breast cancer patients[J]. Chin J Woman Child Health Res, 2016, 27(7): 856-858. DOI:10.3969/j.issn.1673-5293.2016.07.023 |
| [12] |
吴伟伟, 李韶今, 尹慧, 等. 局部晚期鼻咽癌调强放疗中解剖结构改变及剂量分布变化研究[J]. 中华放射医学与防护杂志, 2017, 37(11): 826-831. Wu WW, Li SJ, Yin H, et al. Anatomical changes and dose distribution deviations of locally advanced nasopharyngeal carcinoma patients during IMRT[J]. Chin J Radiol Med Prot, 2017, 37(11): 826-831. DOI:10.3760/cma.j.issn.0254-5098.2017.11.005 |
| [13] |
Sager O, Dincoglan F, Uysal B, et al. Evaluation of adaptive radiotherapy (ART) by use of replanning the tumor bed boost with repeated computed tomography (CT) simulation after whole breast irradiation (WBI) for breast cancer patients having clinically evident seroma[J]. Jpn J Radiol, 2018, 36(6): 401-406. DOI:10.1007/s11604-018-0735-2 |
| [14] |
Yang Z, Chen J, Xie J, et al. Simultaneous integrated boost in breast conserving radiotherapy:is replanning necessary following tumor bed change?[J]. Technol Cancer Res Treat, 2013, 12(2): 115-122. DOI:10.7785/tcrt.2012.500309 |
| [15] |
Moriya S, Tachibana H, Kitamura N, et al. Dose warping performance in deformable image registration in lung[J]. Phys Med, 2017, 37: 16-23. DOI:10.1016/j.ejmp.2017.03.016 |
| [16] |
Palma DA, van Sörnsen de Koste JR, Verbakel WF, et al. A new approach to quantifying lung damage after stereotactic body radiation therapy[J]. Acta Oncol, 2011, 50(4): 509-517. DOI:10.3109/0284186X.2010.541934 |
| [17] |
Brock KK. Results of a multi-institution deformable registration accuracy study (MIDRAS)[J]. Int J Radiat Oncol Biol Phys, 2010, 76(2): 583-596. DOI:10.1016/j.ijrobp.2009.06.031 |
| [18] |
Schreibmann E, Yang Y, Boyer A, et al. SU-FF-J-21:image interpolation in 4D CT using a B spline deformable registration model[J]. Med Phys, 2005, 32(5): 1537-1550. DOI:10.1118/1.1997567 |
| [19] |
Hoffmann C, Krause S, Stoiber EM, et al. Accuracy quantification of a deformable image registration tool applied in a clinical setting[J]. J Appl Clin Med Phys, 2014, 15(1): 4564. DOI:10.1120/jacmp.v15i1.4564 |
| [20] |
Zijdenbos AP, Dawant BM, Margolin RA, et al. Morphometric analysis of white matter lesions in MR images:method and validation[J]. IEEE Trans Med Imaging, 1994, 13(4): 716-724. DOI:10.1109/42.363096 |
| [21] |
George R, Keall PJ, Kini VR, et al. Quantifying the effect of intrafraction motion during breast IMRT planning and dose delivery[J]. Med Phys, 2003, 30(4): 552-562. DOI:10.1118/1.1543151 |
 2019, Vol. 39
2019, Vol. 39


