2. 郑州大学第一附属医院放射科 450052
2. Department of Radiology, The First Affiliated Hospital of Zhengzhou University, Zhengzhou 450052, China
放射治疗是结直肠癌治疗的主要途径之一,手术切除肿瘤前放射治疗能够延长部分患者生存时间并提高保肛率,手术切除后放射治疗能够预防局部复发,但是由于有些患者在治疗中出现放射抵抗等现象,提高肿瘤的放射敏感性是目前医学工作者关注的热点[1-2]。结直肠肿瘤差异表达基因(CRNDE)是一个能够调控生理和病理过程的lncRNA,其参与染色质表观遗传过程,可以作为一种生物学信号分子发挥生物学功能[3]。CRNDE作为肿瘤促进因子可发挥癌基因的作用,在宫颈癌、胃癌、甲状腺癌等恶性肿瘤高表达,与肿瘤患者预后、临床分期等有关,并且下调CRNDE后的肿瘤细胞增殖能力降低[4-6]。研究表明,CRNDE在结直肠癌组织、癌旁组织中的表达水平依次降低,CRNDE可能是结直肠癌治疗的潜在靶点[7]。目前对于CRNDE在结直肠癌细胞放射敏感性、增殖和凋亡中的作用尚不明确。本实验通过CRNDE shRNA下调结直肠癌细胞中CRNDE的表达水平,探讨CRNDE在结直肠癌放射敏感性的作用和机制,为提高结直肠癌患者生存质量提供思路。
材料与方法1.材料与试剂:结直肠癌HT-29细胞购自美国ATCC公司,细胞培养条件为:37℃,5%CO2培养箱,细胞培养在含有10%胎牛血清(杭州天杭生物科技股份有限公司)的DMEM细胞培养液(北京索莱宝科技有限公司)中。LipofectamineTM 2000试剂盒购自美国Invitrogen公司;四甲基偶氮唑盐(MTT)溶液、二甲基亚砜(DMSO)购自美国Sigma公司;磷酸盐缓冲液(PBS)购自北京索莱宝科技有限公司;CRNDE shRNA和shRNA control由滁州通用生物系统有限公司构建;cDNA合成试剂盒和SYBR Green荧光定量PCR试剂盒均购自大连宝生物工程有限公司;所用引物由上海生工生物工程股份有限公司合成;miR-384 inhibitor、miR-384 mimics、mimics control、inhibitor control由上海吉玛制药技术有限公司合成构建;突变型和野生型荧光素酶报告载体由南京科佰生物科技有限公司构建。
2.实时定量PCR测定CRNDE shRNA转染对CRNDE表达影响:HT-29细胞接种密度为70%时,分别在细胞中转染CRNDE shRNA和shRNA control,命名为sh-CRNDE组和阴性对照(NC)组,转染步骤同转染试剂LipofectamineTM 2000,转染后6 h换液,继续培养48 h,用Realtime PCR方法测定细胞中CRNDE表达变化。步骤如下:按照每106个细胞中添加1 ml的TRIzol裂解试剂,分别提取细胞中的总RNA。用Oligo(dT)反转录合成cDNA,程序为:42℃,60 min;70℃,15 min。得到的cDNA保存在-20℃。PCR引物如下:CRNDE正向5′ CGCCAGATGCGTGAAATGG 3′,反向5′ ACCAGAGGGAGTGAATCCAGA 3′;GAPDH正向5′ AACTTTGGCATTGTGGAAGG 3′,反向5′ ACACATTGGGGGTAGGAACA 3′。用SYBR Green荧光定量PCR试剂盒进行PCR扩增,收集每个反应的Ct值,计算CRNDE表达变化,内参为GAPDH。PCR条件为:95℃ 2 min,94℃ 1 min,55℃ 1 min,72℃ 1 min,共40个循环。
3.照射条件:取转染CRNDE shRNA和shRNA control后的HT-29细胞,分别以8 Gy 6 MV X射线照射,记为照射+sh-CRNDE组和照射组。采用美国Varian 600直线加速器,源靶距100 cm,剂量率3.2 Gy/min。
4. MTT测定CRNDE shRNA和放射对细胞增殖的影响:HT-29细胞接种到96孔板中,分为NC组、sh-CRNDE组、照射组、放射+sh-CRNDE组,分组处理后,继续培养48 h。取出培养板,每个孔中添加10 μl的MTT溶液,37℃继续培养4 h。取出培养板,把孔内的液体吸尽,继续添加150 μl的DMSO溶液,孵育10 min后,放在酶标仪上测定470 nm的吸光度(A)值。
5.流式细胞术测定CRNDE shRNA和放射对细胞凋亡的影响:按照NC组、sh-CRNDE组、照射组、照射+sh-CRNDE组分组处理后继续培养48 h。用胰蛋白酶将细胞收集以后,每组细胞收集106,用提前预冷的PBS将细胞重悬2次。最后添加结合缓冲液400 μl,均匀混合后,加入碘化丙啶(PI)和Annexin V-FITC各5 μl。流式细胞仪检测之前再加入100 μl的结合缓冲液。
6.平板克隆实验测定细胞放射敏感性:取sh-CRNDE组和NC组细胞接种到6孔板,每孔200个细胞,同时添加2.5 ml的细胞培养液,按照上述照射方法以0、2、4、6、8 Gy剂量照射处理以后,放在细胞培养箱中培养14 d。取出培养板,把孔内的液体吸除,用PBS悬浮洗涤2次细胞,姬姆萨染色,观察细胞克隆形成数目,计算细胞存活分数,拟合存活曲线,根据单击多靶模型参数值计算放射增敏比(SER)。
7.靶向预测和双荧光素酶报告系统鉴定:用starbase在线靶基因预测软件发现CRNDE和miR-384有互补结合位点。将CRNDE结合位点突变并构建突变型荧光素酶报告载体(mut),同时构建没有突变的野生型荧光素酶报告载体(wt),将mut、wt分别与miR-384 mimics和mimics control共转染至HT-29细胞中,培养48 h以后,以荧光素酶活性检测试剂盒测定荧光素酶活性。将转染miR-384 mimics和mimics control后的HT-29细胞命名为miR-384组和miR-NC组,转染后48 h,用实时定量PCR检测miR-384表达变化,步骤同上,内参为U6。引物为:miR-384正向5′ TGTTAAATCAGGAATTTTAA 3′,反向5′ TGTTACAGGCATTATGAA 3′;U6正向5′ CTCGCTTCGGCAGCACA 3′,反向5′ AACGCTTCACGAATTTGCGT 3′。
8. miR-384 inhibitor对下调CRNDE shRNA联合照射对细胞增殖与凋亡的影响:用LipofectamineTM 2000将miR-384 inhibitor、CRNDE shRNA以及inhibitor control、CRNDE shRNA分别共转染至HT-29细胞中,以8 Gy剂量照射后继续培养48 h,记为照射+sh-CRNDE+anti-miR-384组、照射+sh-CRNDE+anti-NC组。MTT方法测定细胞增殖变化,流式细胞术测定细胞凋亡,实时定量PCR测定miR-384表达变化,步骤均同上。
9.统计学处理:采用SPSS 21.0统计软件分析数据。计量资料符合正态分布用x±s表示。两组数据间比较采用独立样本t检验;经方差齐性检验,若方差齐性,多组差异比较用单因素方差分析,两组间进一步比较采用LSD-t检验。P < 0.05为差异有统计学意义。
结果1. CRNDE shRNA干扰效果:NC组、sh-CRNDE组细胞中CRNDE水平依次为1.00±0.08、0.42±0.06(t=10.051, P < 0.05)。CRNDE shRNA转染可以明显降低结直肠癌细胞中CRNDE表达水平。
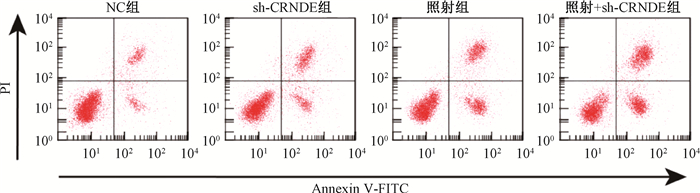
2.照射联合下调CRNDE对结直肠癌细胞增殖和凋亡影响:与NC组比较,sh-CRNDE组、照射组和照射+sh-CRNDE组细胞增殖能力降低(t=7.589、8.050、12.333,P < 0.05),凋亡率升高(t=27.163、26.278、31.984,P < 0.05)。与sh-CRNDE组比较,照射+sh-CRNDE组细胞增殖能力降低(t=10.607,P < 0.05),凋亡率升高(t=9.939,P < 0.05)。与照射组比较,照射+sh-CRNDE组细胞增殖能力降低(t=6.656,P < 0.05),凋亡率升高(t=6.946,P < 0.05)。照射联合下调CRNDE具有协同抗结直肠癌细胞增殖和诱导细胞凋亡的作用。见图 1和表 1。
|
图 1 流式细胞术检测照射联合CRNDE shRNA对结直肠癌细胞凋亡影响 Figure 1 Flow cytometry assay of radiation-induced apoptosis of colorectal cancer cells transfected with CRNDE shRNA |
|
|
表 1 照射联合CRNDE shRNA处理后结直肠癌细胞A值和凋亡率(x±s) Table 1 A values of MTT assay and apoptotic rate of colorectal cancer cells transfected with CRNDE shRNA after irradiation(x±s) |
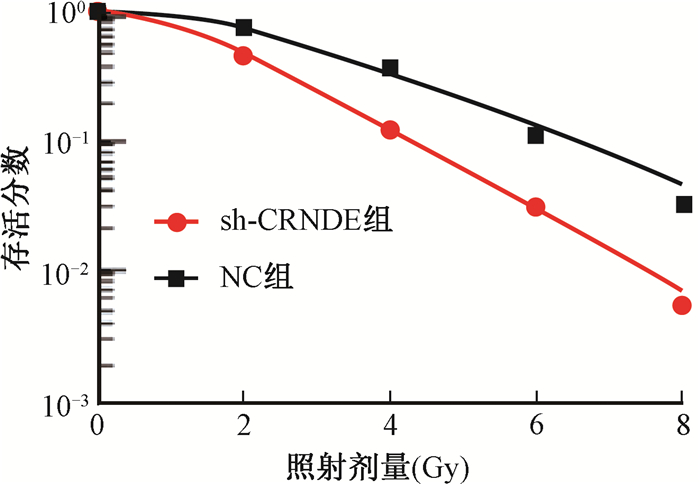
3.下调CRNDE提高结直肠癌细胞放射敏感性:转染CRNDE shRNA后的结直肠癌细胞放射敏感性增加,放射增敏比为1.374,见图 2和表 2。
|
图 2 结直肠癌细胞存活曲线 Figure 2 Survival curve of colorectal cancer cells after irradaition |
|
|
表 2 单击多靶模型参数值 Table 2 The parameter values of cell survival curve stimulated by the single-hit multi-target model |
4. CRNDE靶向负调控miR-384:生物信息学软件分析CRNDE与miR-384有互补结合位点,将CRNDE野生型荧光素酶报告载体和miR-384 mimics共转染后细胞中的荧光素酶活性降低,见图 3和表 3。与miR-NC组比较,共转染WT-CRNDE的miR-384组荧光素酶活性显著降低(t=15.000,P < 0.01);与miR-NC组比较,共转染MUT-CRNDE的miR-384组荧光素酶活性差异无统计学意义(P>0.05)。CRNDE shRNA转染后的结直肠癌细胞中的miR-384表达水平升高,提示CRNDE能够靶向负调控miR-384的表达。

|
图 3 生物信息学软件分析CRNDE与miR-384互补结合位点 Figure 3 The complementary binding sites between CRNDE and miR- 384 analyzed by a bioinformatics software |
|
|
表 3 双荧光素酶活性鉴定(x±s) Table 3 Identification of double luciferase activity(x±s) |
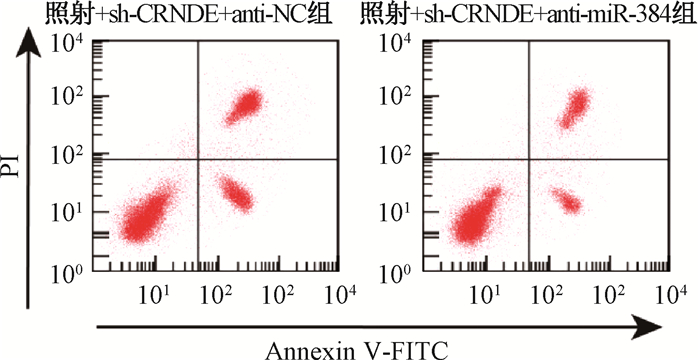
5.下调miR-384对结直肠癌细胞放射敏感性的影响:结果见图 4,表 4。结直肠癌细胞中同时转染CRNDE shRNA和miR-384 inhibitor后,经照射处理,检测细胞中的miR-384表达水平,细胞增殖能力和凋亡率。结果显示,与照射+sh-CRNDE+anti-NC组比较,照射+sh-CRNDE+anti-miR-384组miR-384水平降低(t=12.462, P < 0.01),细胞增殖能力升高(t=6.641,P < 0.01),凋亡率降低(t=7.625,P < 0.01)。下调miR-384可以逆转下调CRNDE联合照射对结直肠癌细胞增殖凋亡的影响,下调miR-384降低结直肠癌细胞放射敏感性。
|
图 4 CRNDE shRNA和miR-384 inhibitor共转染后对照射诱导的结直肠癌细胞凋亡影响 Figure 4 Effects of co-transfection of CRNDE shRNA and miR-384 inhibitor on radiation-induced apoptosis of colorectal cancer cells |
|
|
表 4 CRNDE shRNA和miR-384 inhibitor共转染后结直肠癌细胞中miR-384水平、细胞增殖和凋亡变化(x±s) Table 4 Changes of microRNA-384 level, cell proliferation and apoptosis in colorectal cancer cells after co-transfection of CRNDE shRNA and microRNA-384 inhibitor(x±s) |
讨论
本实验发现下调CRNDE后结直肠癌细胞的增殖能力下降,细胞凋亡增多,并且还可以协同照射发挥抗肿瘤作用,这提示CRNDE在结直肠癌发展中发挥促进作用,靶向抑制CRNDE表达具有提高结直肠癌细胞放射敏感性的作用。本研究还进一步明确了CRNDE调控结直肠癌细胞放射敏感性和增殖凋亡的作用机制,发现下调CRNDE可以靶向miR-384协同放射抵抗结直肠癌细胞恶性表型,这证实了CRNDE可以通过调控miR-384影响结直肠癌放射敏感性和发生发展。
CRNDE在人类支气管、皮肤、睾丸等组织中表达,其作为一种新型的lncRNA具有多种生物学作用[8]。CRNDE可以通过影响组蛋白的甲基化状态调控基因的转录过程,参与细胞生长、凋亡等过程[4]。目前,CRNDE已经被证实在肿瘤中异常表达,并且其可以通过调控肿瘤细胞生长参与肿瘤的发生和发展[9]。在胶质瘤和结直肠癌等肿瘤中发现CRNDE表达下调后的肿瘤细胞凋亡水平升高,细胞生长受到抑制,CRNDE可能是新型肿瘤诊断治疗的分子标记物和靶点[10-11]。研究表明,CRNDE在结直肠癌中高表达,并且其在肿瘤患者血浆和肿瘤组织中的表达水平具有很高的特异性和灵敏度,是一种重要的结直肠癌生物学标记[12]。本实验与上述研究报道一致,均说明CRNDE在结直肠癌中发挥癌基因的作用,并在体外证实了CRNDE在结直肠癌细胞增殖凋亡和放射敏感性中的作用,说明CRNDE不仅参与结直肠癌的发生和发展,还具有调控结直肠癌放射敏感性的作用。
LncRNA不含有起始密码子、开放阅读框,其通过与不同的靶基因结合影响下游信号的转导发挥多样生物学功能,LncRNA能够作为一种内源性的RNA与miRNA调控发挥生物功能[13-15]。目前在肿瘤细胞中的研究发现,CRNDE靶向调控miR-136-5p、miR-181a等miRNA的表达参与肿瘤的发生及发展[12, 16]。本实验发现CRNDE靶向负调控结直肠癌细胞中miR-384的表达,miR-384可能参与CRNDE调控结直肠癌放射敏感性和发展过程。miR-384是一个在肿瘤组织中低表达的miRNA,其对于肿瘤细胞的生长具有抑制作用,在不同肿瘤组织中受到不同的LncRNA的表达调控[17]。有研究表明,CRNDE可以靶向调控miR-384影响胶质瘤细胞的生长,CRNDE在肿瘤中的作用机制可能与miR-384有关[18]。miR-384是一个较为保守的miRNA分子,在神经突触的维持和放大中发挥作用[19]。最近的研究显示,miR-384在肿瘤组织中低表达,并且能够增加非小细胞肺癌细胞放射敏感性,在人胰腺癌细胞增殖中也发挥抵抗作用[20-21]。本实验明确了CRNDE通过调控miR-384对结直肠癌细胞增殖凋亡及放射敏感性的影响,说明了CRNDE在结直肠癌发生和放射敏感性中的作用与miR-384有关,这与在其他肿瘤中的研究结果一致。
综上,本实验证实了CRNDE参与结直肠癌细胞放射敏感性和增殖凋亡机制与靶向负调控miR-384表达有关,这为阐明CRNDE在结直肠癌细胞放射敏感性和发展中的作用机制提供了新思路,CRNDE可能是提高结直肠癌患者生存质量的途径之一。今后的实验会在多株结直肠癌细胞株及体内进行验证,并且会对CRNDE调控miR-384的下游靶向机制进行具体分析。
利益冲突 无
作者贡献声明 孙献涛、练延帮、胡晟云设计及进行实验操作、撰写成文;白杨、杨超协助完成实验;王贵宪协助完成数据分析
| [1] |
Zhu Z, Zhao S, Liu Y, et al. Risk of secondary rectal cancer and colon cancer after radiotherapy for prostate cancer:a meta-analysis[J]. Int J Colorectal Dis, 2018, 33(9): 1149-1158. DOI:10.1007/s00384-018-3114-7 |
| [2] |
Takeda A, Sanuki N, Tsurugai Y, et al. Stereotactic body radiotherapy for patients with oligometastases from colorectal cancer:risk-adapted dose prescription with a maximum dose of 83-100 Gy in five fractions[J]. J Radiat Res, 2016, 57(4): 400-405. DOI:10.1093/jrr/rrw029 |
| [3] |
Meng Y, Li Q, Li L, et al. The long non-coding RNA CRNDE promotes cervical cancer cell growth and metastasis[J]. Biol Chem, 2017, 399(1): 93-100. DOI:10.1515/hsz-2017-0199 |
| [4] |
Hu CE, Du PZ, Zhang HD, et al. Long noncoding RNA CRNDE promotes proliferation of gastric cancer cells by targeting miR-145[J]. Cell Physiol Biochem, 2017, 42(1): 13-21. DOI:10.1159/000477107 |
| [5] |
韩懿, 劳美琼, 雷巧如, 等. 宫颈癌中长链非编码RNACRNDE表达及其临床意义[J]. 中国肿瘤临床, 2015, 42(14): 705-708. Han Y, Lao MQ, Lei QR, et al. Expression of long-chain non-coding RNA CRNDE in cervical cancer[J]. Chin J Clin Oncol, 2015, 42(14): 705-708. DOI:10.3969/j.issn.1000-8179.20150535 |
| [6] |
关善斌, 黄新若, 李加伟, 等. 甲状腺乳头状癌组织中CRNDE的表达变化及对甲状腺癌细胞增殖、迁移、侵袭能力的影响[J]. 山东医药, 2018, 58(3): 89-92. Guan SB, Huang XR, Li JW, et al. Changes of CRNDE expression in papillary thyroid cancer and its effect on proliferation, migration and invasion of thyroid cancer cells[J]. Shandong Med J, 2018, 58(3): 89-92. DOI:10.3969/j.issn.1002-266X.2018.03.029 |
| [7] |
Liu T, Zhang X, Gao S, et al. Exosomal long noncoding RNA CRNDE-h as a novel serum-based biomarker for diagnosis and prognosis of colorectal cancer[J]. Oncotarget, 2016, 7(51): 85551-85563. DOI:10.18632/oncotarget.13465 |
| [8] |
Graham LD, Pedersen SK, Brown GS, et al. Colorectal neoplasia differentially expressed (CRNDE), a novel gene with elevated expression in colorectal adenomas and adenocarcinomas[J]. Genes Cancer, 2011, 2(8): 829-840. DOI:10.1177/1947601911431081 |
| [9] |
Ma X, Zhang W, Zhang R, et al. Overexpressed long noncoding RNA CRNDE with distinct alternatively spliced isoforms in multiple cancers[J]. Front Med, 2019, 13(3): 330-343. DOI:10.1007/s11684-017-0557-0 |
| [10] |
Wang Y, Wang Y, Li J, et al. CRNDE, a long-noncoding RNA, promotes glioma cell growth and invasion through mTOR signaling[J]. Cancer Lett, 2015, 367(2): 122-128. DOI:10.1016/j.canlet.2015.03.027 |
| [11] |
Han P, Li JW, Zhang BM, et al. The lncRNA CRNDE promotes colorectal cancer cell proliferation and chemoresistance via miR-181a-5p-mediated regulation of Wnt/β-catenin signaling[J]. Mol Cancer, 2017, 16(1): 9-21. DOI:10.1186/s12943-017-0583-1 |
| [12] |
Han P, Li JW, Zhang BM, et al. The lncRNA CRNDE promotes colorectal cancer cell proliferation and chemoresistance via miR-181a-5p-mediated regulation of Wnt/β-catenin signaling[J]. Mol Cancer, 2017, 16(1): 9. DOI:10.1186/s12943-017-0583-1 |
| [13] |
Cui Y, Zhang F, Zhu C, et al. Upregulated lncRNA SNHG1 contributes to progression of non-small cell lung cancer through inhibition of miR-101-3p and activation of Wnt/β-catenin signaling pathway[J]. Oncotarget, 2017, 8(11): 17785-17794. DOI:10.18632/oncotarget.14854 |
| [14] |
Tao Y, Han T, Zhang T, et al. LncRNA CHRF-induced miR-489 loss promotes metastasis of colorectal cancer via TWIST1/EMT signaling pathway[J]. Oncotarget, 2017, 8(22): 36410-36422. DOI:10.18632/oncotarget.16850 |
| [15] |
Zhuang J, Shen L, Yang L, et al. TGFβ1 promotes gemcitabine resistance through regulating the LncRNA-LET/NF90/miR-145 signaling axis in bladder cancer[J]. Theranostics, 2017, 7(12): 3053-3067. DOI:10.7150/thno.19542 |
| [16] |
Li DX, Fei XR, Dong YF, et al. The long non-coding RNA CRNDE acts as a ceRNA and promotes glioma malignancy by preventing miR-136-5p-mediated downregulation of Bcl-2 and Wnt2[J]. Oncotarget, 2017, 8(50): 88163-88178. DOI:10.18632/oncotarget.21513 |
| [17] |
Wang Y, Zhang Z, Wang J. MicroRNA-384 inhibits the progression of breast cancer by targeting ACVR1[J]. Oncol Rep, 2018, 39(6): 2563-2574. DOI:10.3892/or.2018.6385 |
| [18] |
Zheng J, Liu X, Wang P, et al. CRNDE promotes malignant progression of glioma by attenuating miR-384/PIWIL4/STAT3 axis[J]. Mol Ther, 2016, 24(7): 1199-1215. DOI:10.1038/mt.2016.71 |
| [19] |
Hu Z, Li Z. miRNAs in synapse development and synaptic plasticity[J]. Curr Opin Neurobiol, 2017, 45: 24-31. DOI:10.1016/j.conb.2017.02.014 |
| [20] |
Guo Q, Zheng M, Xu Y, et al. MiR-384 induces apoptosis and autophagy of non-small cell lung cancer cells through the negative regulation of Collagen α-1(X) chain gene[J]. Biosci Rep, 2019, 39(2): 1-16. DOI:10.1042/BSR20181523 |
| [21] |
沈彬彬, 周俊, 黎亮, 等. 长链非编码RNA TSIX通过靶向miR-384调控人胰腺癌细胞增殖的研究[J]. 中国临床药理学与治疗学, 2018, 23(6): 621-626. Shen BB, Zhou J, Li L, et al. Long non-coding RNA TSIX regulates the proliferation of human pancreatic cancer cells by targeting miR-384[J]. Chin J Clin Pharmacol Ther, 2018, 23(6): 621-626. DOI:10.12092/j.issn.1009-2501.2018.06.004 |
 2019, Vol. 39
2019, Vol. 39


