2. 安徽医学高等专科学校附属医院放射卫生科, 合肥 230001
2. Department of Radiation Hygiene, Affiliated Hospital of Anhui Medical College, Hefei 230001, China
哺乳动物胚胎中枢神经系统发育对辐射异常敏感,宫内受照胎儿出生后常表现出脑功能障碍[1]。日本原子弹爆炸受害幸存者流行病学调查结果显示,胎龄8~15周受照者其神经元前体细胞增殖及增殖后的细胞正确迁移进程受到抑制,出现严重智力障碍。有关研究表明,脑胚胎发育过程中各种神经细胞定向迁移、正确定位构成了出生后大脑发挥正常功能的基础[2]。而神经细胞迁移过程涉及多种迁移相关因子的参与,如神经细胞骨架蛋白(F-肌动蛋白、α-微管蛋白、tau蛋白、MAP2蛋白)、脑源性神经细胞生长因子(BDNF)及细胞外基质糖蛋白Reelin在维持神经细胞结构形状及其稳定性[3],促进神经细胞存活、新细胞生成[4],以及趋化引导神经迁移过程[5]中扮演者非常重要的作用。水迷宫测试可用于检测大鼠的空间记忆学习能力[6]。为此,本研究通过检测氚水辐射后神经细胞迁移相关因子(F-肌动蛋白、α-微管蛋白、tau、MAP2、BDNF、Reelin)表达的情况以及大鼠空间学习记忆能力,进而探索氚辐射对发育期间神经细胞迁移及出生后空间学习记忆能力影响。
材料与方法1.实验动物:SPF级Sprague-Dawley(SD)大鼠购自常州卡文斯实验动物有限公司,动物合格证号SCXK(苏)2011-0003,所有大鼠均饲养于本实验室动物房。环境温度维持在(24±2)℃,光照/暗循环12 h(上午7 :00开灯)。在整个实验过程中,动物可以随意食用标准的食物和水。在适应7 d后,雌鼠与雄鼠按2:1的比例交配过夜。早晨首次观察到阴道栓的时间为妊娠第0天。妊娠第14天,将妊娠大鼠随机数表法分为实验组和对照组。实验组腹腔单次注射3.7×106Bq/g氚水。对照组腹腔注射等量生理盐水。
2.试剂及仪器:氚水(中国原子能科学研究院);DMEM/F12(1:1)和B27(美国GIBCO公司);新生小牛血清(杭州四季青生物工程材料有限公司);表皮生长因子(EGF)、碱性成纤维细胞生长因子(bFGF)、胰蛋白酶、多聚赖氨酸(Poly-L-lysine)、阿糖胞苷(Ara-c)均购自美国Sigma公司;二抗羊抗兔IgG(北京博奥生物有限责任公司);β-肌动蛋白抗体、HRP标记的羊抗小鼠IgG抗体(北京中杉金桥公司);水合氯醛(上海生物工程有限公司)。
3.海马神经元的原代培养:取24 h内的新生SD大鼠,性别不限,置于无菌操作室内,剥离出海马组织,并用预冷磷酸盐缓冲液(PBS)冲洗后备用。将所获得的新生大鼠海马组织放入无菌玻璃皿中,剪碎后加入0.125%胰蛋白酶消化20 min,加入同等体积胎牛血清终止消化,离心半径10 cm、1 000 r/min低速离心5 min,弃上清液,重新悬浮细胞,用血细胞计数板计数后分别接种在不含盖玻片和含盖玻片的6孔板中,种植密度5×106/皿,加入培养基4 cm,置于37℃、5%CO2、饱和湿度的培养箱中。培养24 h后,将培养液半换液,培养第3天时,加入阿糖胞苷(终浓度为3 μg/ml),24 h后去除。此后每2~3天全换液1次。
4.细胞照射和培养:将培养的神经细胞经NF160免疫组织化学染色证实纯度达90%以上。培养7 d后加入氚水,使各培养孔的氚水终浓度分别为0、3.7×102、3.7×103、3.7×104、3.7×105、3.7×106 Bq/ml,照射24 h后进行实验。
5. Western blot法检测F-肌动蛋白、α-微管蛋白、tau、MAP2蛋白的表达
(1) 总蛋白提取及蛋白质定量:收集各神经元细胞,用预冷的PBS漂洗2~3次,按总蛋白提取试剂盒说明书步骤,提取神经细胞内蛋白质。将总蛋白提取液取5 μl样品加入995 μl超纯水,于分光光度计下测量样本的蛋白质浓度。根据测出的样品蛋白浓度将其进行稀释,使各组样本的蛋白质终浓度一致。加入等体积蛋白上样缓冲液混合煮沸8 min,适量分装,-80℃保存备用。
(2) Western blot检测:配置10%分离胶和5%浓缩胶,取20 μl总蛋白上样,经十二烷基硫酸钠-聚丙稀酰胺凝胶电泳(SDS-PAGE)后,转移到PVDF膜上,5%脱脂奶封闭1~2 h,Tris-缓冲盐溶液Tween(TBST)洗3次;加入F-肌动蛋白(1:5 000)、α-tubulin(1:5 000)、tau(1:1 000)与MAP2(1:1 000)蛋白的一抗;4℃封闭过夜,TBST洗3次;加二抗羊抗兔IgG(1:5 000)室温孵育1 h,TBST洗3次;ECL工作液发光显影,定影晾干。
(3) 图像分析:以Quantity-One生物医学图像分析系统进行目的条带半定量分析,将测出各条带积分吸光度(IA)值除以β-肌动蛋白的IA值,得到相对强度(relative intensity,RI)。通过各处理组RI值的比较,可得出蛋白表达的变化规律。实验重复3次。
6. RT-PCR法检测BDNF mRNA和Reelin mRNA的表达:按照试剂盒说明书步骤,使用TRIzol法试剂从细胞中提取总RNA。引物如下:BDNF正向引物5′ CCATGAAAGAAGCAAACGT 3′,反向引物5′ CTCCAGCAGAAAGAGCAGA 3′;Reelin正向引物5′ CTGCTGGACTTCTCTACGGAT 3′,反向引物5′ CAGTAGAGGTGGAAGGATGGG 3′;β-肌动蛋白正向引物5′ CCCGCGGAGTACAACCTTCT 3′,反向引物5′ CGTCATCCATGGCGAACT 3′。PCR反应程序设置如下:最初在94℃变性3 min,37个循环在94℃变性30 s,在56℃退火30 s,在72℃延伸1 min,72℃延伸10 min。紫外投射仪下观察结果,凝胶成像分析系统上扫描并照相。以Quantity-One生物医学图像分析系统进行目的条带半定量分析,通过各处理组RI值的比较可得出蛋白表达的变化规律。实验重复3次。
7. Morris水迷宫(MWM)测试:MWM是用于研究大鼠空间学习记忆的装置,测试实验分为定位航行训练和空间探索两个阶段。对照组和实验组各随机选取8只(性别比一致)体重相近的出生后38~42 d仔鼠进行水迷宫实验,前4 d进行定位航行训练,5 d时撤去透明平台进行空间探索实验。最终根据各组大鼠逃避潜伏期、进入目标象限次数和停留时间等指标,比较分析氚照射对仔鼠学习记忆能力的影响。
8.统计学处理:采用SPSS 16.0软件进行数据分析,所有计量资料均符合正态分布,结果以x±s表示,两组比较方差齐性采用独立样本t检验。P < 0.05为差异有统计学意义。
结果1. Western blot结果分析:结果显示,与0 Bq/ml浓度相比,随着氚水浓度的增加,受照组神经细胞表达的F-肌动蛋白(t=8.898~25.749,P < 0.05)、α-微管蛋白(t=3.261~7.900,P < 0.05)、tau(t=2.274~5.003,P < 0.05)、MAP2 (t=2.274~5.003,P < 0.05)蛋白含量逐渐降低,差异有统计学意义(图 1、表 1)。
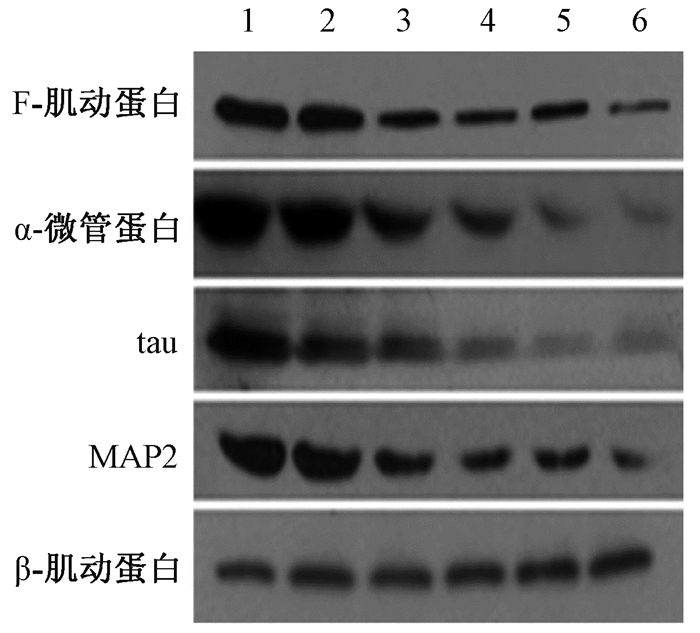
|
注:1~6分别为0、3.7×102、3.7×103、3.7×104、3.7×105、3.7×106 Bq/ml 图 1 Western blot方法检测不同浓度氚水处理神经细胞后神经细胞骨架蛋白F-肌动蛋白、α-微管蛋白、tau、MAP2的表达 Figure 1 The expressions of cytoskeletal proteins F-actin, α-tubulin, tau and MAP2 in the neurons exposed to different concentration of HTO detected by Western blot |
|
|
表 1 不同浓度氚水处理后神经细胞骨架蛋白的表达(x±s) Table 1 The expressions of cytoskeletal proteins in the neurons exposed to different concentrations of HTO(x±s) |
2. RT-PCR结果分析:与0 Bq/ml比较,随着氚水浓度的增加,神经细胞表达的BDNF mRNA(t=3.580~19.792,P < 0.05)和Reelin mRNA(t=3.240~39.692,P < 0.05)含量逐渐降低,差异有统计学意义(表 2)。
|
|
表 2 不同浓度氚水处理后神经细胞表达BDNF mRNA和Reelin mRNA含量的变化(x±s) Table 2 The expressions of BDNF mRNA and Reelin mRNA in the neurons exposed to different concentrations of HTO(x±s) |
3. Morris水迷宫测试结果:在定向巡航实验中,实验组大鼠逃避潜伏期明显长于对照组(t=-2.563, P < 0.05)。在空间探索试验阶段,实验组大鼠在目标象限穿行次数少于对照组(t=3.214,P < 0.05),平台停留时间短于对照组(t=3.874,P < 0.05),见表 3。
|
|
表 3 两组大鼠逃避潜伏期及目标象限穿行次数和停留时间的比较(x±s) Table 3 The comparison of escape latency to platform and through times and retention time in target quadrant of rats between expriment group and control group(x±s) |
讨论
脑胚胎发育过程中,各种神经细胞通过定向迁移实现在脑组织结构中的正确定位,这一过程构成了出生后大脑发挥正常功能的基础。而神经细胞迁移障碍可表现为神经细胞迁移距离的缩短或定位异常。微管是细胞骨架的重要组成部分,由α和β两种微管蛋白亚基聚合后形成的一种中空管状结构[7], 它通过聚合和解聚给神经细胞提供前进的动力。同时,它在细胞迁移中维持胞内生长锥的稳定性和加强中心体及运动中胞核的联系方面也起着非常重要的作用[8]。经典的微管相关蛋白(MAPs),如tau蛋白和MAP2蛋白,在微管聚合过程中,通过和微管二聚体直接可逆的结合,防止已经聚合的二聚体解聚,从而稳定微管的聚合过程[9],帮助微管沿轴突方向延伸。磷酸化的tau蛋白和MAP2蛋白通常会导致它们在微管聚合过程中无法和微管二聚体相结合而影响微管的聚合[10]。微丝蛋白F-肌动蛋白在神经细胞迁移中的作用体现在两个方面:一是在细胞核运动中产生一个向前的推力;二是和细胞外基质相粘附在一起,在细胞尾部运动时产生一个向前的拉力[11]。早期体外培养的神经细胞研究表明,破坏肌动蛋白微丝F-肌动蛋白能够阻碍颗粒神经元沿放射状胶质细胞迁移的过程[12]。本实验证实,体外培养时受氚水照射的神经元细胞骨架蛋白F-肌动蛋白、α-微管蛋白、tau和MAP2的表达量普遍低于对照组。这与先前的氚水照射致体外培养神经元迁移距离缩短的研究结果相印证[13]。因此,可推断出生前氚照射可以降低细胞骨架蛋白的表达,进一步影响细胞骨架结构的形成而扰乱神经元迁移。
脑源性神经细胞营养因子(BDNF)归属于神经营养素家族,是一类促进大脑皮层和小脑颗粒神经元迁移的物质[14]。前期研究结果显示,氚水照射体外培养的海马神经细胞,伴随迁移距离的缩短,其BDNF mRNA含量随氚水浓度不断增加而减少[15]。本实验结果显示,在相同的氚水照射条件下BDNF mRNA表达的下调趋势和细胞骨架蛋白F-肌动蛋白、α-微管蛋白、tau和MAP2表达的下调结果相一致,提示氚水照射可能通过下调BDNF的表达影响神经细胞迁移过程中细胞骨架稳定性而干扰其迁移。
Reelin是由3 461个氨基酸组成,分子量约为388 000,它参与的信号传导通路在大脑皮层细胞结构的形成中起着非常重要的作用[16]。作为神经元和放射状胶质细胞之间连接的桥梁,Reelin发生突变可导致脑发育中神经细胞沿放射状神经细胞迁移发生严重紊乱[17]。Reelin与其在神经元胞外部分的受体VLDLR和ApoER2相结合,通过非受体络氨酸激酶诱导Dab络氨酸残基磷酸化来激活Reelin信号途径,继而和胞内下游的信号分子(如细胞骨架蛋白)相作用,来指导神经元正确的迁移和定位[18]。前期实验结果显示,神经元暴露于浓度为3.7×105 Bq/ml的氚水下,Reelin mRNA、BDNF mRNA和β-tubulin的表达下调致神经元迁移距离缩短[19]。本实验也证实受氚水照射过的神经细胞中,Reelin mRNA的表达与细胞骨架蛋白F-肌动蛋白、α-微管蛋白、tau和MAP2的表达是相一致的,这提示氚水照射可能通过下调神经细胞Reelin mRNA表达,影响其迁移过程中的信号调控及正确定位,进而导致神经细胞无法完成正常迁移过程。
Morris水迷宫(MWM)是一种设计用做测试哺乳动物空间学习和记忆能力的设备。本实验结果证实,所有胚胎发育第14天受氚水照射的仔鼠其出生后在水迷宫测试中都不能正确定向。与对照相比,受照仔鼠的逃避潜伏期延长,目标象限停留时间缩短。这与氚水照射体外培养受照神经元中,神经细胞迁移相关因子F-肌动蛋白、α-微管蛋白、tau、MAP2、BDNF mRNA和Reelin mRNA表达的降低而导致神经细胞迁移距离缩短的结果相符。本实验证实,子宫内氚水照射可以下调迁移相关因子F-肌动蛋白、α-微管蛋白、tau、MAP2、BDNF mRNA和Reelin mRNA的表达进而妨碍神经细胞的正确迁移,而前期研究结果发现受照鼠脑神经细胞迁移受干扰致异常分布影响其空间学习记忆功能,最终表现出水迷宫测试成绩异常[20]。这些结果表明出生前氚辐射可能会影响神经细胞迁移进而引发脑功能异常。
综上所述,神经细胞迁移相关因子F-肌动蛋白、α-微管蛋白、tau、MAP2、BDNF和Reelin在神经细胞迁移过程中起着非常重要的作用。氚水照射神经细胞使其迁移相关因子表达下调,可破坏神经细胞迁移正常进程,使其定位异常,脑结构紊乱,最终损害大脑空间学习记忆能力。
志谢: 感谢安徽省教育厅自然科学基金(2010941, KJ2011Z162, KJ2016A376)对本研究的支持
利益冲突 无
作者贡献声明 王永生负责动物模型制备,具体实验操作,数据整理及分析,撰写论文;王明明参与选题和设计,指导论文撰写和修改
| [1] |
Yang B, Ren BX, Tang FR. Prenatal irradiation-induced brain neuropathology and cognitive impairment[J]. Brain Dev, 2017, 39(1): 10-22. DOI:10.1016/j.braindev.2016.07.008 |
| [2] |
Cooper JA. A mechanism for inside-out lamination in the neocortex[J]. Trends Neurosci, 2008, 31(3): 113-119. DOI:10.1016/j.tins.2007.12.003 |
| [3] |
王永生, 朱虹. 神经细胞骨架在神经细胞迁移中作用的研究进展[J]. 东南国防医药, 2018, 20(1): 54-56. Wang YS, Zhu H. Advances in the role of neurocytoskeleton in neuronal migration[J]. Mil Med J Southest Chin, 2018, 20(1): 54-56. DOI:10.3969/j.issn.1672-271X.2018.01.012 |
| [4] |
Limongi T, Rocchi A, Cesca F, et al. Delivery of brain-derived neurotrophic factor by 3D biocompatible polymeric scaffolds for neural tissue engineering and neuronal regeneration[J]. Mol Neurobiol, 2018, 55(12): 8788-8798. DOI:10.1007/s12035-018-1022-z |
| [5] |
Hirota Y, Nakajima K. Control of neuronal migration and aggregation by reelin signaling in the developing cerebral cortex[J]. Front Cell Dev Biol, 2017, 5: 40. DOI:10.3389/fcell.2017.00040 |
| [6] |
Tyul'kova EI, Vataeva LA, Vetrovoi OV, et al. Prenatal hypoxia modifies working memory and the activity of hippocampal polyphosphoinositide system in rats[J]. J Evol Biochem Phys, 2015, 51(2): 115-121. DOI:10.1134/s0022093015020064 |
| [7] |
Kantak SS, Diglio CA, Onoda JM. Low dose radiation-induced endothelial cell retraction[J]. Int J Radiat Biol, 1993, 64(3): 319-328. DOI:10.1080/09553009314551471 |
| [8] |
Wu Q, Liu J, Fang A, et al. The dynamics of neuronal migration[J]. Adv Exp Med Biol, 2014, 800: 25-36. DOI:10.1007/978-94-007-7687-6_2 |
| [9] |
Hamada T, Sonobe S. Isolation of microtubules and microtubule-associated proteins[J]. Methods Mol Biol, 2017, 1511: 281-289. DOI:10.1007/978-1-4939-6533-5_22 |
| [10] |
Ramkumar A, Jong BY, Ori-McKenney KM. ReMAPping the microtubule landscape:How phosphorylation dictates the activities of microtubule-associated proteins[J]. Dev Dyn, 2018, 247(1): 138-155. DOI:10.1002/dvdy.24599 |
| [11] |
Svitkina T. The actin cytoskeleton and actin-based motility[J]. Cold Spring Harb Perspect Biol, 2018, 10(1): a018267. DOI:10.1101/cshperspect.a018267 |
| [12] |
Cooper JA. Cell biology in neuroscience:mechanisms of cell migration in the nervous system[J]. J Cell Biol, 2013, 202(5): 725-734. DOI:10.1083/jcb.201305021 |
| [13] |
王永生, 姚晓波, 蔡二朋, 等. 氚照射对大鼠海马神经细胞黏附分子L1、NCAM表达的影响[J]. 安徽医科大学学报, 2015, 50(8): 1102-1106. Wang YS, Yao XB, Cai EP, et al. Effects of irradiation from tritiated water on the expression of neural cell adhesion molecule L1 and NCAM of hippocampus in rats[J]. Acta Univ Med Anhui, 2015, 50(8): 1102-1106. |
| [14] |
Sasi M, Vignoli B, Canossa M, et al. Neurobiology of local and intercellular BDNF signaling[J]. Pflugers Arch, 2017, 469(5-6): 593-610. DOI:10.1007/s00424-017-1964-4 |
| [15] |
邱俊, 吴翠萍, 蔡二朋, 等. 氚β辐射对神经细胞迁移相关因子表达的影响[J]. 辐射防护, 2012, 32(4): 204-209. Qiu J, Wu CP, Cai EP, et al. Effects of tritium β irradiation on the expression of the regulated factors associated with neuron cell migration[J]. Radiat Prot, 2012, 32(4): 204-209. |
| [16] |
Boyle MP, Bernard A, Thompson CL, et al. Cell type-specific consequences of reelin deficiency in the mouse neocortex, hippocampus, and amygdala[J]. J Comp Neurol, 2011, 519(11): 2061-2089. DOI:10.1002/cne.22708 |
| [17] |
Takeda H, Kasida Y. Biological behavior of tritium after administration of tritiated water in the rat[J]. J Radiat Res, 1979, 20(2): 174-185. DOI:10.1269/jrr.20.174 |
| [18] |
Park TJ, Curran T. Crk and Crk-like play essential overlapping roles downstream of disabled-1 in the Reelin pathway[J]. J Neurosci, 2008, 28(50): 13551-13562. DOI:10.1523/JNEUROSCI.4323-08.2008 |
| [19] |
蔡二朋, 邱俊, 王永生, 等. 甲状腺激素对氚致神经元迁移障碍的改善作用[J]. 中华放射医学与防护杂志, 2012, 32(6): 588-592. Cai EP, Qiu J, Wang YS, et al. Effects of thyroxine on the migration of newborn rat hippocampal neurons exposed to HTO[J]. Chin J Radiol Med Prot, 2012, 32(6): 588-592. DOI:10.3760/cma.j.issn.0254-5098.2012.06.007 |
| [20] |
姚晓波, 王永生, 邱俊, 等. 氚宫内照射对大鼠神经细胞分布及脑机能的影响[J]. 安徽医科大学学报, 2014, 49(10): 1371-1375. Yao XB, Wang YS, Qiu J, et al. Effects of irradiation in utero from tritiated water on the distribution of neural cells and brain function in rats[J]. Acta Univ Med Anhui, 2014, 49(10): 1371-1375. |
 2019, Vol. 39
2019, Vol. 39


