肺癌是世界上最常见的恶性肿瘤之一[1-2],其常用治疗策略之一为放射治疗,而患者由于基因突变等导致的先天性辐射抵抗和多次放疗导致的肿瘤获得性辐射抵抗,使得单纯放疗效果不佳[3]。目前,辐射抵抗仍是影响肺癌疗效的重要因素[4]。为提高肿瘤对放射治疗的敏感性,放射增敏成为肿瘤辐射抵抗研究的一项重要内容。放射增敏机制之一是促进肿瘤细胞凋亡[5-6]。辐射抵抗的肿瘤细胞凋亡减少与抑癌基因P53表达降低相关,P53突变细胞的辐射抗性会增加[7]。
FOXO4为转录因子Foxhead家族成员,在衰老细胞中与靶基因结合后可抑制P53活化,抑制细胞凋亡,维持衰老细胞的活力。FOXO4-DRI(FOXO4 D-retro-inverso)多肽是与FOXO4结构相似的多肽,能够竞争性作用于FOXO4与P53结合结构域,破坏FOXO4-P53相互作用,引发活性P53核外排,诱导P53依赖性细胞凋亡[8-9]。FOXO4-DRI在肿瘤放射增敏调节中作用的研究较少。因此,本研究利用两种非小细胞肺癌(non-small cell lung cancer, NSCLC)细胞系的辐照模型进行了FOXO4-DRI对细胞放射增敏性影响的研究。
材料与方法1.细胞:人NSCLC细胞系NCI-H460、NCI-A549购自上海赛百慷生物技术股份有限公司。H460在RPMI 1640培养基(美国GIBCO公司)中培养;A549在F12 K培养基(美国GIBCO公司)中培养。各培养基补充有10%胎牛血清(美国GIBCO公司)、100 μg/ml青霉素、100 μg/ml链霉素溶液,于5%CO2的37℃恒温培养箱中培养。
2.试剂与仪器:CCK-8试剂盒(C0037)购自南通碧云天生物技术有限公司;FOXO4-DRI由上海诺优生物科技有限公司合成;划痕插件购自德国IBIDI公司;聚偏氟乙烯(PVDF)膜购自上海赛默飞生物有限公司;细胞凋亡试剂盒(C1062M)、细胞周期试剂盒(C1052)购自南通碧云天生物技术有限公司;Autocell 40 137Cs γ射线照射源购自加拿大原子能有限公司(照射剂量率0.99 Gy/min);Accuri C6流式细胞仪购自美国BD Biosciences公司;RT-6500酶标分析仪购于深圳雷杜生命科学股份有限公司。
3. FOXO4-DRI给药剂量的选择:将FOXO4-DRI溶于磷酸盐缓冲液(PBS)中,配置成2.5 mmol/L储存液。取对数生长期细胞,调整细胞浓度为5.0×104/ml,100 μl/孔接种于96孔培养板中,6 h后给予不同浓度(0、2、4、6、8、10、20、30、60 μmol/L)FOXO4-DRI,继续培养48 h后CCK-8法检测细胞活力并确定最佳给药浓度。
4. CCK-8法检测细胞增殖:取对数生长期细胞,调整细胞浓度为5.0×104/ml,100 μl/孔接种于96孔培养板中,6 h后给予FOXO4-DRI或10 Gy照射处理,于24、48和72 h弃去培养基,每孔加入10 μl CCK-8溶液、100 μl培养基继续培养1 h,测定450 nm处吸光度(A)值。以未作任何处理的细胞作为对照组,其细胞存活力为1,其余各实验组(FOXO4-DRI组、单纯照射组、照射+FOXO4-DRI组)按细胞活力=[A实验-A空白]/[A对照-A空白]计算。式中,A空白为CCK-8溶液的吸光度;A对照为CCK-8溶液和无处理细胞的吸光度;A实验为CCK-8溶液及FOXO4-DRI或10 Gy照射处理细胞的孔的吸光度。
5.克隆形成实验:H460细胞800/孔、A549细胞500/孔接种于6孔培养板中,6 h后给予FOXO4-DRI或0、2、4、6和8 Gy照射处理,培养2周后弃培养基,加甲醇固定15 min,然后去固定液,姬姆萨染色20 min。
6.划痕实验:将细胞悬液稀释至5×105/ml,在培养插件的每个孔中加入70 μl细胞悬液,放入培养箱中培养,6 h后移除培养插件,加入无血清培养基培养并给予FOXO4-DRI或10 Gy照射处理,照射后0及24 h后拍照记录。
7.细胞凋亡实验:取对数生长期细胞,调整细胞浓度为5.0×105/ml,1 ml/孔接种于6孔培养板中过夜培养后,给予FOXO4-DRI或10 Gy照射处理,于2 h收集细胞,PBS洗两次,加入凋亡染色混合液[100 μl的结合缓冲液,5 μl Annexin V抗体,5 μl碘化丙啶(PI)染液],室温避光孵育15 min,加入100 μl的结合缓冲液,流式细胞仪检测。
8.细胞周期实验:取对数生长期细胞,调整细胞浓度为5.0×105/ml,1 ml/孔接种于6孔培养板中过夜培养后,给予FOXO4-DRI或10 Gy照射处理,于24、48 h收集细胞,加入1 ml PBS重悬细胞后弃上清,1 ml预冷70%乙醇,轻吹混匀,4℃固定过夜后,采用离心半径6 cm、3 000 r/min离心5 min,离心结束后去固定液,加入预冷的PBS 1 ml再次离心5 min, 3 000 r/min, 离心半径6 cm,弃上清;加染色液(染色缓冲液0.5 ml,PI染色液25 μl,RNase A 10 μl)37℃避光温浴30 min,加1 ml PBS洗后采用离心半径6 cm、3 000 r/min离心5 min后弃上清,加100 μl PBS,流式细胞仪检测。
9.统计学处理:采用SPSS 19.0统计软件进行数据分析。服从正态分布的计量资料用x±s表示,两组间数据比较采用独立样本t检验。P<0.05为差异有统计学意义。
结果1. FOXO4-DRI对H460、A549细胞增殖的影响:结果显示,给予不同浓度FOXO4-DRI处理48 h后,NSCLC细胞H460、A549的细胞活力均呈浓度依赖性下降,FOXO4-DRI对H460的半数有效抑制浓度(IC50)为6 μmol/L,对A549的IC50为30 μmol/L,差异有统计学意义(t=2.33、5.85、15.74、31.64、107.10、2.75、22.97、35.85,P < 0.05)(图 1)。
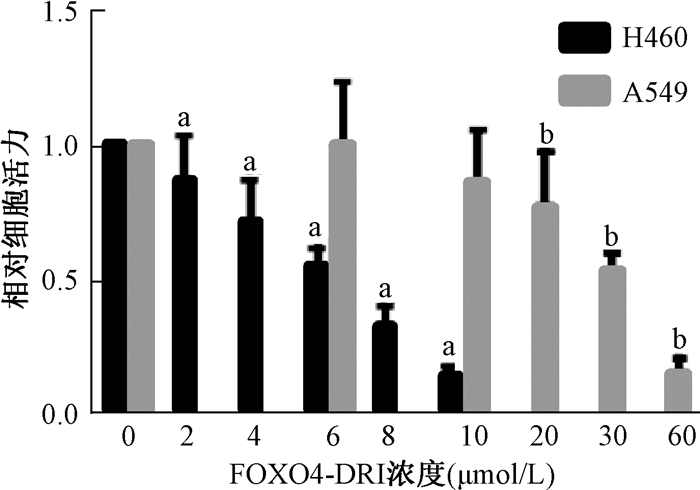
|
注:a与H460组0 μmol/L比较,t=2.33、5.85、15.74、31.64、107.10,P < 0.05;b与A549组0 μmol/L比较,t=2.75、22.97、35.85 图 1 FOXO4-DRI抑制NSCLC细胞的活力的IC50 Figure 1 IC50 of FOXO4-DRI to the viability of NSCLC cells |
2. FOXO4-DRI或照射对H460、A549细胞增殖的影响:与对照组相比,给予IC50剂量的FOXO4-DRI或10 Gy照射处理后24、48和72 h,H460、A549细胞的细胞活力显著降低,差异有统计学意义(t=13.41、3.69、3.88、2.15、6.00、29.46、21.42、1.06、36.57、21.46、50.75、22.60,P < 0.05)。与单纯照射组比较,照射+FOXO4-DRI组细胞的细胞活力显著降低,其差异有统计学意义(t=4.37、2.94、8.15、9.21、23.40、6.29,P < 0.05)。结果表明,FOXO4-DRI可以长时间有效抑制NSCLC细胞增殖,增加其辐射敏感性(表 1)。
|
|
表 1 FOXO4-DRI对NSCLC细胞增殖能力的影响(%,x±s) Table 1 Effect of FOXO4-DRI on proliferation of NSCLC cells(%, x±s) |
3. FOXO4-DRI对H460、A549细胞克隆形成能力的影响:结果显示,与0 Gy的单纯照射组细胞相比,不同剂量照射处理后,H460、A549细胞的克隆形成数目呈剂量依赖性减少(t=55.07、68.12、60.53、93.48、10.96、16.25、45.03);与单纯照射组比较,等剂量照射联合给予FOXO4-DRI处理组细胞克隆形成数目减少,其差异有统计学意义(t=51.00、5.17、8.43、34.00、20.78、10.96、25.98、13.23,P < 0.05)。结果表明,FOXO4-DRI可以抑制H460、A549细胞克隆形成能力,增加其辐射敏感性(图 2)。
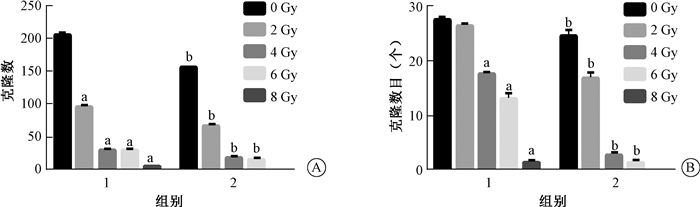
|
注:1.单纯照射组;2.照射+FOXO4-DRI组。a与0 Gy单纯照射组比较,t=55.07、68.12、60.53、93.48、10.96、16.25、45.03,P < 0.05;b与相同剂量单纯照射组比较,t=51.00、5.17、8.43、34.00、20.78、10.96、25.98、13.23,P < 0.05 图 2 照射和FOXO4-DRI对NSCLC细胞H460(A)和A549(B)克隆形成能力的影响 Figure 2 Effects of IR and FOXO4-DRI on colony formation of H460 cells (A) and A549 cells (B) |
4. FOXO4-DRI对H460、A549细胞迁移能力的影响:结果显示,与对照组比较,FOXO4-DRI组或单纯照射组划痕面积增加,与单纯照射组比较,照射+FOXO4-DRI组划痕面积显著增加,其差异有统计学意义(t=33.37、51.28、139.10、47.91、5.25、7.56,P < 0.05)。结果表明,FOXO4-DRI能够有效抑制H460、A549细胞的迁移(图 3)。
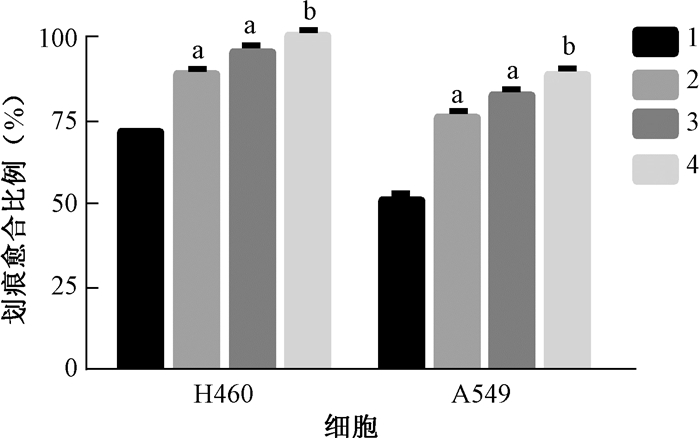
|
注:1.对照组;2. FOXO4-DRI组;3.单纯照射组;4.照射+FOXO4-DRI组。a与对照组比较,t=33.37、51.28、139.10、47.91,P < 0.05;b与单纯照射组比较,t=5.25、7.56,P < 0.05 图 3 照射和FOXO4-DRI对NSCLC H460细胞(A)和A549细胞(B)迁移能力的影响 Figure 3 Effects of IR and FOXO4-DRI on the migration of H460 cells (A) and A549 cells (B) |
5. FOXO4-DRI对H460、A549细胞凋亡的影响:结果如图 4显示,与对照组相比,给予FOXO4-DRI或10 Gy照射处理后2 h,H460、A549细胞的凋亡比例增加,差异有统计学意义(t=3.46、2.95、42.00、14.72,P < 0.05);与单纯照射组比较,照射+FOXO4-DRI组细胞凋亡比例增加,其差异有统计学意义(t=9.20、11.52,P < 0.05),提示FOXO4-DRI能够促进受照射H460、A549细胞凋亡。
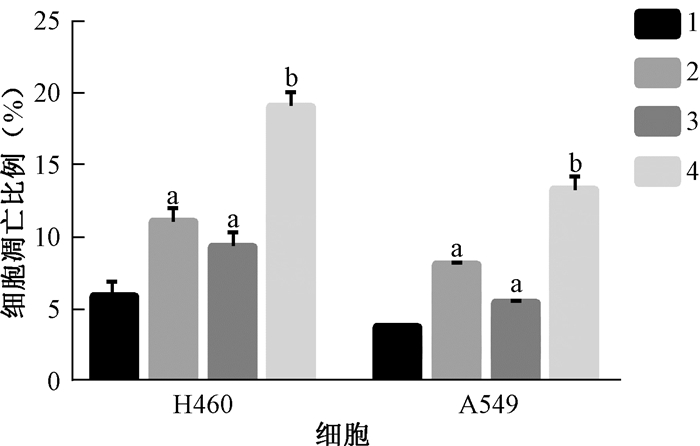
|
注:1.对照组;2. FOXO4-DRI组;3.单纯照射组;4.照射+FOXO4-DRI组。a与对照组比较,t=3.46、2.95、42.00、14.72,P < 0.05;b与单纯照射组比较,t=9.20、11.52,P < 0.05 图 4 FOXO4-DRI或照射对NSCLC细胞凋亡的影响 Figure 4 Effects of FOXO4-DRI or IR on the apoptosis of NSCLC cells |
6. FOXO4-DRI对H460、A549细胞周期的影响:与对照组相比,FOXO4-DRI处理24 h后H460、A549的G0/G1期细胞比例增加(t=16.31、31.59,P < 0.05),S细胞比例下降(t=6.03,P < 0.05)G2/M细胞比例下降(t=11.80、7.29,P < 0.05),10 Gy照射24 h、48 h后S期细胞比例下降(t=22.93、18.15、6.50,P < 0.05),G2/M期细胞比例增加(t=15.82、11.39、3.50,P < 0.05);与照射组比较,照射+FOXO4-DRI组G0/G1期细胞比例增加(t=10.05、4.65,P < 0.05),S期细胞比例增加(t=3.85、17.62、13.62,P < 0.05),G2/M期细胞比例减少(t=9.46、8.80、13.50,P < 0.05)。总而言之,照射后H460和A549细胞S期显著降低,说明电离辐射抑制肿瘤细胞增殖,但是联合给予FOXO4-DRI后,S期细胞反而增多,G0/G1期细胞增多,G2/M期细胞减少,提示FOXO4-DRI的辐射增敏作用可能不是通过抑制细胞增殖的信号通路(表 2,3)。
|
|
表 2 FOXO4-DRI或照射对H460细胞周期的影响(%,x±s) Table 2 Effects of FOXO4-DRI or IR on cell cycle of H460 cells(%, x±s) |
|
|
表 3 FOXO4-DRI或照射对A549细胞周期的影响(%,x±s) Table 3 Effects of FOXO4-DRI or IR on cell cycle of A549 cells(%, x±s) |
讨论
放射治疗是一种有效的癌症治疗手段,但辐射抵抗使肺癌患者放疗疗效降低。因此,提高肺癌患者对放射治疗的敏感性成为提升肺癌疗效的关键[10],其中促进肿瘤细胞凋亡是增加放射敏感性的途径之一[11-12]。FOXO4-DRI是一种FOXO4抑制肽,可以通过选择性诱导衰老细胞凋亡有效清除衰老细胞[13-14],而关于FOXO4-DRI在肺癌细胞放射敏感性中的作用研究较少。
本实验用FOXO4-DRI处理NSCLC细胞H460和A549,发现FOXO4-DRI可以显著降低H460细胞和A549细胞活力,这表明单独应用FOXO4-DRI即可以抑制NSCLC细胞增殖。进一步的研究结果提示,FOXO4-DRI可以长时间协同照射抑制癌细胞活力,抑制NSCLC细胞增殖和迁移,增加照射对NSCLC细胞的损伤程度。已有的研究报道,肺癌细胞内FOXO4表达降低是肺癌转移的重要因素之一[15],过表达FOXO4抑制胃癌细胞的增殖和转移[16],提示FOXO4可能是一种抑癌基因。在本研究中,FOXO4-DRI能够引起FOXO4-P53解离,更多的FOXO4被释放出来可能是FOXO4-DRI本身发挥抗肿瘤作用的机制之一,值得进一步研究。
细胞凋亡的结果提示,FOXO4-DRI可以有效增加H460和A549细胞凋亡比例,并能增加辐照诱导的A549和H460细胞凋亡,这可能与FOXO4-DRI选择性清除衰老细胞的作用机制一致[8]。FOXO4-P53解离后,活化的P53被释放到胞浆中启动P53依赖的肿瘤细胞凋亡,但仍需要进一步的研究验证。众所周知,P53是一种肿瘤抑制蛋白,当细胞DNA损伤后, P53基因过度表达[17], P53介导两个主要的DNA损伤依赖的细胞内检定点,G1/S期转换和G2/M期转换,处于G2/M期时细胞的辐射敏感性最强,而S期细胞辐射敏感性最弱[18]。因此,本研究拟进一步确认FOXO4-DRI的抗肿瘤及辐射增敏作用是否与调控细胞周期相关。与已有研究结果一致,射线照射能够抑制H460和A549细胞增殖,降低S期细胞比例,增加G2/M期细胞比例[19]。然而,FOXO4-DRI作用于细胞后,并不能进一步降低S期和增加G2/M期细胞比例;FOXO4-DRI能够引起A549和H460细胞的G0/G1期比例显著增加,提示其抗肿瘤及辐射增敏可能不是通过调控细胞周期G0/G1期起作用,具体的作用机制值得更深一步研究。
综上,本研究证实了FOXO4-DRI自身能抑制肺癌A549和H460细胞增殖和迁移,并能增加细胞放射敏感性,其机制可能是与其促进A549和H460细胞凋亡相关。本研究表明,FOXO4-DRI多肽可能成为NSCLC放射治疗的潜在放射增敏剂,为进一步提高NSCLC的临床放射治疗效果,提供实验依据和理论基础,FOXO4-DRI对NSCLC的相关放射增敏机制还需进行深入研究和探索。
志谢: 感谢中国医学科学院医学与健康创新工程重大项目(2016-I2M-1-017)对本研究的资助
利益冲突 无
作者贡献声明 赵玉负责实验操作、论文撰写;张俊伶、樊赛军负责指导课题设计、论文修改;韩晓丹负责协助实验操作
| [1] |
Ferlay J, Shin HR, Bray F, et al. Estimates of worldwide burden of cancer in 2008:GLOBOCAN 2008[J]. Int J Cancer, 2010, 127(12): 2893-2917. DOI:10.1002/ijc.25516 |
| [2] |
Thomson CS, Forman D. Cancer survival in England and the influence of early diagnosis:what can we learn from recent EUROCARE results?[J]. Br J Cancer, 2009, 101(Suppl 2): S102-109. DOI:10.1038/sj.bjc.6605399 |
| [3] |
Ding X, Cheng J, Pang Q, et al. BIBR1532, a selective telomerase inhibitor, enhances radiosensitivity of non-small cell lung cancer through increasing telomere dysfunction and ATM/CHK1 inhibition[J]. Int J Radiat Oncol Biol Phys, 2019, 105(4): 861-874. DOI:10.1016/j.ijrobp.2019.08.009 |
| [4] |
Xu X, Cao L, Zhang Y, et al. Network analysis of DEGs and verification experiments reveal the notable roles of PTTG1 and MMP9 in lung cancer[J]. Oncol Lett, 2018, 15(1): 257-263. DOI:10.3892/ol.2017.7329 |
| [5] |
Sun C, Li Y, Tan Y, et al. A novel role for NFIA in restoring radiosensitivity in radioresistant NSCLC cells by downregulating the AKT and ERK pathways[J]. Biochem Biophys Res Commun, 2019, 515(4): 558-564. DOI:10.1016/j.bbrc.2019.06.011 |
| [6] |
Zhang F, Fan B, Mao L. Radiosensitizing effects of Cyclocarya paliurus polysaccharide on hypoxic A549 and H520 human non-small cell lung carcinoma cells[J]. Int J Mol Med, 2019, 44(4): 1233-1242. DOI:10.3892/ijmm.2019.4289 |
| [7] |
Wu B, Wang H, Zhang L, et al. High expression of RAD18 in glioma induces radiotherapy resistance via down-regulating P53 expression[J]. Biomed Pharmacother, 2019, 112: 108555. DOI:10.1016/j.biopha.2019.01.016 |
| [8] |
Baar MP, Brandt RMC, Putavet DA, et al. Targeted apoptosis of senescent cells restores tissue homeostasis in response to chemotoxicity and aging[J]. Cell, 2017, 169(1): 132-147. DOI:10.1016/j.cell.2017.02.031 |
| [9] |
Rodier F, Munoz DP, Teachenor R, et al. DNA-SCARS:distinct nuclear structures that sustain damage-induced senescence growth arrest and inflammatory cytokine secretion[J]. J Cell Sci, 2011, 124(Pt 1): 68-81. DOI:10.1242/jcs.071340 |
| [10] |
Chen J, Wang K, Jian J, et al. A mathematical model for predicting the changes of non-small cell lung cancer based on tumor mass during radiotherapy[J]. Phys Med Biol, 2019, 64(23): 235006. DOI:10.1088/1361-6560/ab47c0 |
| [11] |
Luo D, Liu D, Shi W, et al. PPA1 promotes NSCLC progression via a JNK-and TP53-dependent manner[J]. Oncogenesis, 2019, 8(10): 53. DOI:10.1038/s41389-019-0162-y |
| [12] |
Vassilev LT, Sun Q, Guo Y, et al. Therapeutic implications of p53 status on cancer cell fate following exposure to ionizing radiation and the DNA-PK inhibitor M3814[J]. Mol Cancer Res, 2019, 17(12): 2457-2468. DOI:10.1158/1541-7786.Mcr-19-0362 |
| [13] |
Fuhrmann-Stroissnigg H, Santiago FE, Grassi D, et al. SA-beta-galactosidase-based screening assay for the identification of senotherapeutic drugs[J]. J Vis Exp, 2019, 28(148): e58133. DOI:10.3791/58133 |
| [14] |
Krimpenfort P, Berns A. Rejuvenation by therapeutic elimination of senescent cells[J]. Cell, 2017, 169(1): 3-5. DOI:10.1016/j.cell.2017.03.014 |
| [15] |
Li H, Ouyang R, Wang Z, et al. MiR-150 promotes cellular metastasis in non-small cell lung cancer by targeting FOXO4[J]. Sci Rep, 2016, 15(6): 39001. DOI:10.1038/srep39001 |
| [16] |
Su L, Liu X, Chai N, et al. The transcription factor FOXO4 is down-regulated and inhibits tumor proliferation and metastasis in gastric cancer[J]. BMC Cancer, 2014, 14: 378. DOI:10.1186/1471-2407-14-378 |
| [17] |
Levine AJ. p53, the cellular gatekeeper for growth and division[J]. Cell, 1997, 88(3): 323-331. DOI:10.1016/s0092-8674(00)81871-1 |
| [18] |
Pawlik TM, Keyomarsi K. Role of cell cycle in mediating sensitivity to radiotherapy[J]. Int J Radiat Oncol Biol Phys, 2004, 59(4): 928-942. DOI:10.1016/j.ijrobp.2004.03.005 |
| [19] |
Sak A, Fegers I, Groneberg M, et al. Effect of separase depletion on ionizing radiation-induced cell cycle checkpoints and survival in human lung cancer cell lines[J]. Cell Prolif, 2008, 41(4): 660-670. DOI:10.1111/j.1365-2184.2008.00540.x |
 2019, Vol. 39
2019, Vol. 39


