3D放射治疗计划依赖于使用从患者解剖结构的CT得到的3D电子密度图,以评估该解剖结构对剂量分布的影响,这些电子密度图的产生要求使用稳定的校准关系,通过对患者的解剖结构量化X射线束衰减的CT数,可靠地转换成电子密度[1-2]。在CT扫描时,通常使用标准的12位深度图像建立了4 096个CT值,范围从-1 024 HU到3 071 HU,人体的不同组织的CT值都在这个范围,可以通过建立电子密度表来准确的进行转换[3]。然而,由于各种医疗技术的广泛应用,需接受放射治疗的患者中,体内存在各种人工金属植入物的情况也越来越常见,这些金属物质在人体内与组织紧密贴合,在进行CT扫描时就会导致金属植入物周围产生伪影,伪影的产生可能会影响剂量计算。在设计治疗计划时,射野一般会避开金属植入物所在区域,但金属植入物对CT图像造成的伪影同样会对剂量计算造成一定的影响[4]。为了研究单纯伪影对放疗剂量计算的影响,本研究通过人工引入伪影,探讨伪影的存在对不同算法剂量计算结果的影响,为了排除两套计划系统对CT值统计的影响,本研究对两套系统的CT值进行了统计分析。
材料与方法1.设备与仪器:使用上海拓能医疗技术有限公司的头部、肺部仿真模体,钛合金组件购自广东东莞展越金属材料公司,使用荷兰Philips公司大口径CT机,使用美国Varian公司的Eclipse 13.5和Philips的Pinnacle 9.8放射治疗计划系统(TPS)。
2. CT图像获取:对拓能的头部均匀模体和肺部模体进行CT扫描,设为对照组,扫描结束后将模体中心圆柱体组件替换为钛合金后进行扫描,设为伪影组。扫描参数设置,管电压为120 kV、管电流200 mAs、扫描层厚5 mm。
3. CT值采集:应用美国Varian公司Eclipse治疗计划系统进行三维重建。对于头部模体,分别勾画体表至5.5 cm深度处的感兴趣区域,从体表开始每间隔0.5 cm为一个评价区域,伪影组和对照组结构勾画方式保持一致,对这些区域的CT值的平均值进行统计分析。对于肺部模体,选取肺部深度为1.0、2.0和3.0 cm的区域作为研究对象,伪影组和对照组结构勾画方式保持一致,同样对感兴趣区域的CT值进行分析。
4.照射方式:利用单野照射来研究不同深度剂量的变化趋势。采用等中心照射,等中心为钛合金所在区域,对于头部模体,机架角0°,小机头角度0°,射野大小为10 cm×10 cm,源皮距(SSD)为92.5 cm,钛合金区域的处方剂量为60 Gy。肺部模体计划设计,同样采用等中心照射,为了穿过钛合金区域并且为了前端避开肺组织,采用机架角度为245°,小机头角度设置为0°,射野大小10 cm×10 cm,SSD为88.4 cm,钛合金区域的处方剂量为60 Gy。
5.剂量值采集:选取3种不同的剂量计算方法,分别为Varian Eclipse的各向异性分析(anisotropic analytical algorithm,AAA)算法、确定性(acuros XB,AXB)算法和Pinnacle的筒串卷积(collapsed cone convolution,CCC)算法。分别统计伪影组与对照组感兴趣区域的平均剂量,并对剂量进行评估。
6.统计学处理:使用Origin 9.6软件进行绘图、SPSS 20.0软件进行数据分析。两套系统的CT值符合正态分布,采用独立样本t检验,同一套系统的伪影组和对照组采用配对样本t检验。P < 0.05为差异有统计学意义。
结果1. TPS的CT值统计结果:两套TPS的CT值统计结果列于表 1,2。CT值符合正态分布,Pinnacle系统和Eclipse系统对头部模体和肺部模体的CT值统计结果比较,差异没有统计学意义(P>0.05),两套系统的伪影组和对照组的差值比较,差异没有统计学意义(P>0.05)。在相同的位置,伪影组的CT值均大于对照组的CT值,且越远离钛合金组件的区域,CT值偏差越小,但是接近体表的区域的CT值偏差异常增大。
|
|
表 1 不同系统两组头部模体不同深度区域平均CT值(HU) Table 1 CT values averaged on regions at different depths of head phantoms for two TPSs (HU) |
|
|
表 2 不同系统中两组肺部模体不同深度区域平均CT值(HU) Table 2 CT values averaged on regions at different depths of lung phantoms for two TPSs (HU) |
2. 3种算法感兴趣区域的剂量计算:对于均匀模体,对照组AAA、AXB、CCC算法的最大剂量点在1.5 cm附近,而伪影组3种算法的最大剂量点在1.25 cm附近,说明伪影组的建成区减小。对于肺部模体,伪影组3种算法3 cm深度的计算剂量分别为35.1、37.6、34.1 Gy,对照组3种算法3 cm深度处的计算剂量35.6、38.1、35.9 Gy,伪影组的剂量低于对照组的剂量。
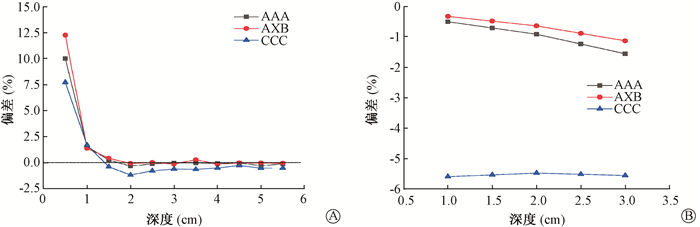
3.伪影组和对照组的剂量差:伪影组和对照组的剂量差分析见图 1。对于头部模体,在距离体表 0~1.5 cm的区域,伪影组的剂量值明显大于对照组的剂量值(t=8.017,P < 0.05),且皮肤表面剂量相差达7.0%~12.0%,距离体表距离1.5 cm之后,伪影组的计算剂量值小于对照组的计算剂量值,相差-1.0%以内。从图 1可知,对于肺部模体,随着深度的增加,肺部组织所沉积的剂量值逐渐减少,且对照组的剂量值大于伪影组的剂量值。Varian的AAA算法和AXB算法的剂量偏差较小约为1.0%,而在Pinnacle的CCC算法下,对照组与伪影组的剂量值差别较大达5.0%。
|
图 1 伪影组和对照组的3种算方法不同深度的剂量差A.头部模体;B.肺部模体 Figure 1 Dose differencesatdifferentdepthsofthe 3 algorithmsbetween artifact group and control group A.Head phantom; B. Lung phantom |
讨论
现代治疗计划基于计算机断层扫描(CT)图像,CT数据与其他成像方式结合用于勾画危及器官和肿瘤,CT值和电子密度的准确转换是准确计算患者剂量的先决条件。在CT扫描数据中,金属植入物或其他高密度的植入物会对CT图像造成一定的失真、伪影,从而影响金属和周围组织的形状和密度的正确表达[5-6]。这些高密度组织不仅阻碍了危及器官和肿瘤的准确勾画,而且由于CT数据形成了错误的密度分布,导致治疗计划系统的剂量分布计算受到影响。此外,由于标准CT扫描仪的数值范围有限,金属植入物的密度值在CT数据中无法正确表示。本研究可知伪影组的CT值均大于对照组的CT值,且越远离钛合金组件的区域,CT值偏差越小,但是接近体表的区域的CT值偏差异常增大,其原因可能是因为对于高密度组织来说,kV级的X射线衰减比较大,造成一定的屏蔽作用,导致kV级的射线对于高密度组织的分辨率比较低,CT值的失真必然对放疗剂量学产生影响[7]。一些研究者研究了有植入物存在时金属植入物表面的剂量变化[5-7],但是伪影对TPS剂量计算的定量影响还少有专门的研究。
本研究利用插入钛合金组件人为的制造伪影环境,利用TPS对替换钛合金组件前后两组放疗计划剂量分布进行了分析对比,证明了金属伪影的存在会导致患者靶区的计算剂量与实际受照射剂量有所偏差[8-9],分析其原因可能是在有伪影存在的情况下,使得患者CT值失真,伪影组的CT值高于对照组的CT值,造成患者组织密度增高的假象,从而在剂量计算时使得表浅区域沉积剂量增多,到达深部区域的照射量减少,导致深部沉积的剂量减少,使得实际照射和计算剂量发生偏差。因此,在射束和靶区之间没有金属植入物而只存在伪影时,就会导致低估深部肿瘤患者靶区受照剂量,导致患者靶区过量照射;而对表浅肿瘤患者进行放射治疗时会高估患者靶区受照剂量,使患者靶区剂量不足,导致肿瘤未控或复发, 特别是表皮肿瘤。而对于有金属植入物的肺部肿瘤来说,伪影组的CT值有一定的增加,但由于肺组织属于低密度区域,CT值增加的相对值比较高,理论上剂量计算影响比较大,Pinnacle的CCC算法偏差较大,剂量偏差可高达5.0%,但无法确定是由于伪影造成的计算偏差,还是算法对于低密度剂量计算本身存在偏差,这还需进一步做详细的研究。但如果射线穿过金属植入物再到达靶区时,由于CT值失真不能正确反应金属植入物的电子密度,导致靶区的计算剂量偏高,而实际照射剂量偏低[10]。
总之,CT值的偏差使得照射野内剂量分布存在明显差异,导致靶区周围组织剂量分布发生变化,可能造成金属植入物周围组织照射剂量不足或过量照射[11]。由于本研究所选材料为均匀模体,而人体组织并非均匀分布,故更为详实的工作有待开展。有研究也通过某些算法来改善伪影的影响,但并不能完全去除[7, 11]。因此,临床上建议对体内植入金属植入物的患者进行放射治疗时不仅要进行植入物区域的剂量修正,还要对伪影进行剂量修正,从而保证放疗质量,减少肿瘤治疗失败率与复发率。
利益冲突 无作者贡献声明 郭瑞嵩负责采集数据、分析数据和论文撰写;邢晓汾参与设计实验;崔桐、张军、彭金鑫参与采集数据和分析数据;褚薛刚负责论文实验设计、论文修改
| [1] |
Kairn T, Crowe SB, Fogg P, et al. The appearance and effects of metallic implants in CT images[J]. Australas Phys Eng Sci Med, 2013, 36(2): 209-217. DOI:10.1007/s13246-013-0197-x |
| [2] |
Hasani M, Farhood B, Ghorbani M, et al. Effect of computed tomography number-relative electron density conversion curve on the calculation of radiotherapy dose and evaluation of Monaco radiotherapy treatment planning system[J]. Australas Phys Eng Sci Med, 2019, 42(2): 489-502. DOI:10.1007/s13246-019-00745-6 |
| [3] |
Gao L, Sun H, Ni X, et al. Effects of 16-bit CT imaging scanning conditions for metal implants on radiotherapy dose distribution[J]. Oncol Lett, 2018, 15(2): 2373-2379. DOI:10.3892/ol.2017.7586 |
| [4] |
Liugang G, Hongfei S, Xinye N, et al. Metal artifact reduction through MVCBCT and kVCT in radiotherapy[J]. Sci Rep, 2016, 6: 37608. DOI:10.1038/srep37608 |
| [5] |
Subhas N, Polster JM, Obuchowski NA, et al. Imaging of arthroplasties:improved image quality and lesion detection with iterative metal artifact reduction, a new CT metal artifact reduction technique[J]. AJR Am J Roentgenol, 2016, 207(2): 378-385. DOI:10.2214/AJR.15.15850 |
| [6] |
Spadea MF, Verburg JM, Baroni G, et al. The impact of low-Z and high-Z metal implants in IMRT:a Monte Carlo study of dose inaccuracies in commercial dose algorithms[J]. Med Phys, 2014, 41(1): 011702. DOI:10.1118/1.4829505 |
| [7] |
Paudel MR, Mackenzie M, Fallone BG, et al. Evaluation of normalized metal artifact reduction (NMAR) in kVCT using MVCT prior images for radiotherapy treatment planning[J]. Med Phys, 2013, 40(8): 081701. DOI:10.1118/1.4812416 |
| [8] |
Axente M, Paidi A, Von Eyben R, et al. Clinical evaluation of the iterative metal artifact reduction algorithm for CT simulation in radiotherapy[J]. Med Phys, 2015, 42(3): 1170-1183. DOI:10.1118/1.4906245 |
| [9] |
Andersson KM, Ahnesjö A, Vallhagen Dahlgren C. Evaluation of a metal artifact reduction algorithm in CT studies used for proton radiotherapy treatment planning[J]. J Appl Clin Med Phys, 2014, 15(5): 4857. DOI:10.1120/jacmp.v15i5.4857 |
| [10] |
Korpics M, Johnson P, Patel R, et al. Metal artifact reduction in cone-beam computed tomography for head and neck radiotherapy[J]. Technol Cancer Res Treat, 2016, 15(6): 88-94. DOI:10.1177/1533034615618319 |
| [11] |
Paudel MR, Mackenzie M, Fallone BG, et al. Clinical evaluation of normalized metal artifact reduction in kVCT using MVCT prior images (MVCT-NMAR) for radiation therapy treatment planning[J]. Int J Radiat Oncol Biol Phys, 2014, 89(3): 682-689. DOI:10.1016/j.ijrobp.2014.02.040 |
 2019, Vol. 39
2019, Vol. 39


