2. 北京大学第三医院肿瘤中心 100191
2. Department of Radiation Oncology, Peking University Third Hospital, Beijing 100191, China
肺为结直肠癌患者的常见转移部位,手术切除为结直肠癌肺内寡转移的首选治疗方式,但是许多患者就诊时丧失了手术机会或因身体原因不能耐受手术治疗,对于这部分患者来说,放射治疗是一种可选的治疗方式。随着放疗技术的不断进步,高剂量率近距离放射治疗(HDR-BT)越来越多地应用于临床,但其在结直肠癌术后复发肺内寡转移中的应用较少,其安全性和有效性还有待于进一步研究。本研究回顾性分析10例无法手术的结直肠癌术后复发肺内寡转移患者,采用192Ir高剂量率近距离放射治疗肺内寡转移,评价其疗效及安全性。
资料与方法1.研究对象:回顾性收集2013年5月至2017年10月河北省沧州中西医结合医院收治的10例有明确病理诊断的结直肠癌术后复发肺内寡转移患者资料,根据欧洲肿瘤内科学会(ESMO)指南定义肺内寡转移为转移病灶≤5个。所有患者均为不能耐受手术治疗或失去手术机会患者,男性患者8例,女性患者2例,平均年龄为58岁(45~70岁);美国东部肿瘤协作组(ECOG)评分0分3例,1分5例,≥2分2例;10例患者共15个病灶,其中6例患者为1个病灶,3例患者为2个病灶,1例患者为3个病灶;4例患者病灶超过1个,其中病灶位于同侧肺者2例,位于双侧肺者1例,同侧肺2个病灶对侧肺1个病灶者1例;15个病灶平均直径为3 cm(1.7~3.8 cm),其中9个病灶(2.3~3.0 cm)使用单根插植针,6个病灶使用2根插植针(3.0~4.5 cm)。
2.CT引导下插植针植入:根据病灶位置选取仰卧或俯卧位,嘱患者平静呼吸,进行CT扫描采集图像,在采集的图像中虚拟插植针的位置,制定术前放疗计划,插植针的位置及数目以保证最终剂量覆盖为目的。对于直径≤3 cm的病灶使用单根插植针,形态较规则的病灶预定位置为病灶中心,形态不规则的病灶则相应移动插植针的位置,对于直径>3 cm且≤4.5 cm的病灶使用2根插植针,插植针的位置及角度由病灶的具体形态决定,计划完成后,铅丝标定穿刺点,2%利多卡因局部麻醉后,由穿刺点进针植入预定位置,考虑到术前计划与实际实施计划可能存在插植针位置偏移,因此,穿刺完成后进行CT扫描验证,确认所有的针都在指定位置。同一患者存在2个及以上肺部转移灶时,位于同侧肺者插植一次性完成,位于双侧肺者插植分两次完成,间隔时间为1周。
3.靶区勾画和治疗计划制定:CT扫描采集层厚3 mm图像传至Oncentra Brachy系统(瑞典医科达公司)。勾画靶区(GTV)及危及器官(OAR),危及器官包括肺、心脏、脊髓、食管、气管。全部勾画完毕后进行三维图像重建,制定放射治疗计划,具体为在目标区域内使用步进为2.5 mm的源驻留位间距,采用192Ir放射源进行后装放射治疗,制定单次剂量20 Gy覆盖90%肿瘤靶区(GTV)的放疗计划,计算机根据处方剂量自动计算出每个驻留位的驻留时间。肿瘤靶区与危及器官计算剂量体积时均转换为等效生物剂量,优化放疗计划。计划制定后实施后装放射治疗,治疗结束后屏住呼吸拔出插植针,随后进行CT扫描确认有无发生气胸、血胸等并发症。结束后予以留院观察24 h。
4.观察指标和疗效评价:主要观察指标为局部控制率(LC)、无进展生存期(PFS)、总生存(OS)、不良事件发生率。放疗结束后定期通过胸部CT等影像学检查进行疗效评价,根据实体肿瘤的疗效评价标准RECIST 1.1版分为肿瘤病灶完全消失(CR)、肿瘤病灶最大单径之和减少30%以上(PR)、肿瘤病灶最大单径之和增加20%或出现新病灶(PD)、肿瘤病灶减小的程度没达到PR,增加的程度也没达到PD水平(SD),CR+PR为有效,CR+PR+SD为LC。LC的开始时间点为治疗开始日期。不良事件评价标准参照CTCAE 5.0中文版。
5.统计学处理:统计分析采用SPSS 16.0软件处理,计数资料采用实际例数及百分比表示。
结果1.疗效评价:1年无治疗LC为93.3%,其中1例患者于6个月复查时疗效评价PD,再次实施近距离放疗后达PR。治疗前后复查胸部CT(图 1)。随访截至2018年3月1日,8例患者死亡,中位PFS为8.5个月,中位OS为14.7个月,见图 2。
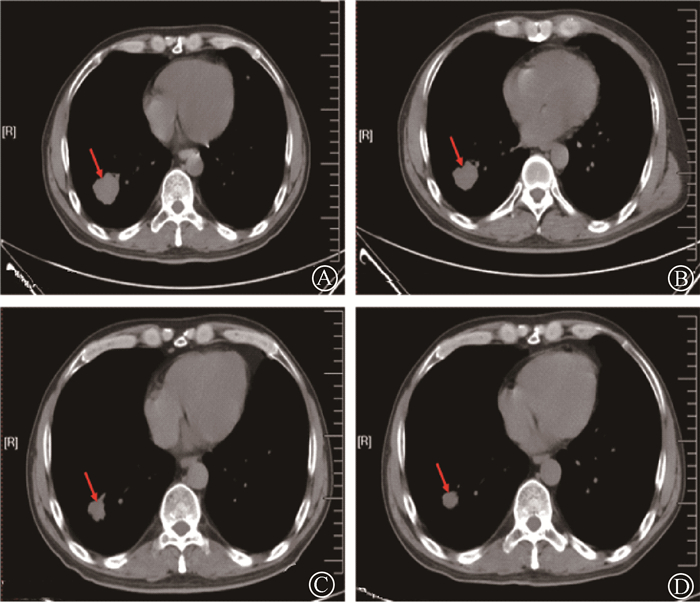
|
注:箭头指示靶病灶位置 图 1 结直肠癌术后复发肺转移患者治疗前后胸部CT图像 A.治疗前;B.治疗后1个月疗效评价SD;C.治疗后6个月疗效评价PR;D.治疗后12个月疗效评价维持PR Figure 1 CT images of patients with recurrent lungmetastases treatment after colorectal cancersurgery A. Before treatment; B. Evaluation of stable disease (SD)after one month; C. Evaluation of progressive disease (PR)after six months after treatment; Evaluation of PR after 12 months |

|
图 2 10例结直肠癌术后复发肺转移患者治疗后无进展生存(PFS)和总生存(OS) Figure 2 Progression-free survival (PFS) and overall survival (OS) of 10 patients with recurrent lung metastases treatment after colorectal cancer surgery |
2.不良事件发生率评估:参照CTCAE 5.0中文版标准,治疗期间及治疗完成后1级不良事件发生率30%,其中1例为轻度咳嗽,2例为痰中带血,所有患者在治疗期间及治疗结束后均未发生严重不良事件。
讨论对于肺部转移病灶预期无法完整切除或因身体原因不能耐受手术的结直肠癌术后肺内寡转移患者来说,探寻有效的治疗手段尤为必要,其中立体定向放射治疗(SBRT)、射频消融术等均取得了一定的疗效[1-2]。近来,随着放疗技术的不断进步,HDR-BT越来越多的应用于临床[3-4],但其在肺转移瘤中的应用还比较有限,其安全性及有效性还需进一步研究。
本研究收集病例采用HDR-BT治疗肺部转移病灶,单次剂量为20 Gy(生物有效剂量BED=131.11 Gy),目前对HDR-BT治疗结直肠癌术后复发肺内寡转移鲜见报道,本研究中照射剂量借鉴于以下两项研究:Peters等[5]采用近距离照射无法手术的肺部恶性病变,单次剂量20 Gy,1年LC为91%;Imamura等[6]报道12例接受高剂量率近距离治疗的外周型非小细胞肺癌患者,其中经皮(20 Gy),经支气管(12.5 Gy×2)治疗,LC为88.9%。本研究采用单次剂量20 Gy照射后1年LC为93.3%,类似于以上两项研究。Brach等[7]使用HDR-BT结合外照射治疗无法手术的肺部恶性病变,具体方式为外照射剂量达到66 Gy后,使用近距离推量10~20 Gy,肿瘤局部控制率为75%,而本研究表明单用近距离放射治疗即取得了更良好的LC。目前,对于无法手术的结直肠癌肺内寡转移患者来说,可选的放射治疗手段除高剂量率近距离放射治疗(HDR-BT)外,还包括立体定向放射治疗(SBRT)。Wang等[8]采用SBRT治疗结直肠癌肺转移患者1年局部无复发生存期为80.6%,并经单变量分析发现采用较高剂量(BED=132 Gy)治疗的结直肠癌肺转移患者比低剂量治疗(BED≤105.6 Gy)有更好的局部无复发生存率,其中较高剂量治疗1年局部无复发生存率为88.9%。本研究结果显示,1年局部控制率为93.3%,结果与之相似。Li等[9]利用SBRT治疗结直肠癌术后肺转移患者,处方剂量为50 Gy(BED=100 Gy),结果显示治疗后1年局部控制率>80%,中位生存期分别为11.5个月。本研究结果显示中位PFS为8.5个月,中位OS为14.7个月。Franzese等[10]利用SBRT技术在270名结直肠癌患者中治疗了437例转移灶,其中肺部转移部位占48.5%,肝脏转移灶36.4%,在SBRT之前对199名患者(73.7%)进行全身治疗,1年、3年、5年LC分别为95%,73%和73%,中位PFS为8.6个月,1年、3年、5年OS分别为88.5%,56.6%和37.2%,其1年LC及中位PFS与本研究结果类似,OS明显高于本研究,分析原因可能是上述研究中患者均为初治病例并配合全身治疗,而本研究中患者均为结直肠癌术后复发难治病例,从某种程度上来说,治疗敏感性降低,治疗难度增加。
HDR-BT与SBRT相比,可以将高剂量集中于局部肿瘤区域,并具有剂量快速下降从而减少对周围正常肺组织损伤的优点[11-12],因此具有良好的应用前景。同时HDR-BT有剂量分布不均的弊端,即中心区域相对剂量高,边缘区域剂量迅速跌落。事实证明这种剂量不均匀性在肺部转移灶的治疗中是有利的,肿瘤中心区域肿瘤组织相对乏氧,接受的剂量相对较高,肿瘤边缘区域肿瘤组织氧含量相对较高,剂量较低。
本研究中1级不良事件发生率为30%,未见严重不良事件发生。与Brach等[7]研究中30%的患者出现了明显的气胸结果不同,可能与其先采用外照射治疗后局部近距离推量使得肺组织损伤有关。而Ricke等[13]首次单纯使用肺插植照射肺部恶性病变患者,单次剂量为肿瘤边缘20 Gy,1级不良事件发生率为7%,未见严重不良事件发生,其中1级不良事件发生率低于本研究,这可能是与以上研究中病灶平均直径均小于3 cm,而本研究中平均直径为3 cm,并且其中4例超过3 cm的患者均使用2根插植针,可能增加了不良反应的发生。
综上所述,对于结直肠癌术后复发肺内寡转移患者来说,HDR-BT取得了较好的LC、PFS及OS,并且不良事件发生率低且轻微,具有巨大的潜在优势,但现有研究数据较少,尚需进一步的研究。
利益冲突 本研究由署名作者按以下贡献声明独立开展,不涉及任何利益冲突,排名无争议作者贡献声明 尹晓明负责数据分析和论文撰写;孙云川负责研究设计并指导论文修改;胡婷婷,何新颖、毕建强、肖丽、黄如敬提供了入组病例;鲁洪岭完成了本研究中的有创性操作;王俊杰参与修改论文
| [1] |
Sharma A, Duijm M, Oomen-de Hoop E, et al. Survival and prognostic factors of pulmonary oligometastases treated with stereotactic body radiotherapy[J]. Acta Oncol, 2019, 58(1): 74-80. DOI:10.1080/0284186X.2018.1521986 |
| [2] |
Hiyoshi Y, Miyamoto Y, Kiyozumi Y, et al. CT-guided percutaneous radiofrequency ablation for lung metastases from colorectal cancer[J]. Int J Clin Oncol, 2019, 24(3): 288-295. DOI:10.1007/s10147-018-1357-5 |
| [3] |
Abe K, Kadoya N, Sato S, et al. Impact of a commercially available model-based dose calculation algorithm on treatment planning of high-dose-rate brachytherapy in patients with cervical cancer[J]. J Radiat Res, 2018, 59(2): 198-206. DOI:10.1093/jrr/rrx081 |
| [4] |
Safigholi H, Meigooni AS, Song WY. Comparison of 192Ir, 169Yb, and 60Co high-dose rate brachytherapy sources for skin cancer treatment[J]. Med Phys, 2017, 44(9): 4426-4436. DOI:10.1002/mp.12335 |
| [5] |
Peters N, Wieners G, Pech M. CT-guided interstitial brachytherapy of primary andsecondary lung malignancies:results of a prospective phase Ⅱ trial[J]. Strahlenther Onkol, 2008, 184(6): 296-301. DOI:10.1007/s00066-008-1718-5 |
| [6] |
Imamura F, Ueno K, Kusunoki Y, et al. High-dose-rate brachytherapy for small-sized peripherally located lung cancer[J]. Strahlenther Onkol, 2006, 182(12): 703-707. DOI:10.1007/s00066-006-1536-6 |
| [7] |
Brach B, Buhler C, Hayman MH, et al. Percutaneous computed tomography-guided fine needle brachytherapy of pulmonary malignancies[J]. Chest, 1994, 106(1): 268-274. DOI:10.1378/chest.106.1.268 |
| [8] |
Wang X, Zamdborg L, Ye H, et al. A matched-pair analysis of stereotactic body radiotherapy (SBRT) for oligometastatic lung tumors from colorectal cancer versus early stage non-small cell lung cancer[J]. BMC Cancer, 2018, 18(1): 962. DOI:10.1186/s12885-018-4865-9 |
| [9] |
Li J, Zhang L, Xie Q, et al. Comparison of clinical efficacy and complications of 125I seed brachytherapy and stereotactic body radiation therapy for recurrent pulmonary metastases from colorectal carcinoma[J]. J Contemp Brachytherapy, 2018, 10(4): 360-367. DOI:10.5114/jcb.2018.77956 |
| [10] |
Franzese C, Comito T, Toska E, et al. Predictive factors for survival of oligometastatic colorectal cancer treated with Stereotactic body radiation therapy[J]. Radiother Oncol, 2019, 133: 220-226. DOI:10.1016/j.radonc.2018.10.024 |
| [11] |
Chan MK, Lee VW, Kadoya N, et al. Single fraction computed tomography-guided high-dose-rate brachytherapy or stereotactic body radiotherapy for primary and metastatic lung tumors?[J]. J Contemp Brachytherapy, 2018, 10(5): 446-453. DOI:10.5114/jcb.2018.79335 |
| [12] |
杨波, 孙小杨, 庞皓文, 等. 肺癌插植放疗中插植针排列规则对肺受量影响研究[J]. 中华放射肿瘤学杂志, 2017, 26(12): 1417-1420. Yang B, Sun XY, Pang HW, et al. Effect of needle arrangement on the lung dose in interstitial brachytherapy for lung cancer[J]. Chin J Radiat Oncol, 2017, 26(12): 1417-1420. DOI:10.3760/cma.j.issn.1004-4221.2017.12.013 |
| [13] |
Ricke J, Wust P, Wieners G, et al. CT-guided interstitial single-fraction brachytherapy of lung tumors:phase Ⅰ results of a novel technique[J]. Chest, 2005, 127(6): 2237-2242. DOI:10.1378/chest.127.6.2237 |
 2019, Vol. 39
2019, Vol. 39


