在精确放疗中,CT因能提供用于剂量计算的解剖和电子密度可靠信息而成为放射治疗计划的基石,但CT图像的软组织分辨率较差,所以在软组织以及中枢神经系统等部位肿瘤的勾画常常需要借助磁共振成像(MRI)影像[1-2]。因此,将MRI诊断影像(MRIdiag)与CT模拟定位影像进行匹配融合是以往常用的靶区勾画手段,但常受限于两者不同体位和扫描方式而影响融合精准性,所勾画靶区及其剂量的精准性亦受到质疑[3-4]。近年来,放疗专用的MRI模拟定位机逐渐在大型肿瘤中心出现,患者可以在治疗体位以及治疗固定装置下进行扫描,相同的体位以及专用的扫描方式给影像融合带来了更多的便捷,但融合的精准性评估却少有报道。因此,本研究旨在头、头颈部、盆腔3个部位肿瘤放疗中将MRI模拟定位(MRIsim)和MRIdiag影像分别与模拟CT影像融合比较,从几何影像和剂量学两方面来定性定量评估MRIsim影像与CT融合的精准性,为MRIsim在放疗中的进一步应用提供参考。
资料与方法1.一般临床资料:选择苏州大学附属第二医院放疗科2017年5月至2018年5月期间行MRI模拟定位且近期(≤10 d)又有同部位诊断MRI的患者24例,其中脑胶质瘤、鼻咽癌和前列腺癌各8例。所有患者中位年龄58岁(7~80岁),男性16例,女性8例。脑胶质瘤患者中有6例为世界卫生组织(WHO)分级Ⅲ级,2例为WHO Ⅱ级;鼻咽癌患者中T2、T3、T4分别有5、2和1例;前列腺癌患者中T2有6例,T3、T4各1例。
2.模拟定位:所有患者均采用美国CIVICO公司提供的CT和MRI兼容的固定装置。其中,脑胶质瘤、鼻咽癌和前列腺癌患者分别采用头架、头颈肩固定架和体部固定架。所有患者先在美国通用公司的CT590大孔径模拟定位机扫描CT影像(静脉增强造影),层厚为2.5 mm。1~2 d后在荷兰Philips公司Ingenia 3.0T MR-RT行MRI定位。MRI模拟定位的流程、扫描序列以及质量控制参考文献[5-8]。定位时患者治疗体位使用固定体架躺在CIVICO MRI专用平板床上。脑胶质瘤患者采用两片Flex灵活线圈贴在热塑膜外固定,鼻咽癌和前列腺癌患者均采用体部线圈放置在线圈桥架上。所有患者采用3D且不设置角度的扫描方法,层厚与CT模拟定位一致均为2.5 mm,扫描范围与CT模拟定位一致,即脑胶质瘤患者为头顶至颈1椎体,鼻咽癌患者为头顶至气管分叉水平,前列腺癌患者为腰4椎体下缘至会阴下2 cm水平。
3.图像融合:所有患者的图像融合由同一名高年资计划师操作完成。将每位患者的CT模拟影像、MRI模拟影像以及医院影像归档和通讯系统(PACS)网络中的诊断MRI影像分别传至Pinnacle 9.0(美国Philips Radiation Oncology, Fitchburg)计划系统进行影像融合。采用刚性匹配方法分别将CT与MRIsim、CT与MRIdiag融合。影像融合时首先将两影像进行手工粗略匹配,然后采用基于算法的全图像的自动融合,观察各个解剖器官的重叠情况后必要时作手动调整。最后将感兴趣区域设置在肿瘤区域进行微调,以手动调整为主,当肿瘤区域的解剖结构最大程度地匹配时融合工作完成。鼻咽癌患者影像融合时感兴趣区域设置在鼻咽部,当鼻咽部解剖结构最大程度地匹配时融合工作完成。
4.靶区和危及器官(OAR)勾画以及计划设计:基于每位患者的CT和MRIsim融合影像(F_CTMsim)以及CT和MRIdiag融合影像(F_CTMdiag)勾画靶区,鼻咽癌患者的颈部淋巴引流区则按照CT影像勾画。所有前列腺癌患者仅照射前列腺(和精囊腺)靶区。每位患者的OAR是分别基于CT、MRIsim和MRIdiag影像进行勾画的,选择容易勾画、生理性运动小以及受勾画者主观因素影响较小的OAR进行比较。脑胶质瘤计划选择眼球、脑干和全脑;鼻咽癌计划选择眼球、脑干、全脑和脊髓;前列腺癌计划选择盆骨。按照基于F_CTMsim融合影像勾画的靶区以及基于CT勾画的OAR设计治疗计划,其中针对脑胶质瘤患者设计5~7野共面或非共面计划、鼻咽癌患者设计9野共面计划、前列腺癌患者设计7野共面计划,所有计划根据QUANTEC限量要求来限制OAR的剂量[9]。
5.影像融合精准性评估:①基于CT、MRIsim和MRIdiag影像所勾画OAR体积值的比较。②OAR轮廓的相似性比较[4, 10-11]。一致性指数(CI)CI=(A∩B)/(A∪B);形似性指数(DSC)DSC=2(A∩B)/(A+B)。其中A和B是相比较的两个轮廓。③图像相似性指数S,S=
6.统计学处理:采用SPSS 19.0软件进行统计分析。计量资料符合正态分布则数据用x±s表示,两组数据间的差异采用配对t检验。P < 0.05为差异有统计学意义。
结果1. OAR的体积和剂量学:脑胶质瘤、鼻咽癌和前列腺癌患者基于CT、MRIsim和MRIdiag影像的OAR体积中位值见表 1。除了鼻咽癌患者的全脑和前列腺癌患者的盆骨外,其余OAR基于3种图像的体积值无明显差异(P>0.05),前列腺癌患者中基于CT勾画的盆骨体积明显大于MRIsim和MRIdiag所勾画的体积(t=4.28、3.51,P < 0.05),MRIsim和MRIdiag之间盆骨体积无差异。基于F_CTMsim的靶区和CT的OAR所设计适形调强放疗(IMRT)计划的3种OAR(基于CT、MRIsim和MRIdiag)的剂量见表 1。在3个部位患者中的OAR均无明显差异。
|
|
表 1 基于CT、MRIsim和MRIdiag影像的OAR体积值和剂量学比较(x±s) Table 1 Comparison of volume and dosimetry of OARs based on CT, MRIsim and MRdiag images(x±s) |
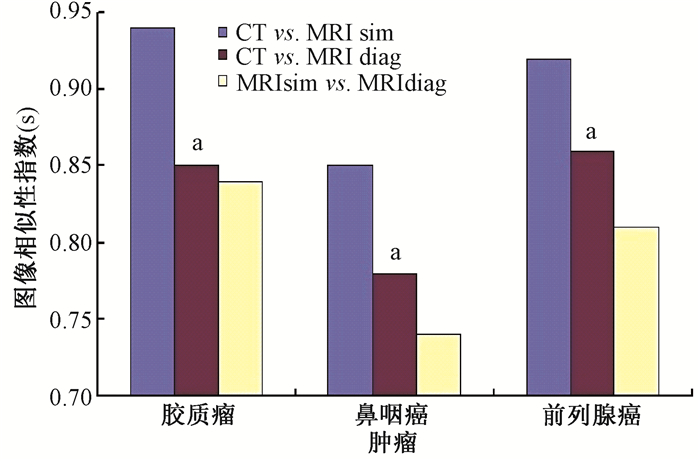
2. OAR的一致性指数CI、形似指数DSC以及图像相似性指数S:如表 2所示,在脑胶质瘤、鼻咽癌和前列腺癌患者中,MRIsim 50%的OAR与CT比较的CI和DSC值均高于MRIdiag与CT比较的CI和DSC值(t=2.58~5.47, P < 0.05)。24例患者MRIsim与CT比较的S值高于MRIdiag与CT比较的S值(0.89 vs. 0.83,t=5.77, P < 0.05),且高于MRIsim与MRIdiag比较的S值(0.89 vs. 0.80, t=6.81, P < 0.05);MRIdiag与CT比较的S值和MRIsim与MRIdiag比较的S值差异无统计学意义(0.83 vs. 0.80, P>0.05)。相对于MRIdiag,MRIsim改善了S值10%(2%~56%)。在脑胶质瘤、鼻咽癌和前列腺癌患者中的S值见表 2。相对于MRIdiag,MRIsim改善了S值10%、9%和10%。其中脑胶质瘤、前列腺癌患者MRIsim与CT比较的S值均高于鼻咽癌患者(t=4.18、2.72, P < 0.05,图 1)。
|
|
表 2 OAR的一致性指数CI、形似性指数DSC和图像相似性指数S Table 2 The concordance index (CI), Dice′s similarity coefficient (DSC) of OARs and image similarity index (S) |
|
注:a与CT与MRIsim融合的S值比较,t=3.18、3.08、3.66,P < 0.05 图 1 3个部位中MRIsim与CT、MRIdiag与CT以及MRIsim与MRIdiag的图像相似性指数(S) Figure 1 The image similarity index (S) for MRIsim compared with CT, MRIdiag compared with CT and MRIsim compared with MRIdiag in three tumors |
3.靶区的体积和剂量:基于F_CTMsim和F_CTMdiag所勾画靶区的体积值和剂量学比较在脑胶质瘤、鼻咽癌、前列腺癌中,F_CTMsim靶区的体积中位值均略小于F_CTMdiag靶区,但差异无统计学意义(P>0.05)。F_CTMsim和F_CTMdiag各肿瘤靶区之间的Dmax、Dmin、和VDT差异均无统计学意义(P>0.05)。
4.靶区的一致性指数CI、形似性指数DSC:24例患者基于F_CTMsim和F_CTMdiag靶区的CI、DSC分别为0.95、0.98。其中胶质瘤患者CTV为0.94、0.97;PTV为0.96、0.98。鼻咽癌患者GTVnx、GTVnd、PGTVnx和PGTVnd分别为0.89、0.94;0.93、0.96;0.93、0.96;0.95、0.98。前列腺癌患者CTV、PTV分别为0.95、0.98;0.97、0.98。
讨论以往的一些研究已经证实了在治疗体位下扫描MRI的重要性,如有研究认为头颈部肿瘤GTV勾画的金标准是采用治疗体位的MRI与模拟CT进行融合[12-14]。近年来MRIsim技术的发展使MRI已经深度参与至放疗之中,因此从几何学及剂量学方面来定性定量评估不同部位MRIsim影像与CT融合的精准性对临床具有重要指导意义。
本研究把模拟CT影像作为基准,用刚性匹配方法将MRIsim和MRIdiag影像分别与之融合,用一致性指数CI和形似性指数DSC分别评估两者与CT之间各个OAR的重叠情况;用图像相似性指数S评估两者与CT之间影像的重叠情况。体积值是比较OAR差异的最简单且应用最广泛的方法,其优势是产生的连续变量可以直接进行简单的统计分析,但缺点是不能进行空间比较。CI代表了两个轮廓中共同体积所占的比例,值越接近于1说明两轮廓的一致性越好。DSC的原理与CI相似,但其值一般略高于CI[10]。关于最佳DSC值没有明确的共识,但有研究认为>0.7时被认为是在轮廓之间具有极好的一致性[15]。图像相似性指数S是基于图像所有OAR的CI和DSC对两组图像相似性的综合评估,S值越接近1,两图像的相似性越好。
结果显示,基于MRIsim和MRIdiag所勾画OAR与CT相比,有75%的OAR体积值无明显差异。MRIsim的所有OAR与CT比较的CI和DSC值均高于MRIdiag,进一步计算的图像相似性指数S也显示,MRIsim与CT比较的S值明显高于MRIdiag。这足以证明在入组的患者中,MRIsim与CT匹配融合的精准性明显高于MRIdiag。
在脑胶质瘤、鼻咽癌和前列腺癌3个肿瘤部位中,MRIsim与CT匹配融合的精准性较MRIdiag均有改善(10%、9%和10%),其中胶质瘤(头部)和前列腺癌(盆腔)部位的S值均明显高于鼻咽癌。在鼻咽癌患者(头颈部)中的OAR如眼球、脑干、大脑的CI值均小于头部OAR,尤其是头颈部脊髓OAR的CI值(0.58)明显低于同一部位的其他OAR(0.78~0.98)。这可能是头颈部患者较大的分次间摆位不确定性引起的[16-17]。本研究使用的头颈肩固定系统包括头枕和固定热塑模,对头部有较好的固定,但对颈部的固定性则相对较差,且头部和颈部可以作相对独立的运动。因此,有研究显示头颈部患者使用头颈肩模的摆位重复性较头模没有优势[18]。
相对于MRIdiag,MRIsim不仅可以改善与CT匹配融合的精准性,有研究显示,其采用的放疗体位和固定系统还可以减少运动伪影引起的影像质量受损以及改善体位的重复性[19]。因此MRIsim对于随后的靶区勾画、治疗计划设计和基于MRI适应性计划的修正具有重要意义。
Hanvey等[14]针对22例口咽癌患者的研究显示,相比于MRIdiag,采用放疗体位的MRI影像可以明显改善与CT融合的精准性和PTV剂量覆盖,该研究采用刚性匹配时将口咽作为中心、使用全自动且不进行人为干预的融合方式,认为人工干预会引入主观影响因素。本研究MRIsim改善融合精准性的结果与Hanvey等[14]的研究相一致,但本研究采用全自动刚性匹配及手工调整的融合方式,将肿瘤区作为感兴趣区域(鼻咽癌患者将鼻咽部作为感兴趣区域),优点是减少了靶区勾画的差异性,但缺点是融合受操作者的经验所影响。为尽量减少融合结果受主观因素的影响,本研究中所有图像的融合由同一名高年资计划师操作完成。
Sabater等[20]选择15例前列腺癌患者,用平板床和曲面床方式分别扫描MRI得到MRI平板床(Flat)、MRI曲面床(Curve),用刚性匹配(RIR)和形变匹配(DIR)方法分别与模拟CT融合后得到的IMRT计划比较显示,在FlatRIR与CurveRIR计划之间或FlatRIR与CurveDIR计划之间没有剂量学差异,并认为用于诊断的MRI曲面床影像在放疗中的应用是可行的。该研究中MRI曲面床影像是指MRI平板床影像扫描结束后立即更换为曲面床并进行的MRI诊断序列的扫描。但各个肿瘤中心的MRIdiag影像在扫描体位、与模拟CT的间隔时间、扫描序列以及扫描范围等情况都不尽相同,因此,MRIdiag影像在放疗中的应用应根据各个单位自身的实际情况。同时应注意MRIdiag影像与模拟CT的间隔时间,如果太长则可能会有肿瘤进展而不适用于放疗靶区的勾画。本研究选择的MRIdiag是源于本单位影像科上传至医院PACS系统的常规诊断图像,将其与模拟CT的间隔时间控制在≤10 d是本研究筛选患者的一个条件。
刚性匹配是最常用的方法,所涉及的变换是影像整体旋转和平移,其局限性是在体位或体表轮廓相差较大的两组图像中不能很好地匹配,需要设置感兴趣区域甚至进行人工调节。特别是在鼻咽癌患者中鼻咽部和颈部位置关系的刚性相对较差。本研究均以鼻咽部作为感兴趣进行自动匹配和人工调节。而非刚性变换也称DIR,影像中每个体素都可以独立位移。以往的研究显示形变匹配方法可以改善匹配的精准性[21-23]。但是最近一项国际性的研究共识建议在脑、头颈、前列腺和宫颈部位的CT与MRI定位影像匹配时使用刚性匹配方法[6]。本研究限于Pinnacle 9.0系统仅提供的刚性匹配工具,基于形变匹配方法的MRIsim、MRIdiag与CT的融合精准性有待进一步研究。
综上所述,相对于MRIdiag,将MRIsim引入放疗与模拟CT融合可以明显改善影像匹配的精准性。两者基于刚性匹配、肿瘤区域手动调整方法所勾画的靶区之间没有剂量学差异。
志谢 感谢苏州市民生科技项目(SYSD2018101)和苏州市临床医学中心建设项目(Szzxj201503)对本研究的支持利益冲突 无
作者贡献声明 顾莹负责收集病例资料、采集和分析数据、起草论文;邢鹏飞、蔡尚负责靶区和危及器官的勾画;钱建军负责图像融合和论文修改;范秋虹负责靶区和危及器官勾画的审核;田野负责研究设计
| [1] |
张全彬, 张书旭, 林生趣. 磁共振成像技术应用于肿瘤放射治疗的进展[J]. 中华放射医学与防护杂志, 2016, 36(4): 316-320. Zhang QB, Zhang SX, Lin SQ. Progress of magnetic resonance imaging in radiotherapy for cancer[J]. Chin J Radiol Med Prot, 2016, 36(4): 316-320. DOI:10.3760/cma.j.issn.0254-5098.2016.04.018 |
| [2] |
朱超华, 夏邦传, 韦春姣, 等. 鼻咽癌放射治疗定位的CT/MRI图像配准辅助装置的研究[J]. 中华放射医学与防护杂志, 2016, 36(11): 832-836. Zhu CH, Xia BC, Wei CJ, et al. Development of nasopharyngeal carcinoma radiotherapy positioning of CT/MRI image registration auxiliary device[J]. Chin J Radiol Med Prot, 2016, 36(11): 832-836. DOI:10.3760/cma.j.issn.0254-5098.2016.11.007 |
| [3] |
任雯廷, 陈辛元, 戴建荣. 磁共振放疗模拟定位技术应用现状与问题[J]. 中华放射肿瘤学杂志, 2015, 24(1): 93-96. Ren WT, Chen XY, Dai JR. Status and problems of application of magnetic resonance simulation in radiotherapy[J]. Chin J Radiat Oncol, 2015, 24(1): 93-96. DOI:10.3760/cma.j.issn.1004-4221.2015.01.025 |
| [4] |
Chuter R, Prestwich R, Bird D, et al. The use of deformable image registration to integrate diagnostic MRI into the radiotherapy planning pathway for head and neck cancer[J]. Radiother Oncol, 2017, 122(2): 229-235. DOI:10.1016/j.radonc.2016.07.016 |
| [5] |
Paulson ES, Erickson B, Schultz C, et al. Comprehensive MRI simulation methodology using a dedicated MRI scanner in radiation oncology for external beam radiation treatment planning[J]. Med Phys, 2015, 42(1): 28-39. DOI:10.1118/1.4896096 |
| [6] |
Paulson ES, Crijns SP, Keller BM, et al. Consensus opinion on MRI simulation for external beam radiation treatment planning[J]. Radiother Oncol, 2016, 121(2): 187. DOI:10.1016/j.radonc.2016.09.018 |
| [7] |
Liney GP, Moerland MA. Magnetic resonance imaging acquisition techniques for radiotherapy planning[J]. Semin Radiat Oncol, 2014, 24(3): 160-168. DOI:10.1016/j.semradonc.2014.02.014 |
| [8] |
Devic S. MRI simulation for radiotherapy treatment planning[J]. Med Phys, 2012, 39(11): 6701-6711. DOI:10.1118/1.4758068 |
| [9] |
Marks LB, Yorke ED, Jackson A, et al. Use of normal tissue complication probability models in the clinic[J]. Int J Radiat Oncol Biol Phys, 2010, 76(3): S10-S19. DOI:10.1016/j.ijrobp.2009.07.1754 |
| [10] |
Hanna GG, Hounsell AR, O'Sullivan JM. Geometrical analysis of radiotherapy target volume delineation:a systematic review of reported comparison methods[J]. Clin Oncol, 2010, 22(7): 515-525. DOI:10.1016/j.clon.2010.05.006 |
| [11] |
Feuvret L, Noël G, Mazeron JJ, et al. Conformity index:a review[J]. Int J Radiat Oncol Biol Phys, 2006, 64(2): 333-342. DOI:10.1016/j.ijrobp.2005.09.028 |
| [12] |
Webster GJ, Kilgallon JE, Ho KF, et al. A novel imaging technique for fusion of high-quality immobilised MR images of the head and neck with CT scans for radiotherapy target delineation[J]. Br J Radiol, 2009, 82(978): 497-503. DOI:10.1259/bjr/50709041 |
| [13] |
Brunt JN. Computed tomography-magnetic resonance image registration in radiotherapy treatment planning[J]. Clin Oncol, 2010, 22: 688-97. DOI:10.1016/j.clon.2010.06.016 |
| [14] |
Hanvey S, McJury M, Tho LM, et al. The influence of MRI scan position on patients with oropharyngeal cancer undergoing radical radiotherapy[J]. Radiat Oncol, 2013, 8: 129. DOI:10.1186/1748-717X-8-129 |
| [15] |
Zijdenbos AP, Dawant BM, Margolin RA, et al. Morphometric analysis of white matter lesions in MR images:method and validation[J]. IEEE Trans Med Imaging, 1994, 13(4): 716-724. DOI:10.1109/42.363096 |
| [16] |
Zhang L, Garden AS, Lo J, et al. Multiple regions-of-interest analysis of setup uncertainties for head-and-neck cancer radiotherapy[J]. Int J Radiat Oncol Biol Phys, 2006, 64(5): 1559-1569. DOI:10.1016/j.ijrobp.2005.12.023 |
| [17] |
陈杰, 张文学, 王克强, 等. 配合度较差鼻咽癌患者VMAT摆位误差及靶区外扩距离的研究[J]. 中华放射肿瘤学杂志, 2016, 25(9): 971-974. Chen J, Zhang WX, Wang KQ, et al. Volumetric modulated arc therapy for nasopharyngeal carcinoma patients with poor compliance:setup error and expansion margin of target volume[J]. Chin J Radiat Oncol, 2016, 25(9): 971-974. DOI:10.3760/cma.j.issn.1004-4221.2016.09.015 |
| [18] |
Sharp L, Lewin F, Johansson H, et al. Randomized trial on two types of thermoplastic masks for patient immobilization during radiation therapy for head-and-neck cancer[J]. Int J Radiat Oncol Biol Phys, 2005, 61(1): 250-256. DOI:10.1016/j.ijrobp.2005.03.019 |
| [19] |
Ding Y, Mohamed AS, Yang J, et al. Prospective observer and software-based assessment of magnetic resonance imaging quality in head and neck cancer:should standard positioning and immobilization be required for radiation therapy applications?[J]. Pract Radiat Oncol, 2015, 5(4): e299-e308. DOI:10.1016/j.prro.2014.11.003 |
| [20] |
Sabater S, Pastor-Juan MdR, Berenguer R, et al. Analysing the integration of MR images acquired in a non-radiotherapy treatment position into the radiotherapy workflow using deformable and rigid registration[J]. Radiother Oncol, 2016, 119(1): 179-184. DOI:10.1016/j.radonc.2016.02.032 |
| [21] |
Fortunati V, Verhaart RF, Verduijn GM, et al. MRI integration into treatment planning of head and neck tumors; Can patient immobilization be avoided?[J]. Radiother Oncol, 2015, 115(2): 191-194. DOI:10.1016/j.radonc.2015.03.021 |
| [22] |
Leibfarth S, Mönnich D, Welz S, et al. A strategy for multimodal deformable image registration to integrate PET/MR into radiotherapy treatment planning[J]. Acta Oncol, 2013, 52(7): 1353-1359. DOI:10.3109/0284186X.2013.813964 |
| [23] |
Piper JW. SU-FF-I-68:Evaluation of an intensity-based free form deformable registration algorithm[J]. Med Phys, 2007, 34(6): 2353-2354. |
 2019, Vol. 39
2019, Vol. 39


