2. 南京医科大学附属常州市第二人民医院放疗科, 常州 213003;
3. 苏州大学附属第一医院放疗科 215006
2. Department of Radiation Oncology, Changzhou Second People's Hospital Affiliated to Nanjing Medical University, Changzhou 213003, China;
3. Deparment of Radiation Oncology, The First Affiliated Hospital of Soochow University, Suzhou 215006, China
宫颈癌是全球女性发病率第4位的恶性肿瘤[1],2015年中国新发病例数约9.9万,病死人数约为3.1万[2]。放射治疗是宫颈癌主要治疗手段之一,调强放疗(IMRT)因具有放射剂量学的优势,有着更好的肿瘤局部控制率和生存率以及更低的放疗不良反应等优点[1, 3],正逐步替代常规放疗被广泛应用。同期放化疗联合后装治疗是目前局部晚期宫颈癌标准治疗措施[4-5]。同期化疗方案的选择、是否行腹主动脉旁淋巴结(PALN)引流区预防性放疗、序贯化疗的价值和正常组织的保护等,是目前宫颈癌非手术治疗的研究热点。本研究回顾性分析了422例调强放疗加后装治疗±化疗的宫颈癌患者的不良反应和生存情况,并对影响预后的因素进行分析。
资料与方法1.临床资料:收集2010年6月1日至2018年6月30日徐州医科大学附属江阴临床学院、常州市第二人民医院和苏州大学附属第一医院行根治性放疗的宫颈癌患者422例。入选标准:①病理确诊的宫颈癌初始治疗。②影像学检查未见远处转移。③血常规、肝功能等检查基本正常,脏器功能基本正常。④功能状态(PS)评分≤2分。排除标准:①妊娠期患者。②有放疗禁忌。③伴有其他恶性肿瘤或有恶性肿瘤病史。临床资料见表 1。
|
|
表 1 422例宫颈癌患者一般资料 Table 1 Characteristics of 422 cervical carcinoma patients |
2.治疗方法:所有患者均采用调强放疗+后装照射±化疗治疗方式。①外照射:靶区包括宫颈、宫体、宫旁、上1/3阴道(根据肿瘤侵犯阴道情况行相应调整,至少距离肿瘤下缘3 cm),淋巴结引流区包括髂总、髂外、髂内、闭孔、骶前等区域,ⅢA期患者包含双侧腹股沟淋巴引流区。PALN引流区预防性放疗:上界至左肾静脉下缘,下界与盆腔野衔接。处方剂量:剂量45~50 Gy/25次,每次1.8~2.0 Gy,常规分割;影像学检查短径≥10 mm的肿大淋巴结加量4~8 Gy/2~4次,常规分割。②后装治疗:采用高剂量率192Ir后装治疗机(山东新华医疗器械股份有限公司),常规于外照射15次后进行(如中期复查肿瘤仍>4 cm则推迟1~2周进行),以A点为剂量参考点,总剂量21~42 Gy,5~7Gy/次,1~2次/周,治疗当日不行外照射。③化疗方案:诱导化疗和序贯化疗采用两药联合方案,其中紫杉醇+铂类274例,多西紫杉醇+铂类19例,氟尿嘧啶+铂类13例,吉西他滨+顺铂32例。化疗1~7个疗程。同期化疗单药周剂量159例,其中顺铂62例、卡铂24例、奈达铂73例;两药化疗194例,其中同期1程127例、同期2程67例,方案与诱导或序贯化疗相同。
3.评价标准和随访:不良反应评价,急性放疗不良反应按照美国肿瘤放射治疗协作组急性放射损伤分级标准评定;化疗不良反应根据美国癌症研究所常用药物毒性标准(V3.0版)评定。疗效评价,按实体瘤疗效评价标准(RECIST 1.1版)评价肿瘤近期疗效。放疗结束后1个月评估近期疗效,评估方式为胸腹部CT、盆腔MR、经阴道超声和妇科检查等。随访为前2年内每3个月随访1次,之后每半年随访1次;随访截止时间为2019年7月31日,中位随访时间42个月。
4.统计学处理:采用SPSS 23.0统计软件包进行数据分析,计数资料比较采用χ2检验,生存分析采用Kaplan-Meier分析,单因素预后分析采用Logrank检验,多因素分析采用Cox比例风险模型。P < 0.05为差异有统计学意义。
结果1.近期疗效:全组完全缓解(CR)率75.6%,部分缓解(PR)率22.3%,总有效率(CR+PR)为97.9 %。不同FIGO分期、淋巴结转移状况和是否同期化疗的局部控制率不同,差异有统计学意义(χ2=6.152~118.059,P<0.05),见表 2。
|
|
表 2 422例不同临床特征宫颈癌患者近期疗效情况 Table 2 Efficacy of 422 cervical carcinoma patients with different clinical characteristics |
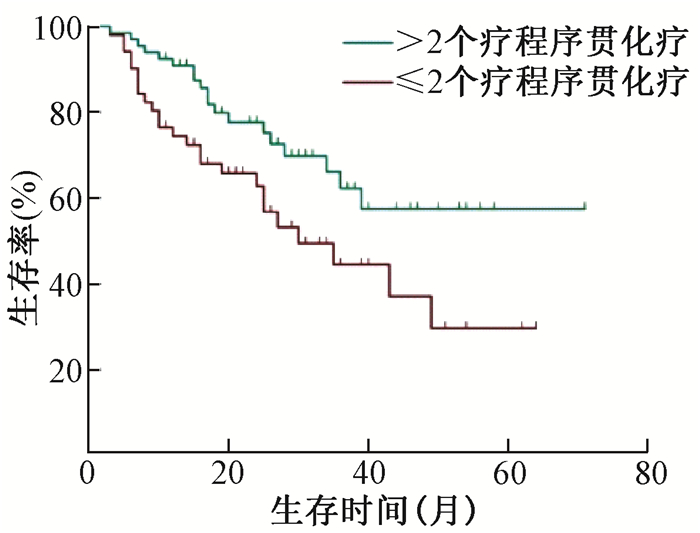
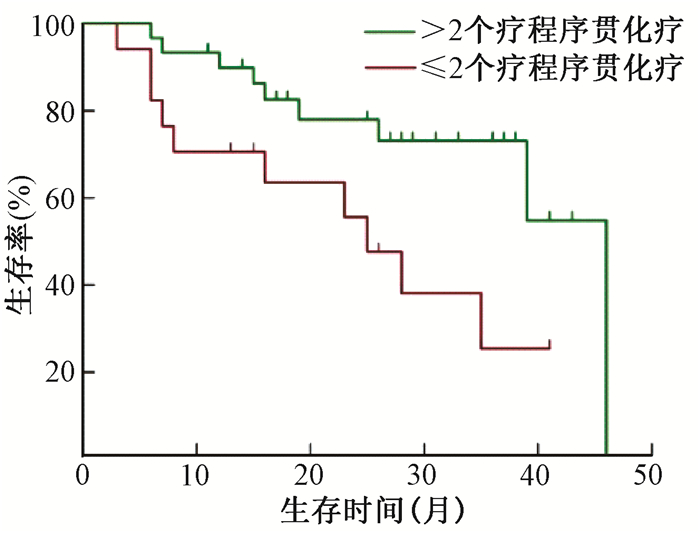
2.生存和预后因素分析:全组1、3和5年总生存(OS)率分别为93.4%、79.4%和65.0%。单因素分析显示:患者年龄、FIGO分期、淋巴结转移状况、病理类型、放疗同期的化疗情况、近期疗效和序贯化疗情况是影响预后的因素,见表 3。Cox多因素分析:国际妇产科联盟(FIGO)分期、淋巴结转移状况、病理类型、放疗同期的化疗情况和近期疗效是影响患者预后的独立因素,见表 4。亚组分析显示:放疗同期使用顺铂、卡铂、奈达铂单药化疗OS相似(P>0.05);单药与两药同期化疗对OS无影响(P>0.05);同期化疗基础上>2个周期的序贯化疗能延长FIGO ⅢB~ⅣA期(χ2=5.041,P < 0.05,图 1)或PALN阳性(χ2=5.179,P < 0.05,见图 2)患者的OS。
|
|
表 3 422例宫颈癌患者生存率Logrank法单因素预后分析 Table 3 Univariate analysis of OS in 422 cervical carcinoma patients by using Log-rank estimates |
|
|
表 4 422例宫颈癌患者生存率Cox法多因素预后分析 Table 4 Multivariate analysis of OS in 422 cervical carcinoma patients by using Cox estimates |
|
图 1 FIGO ⅢB~ⅣA期患者≤2个周期和>2个周期序贯化疗生存曲线比较 Figure 1 Comparison of OS curvesinthe patients at FIGO ⅢB~ⅣA stages receiving ≤ 2 cycles of chemotherapy or > 2 cycles of chemotherapy |
|
图 2 PALN阳性患者≤2个周期和>2个周期序贯化疗生存曲线比较 Figure 2 Comparison of OS curvesinthe patients with PALN positivity receiving ≤ 2 cycles of chemotherapy or > 2 cycles of chemotherapy |
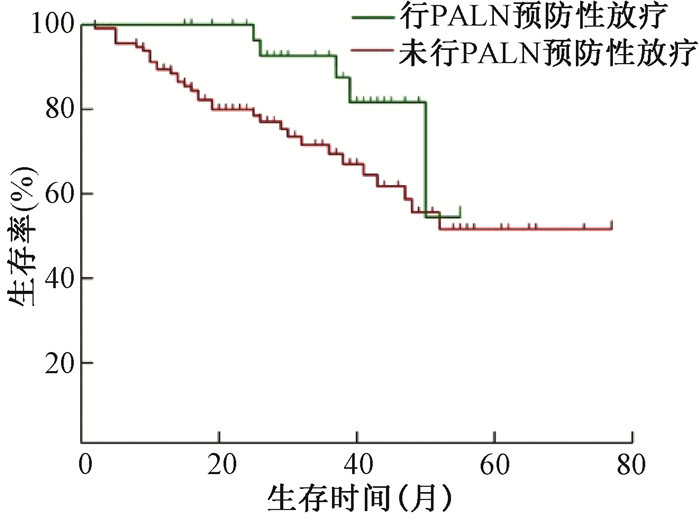
3.盆腔淋巴结阳性患者行预防性PALN引流区放疗价值分析:全组共盆腔淋巴结阳性者共146例,未行预防性PALN引流区放疗113例中有19例(16.8%)出现PALN转移,行预防性放疗33例患者中2例出现PALN复发,差异无统计学意义(P>0.05)。预防性PALN引流区放疗的OS高于未行预防性放疗(χ2=3.953,P < 0.05),见图 3。
|
注:PALN.腹主动脉旁淋巴结 图 3 盆腔淋巴结阳性患者PALN引流区预防性放疗和不预防患者生存曲线比较 Figure 3 Comparison of OS curves in the patients with pelvic lymph node metastasis receiving prophylactic extended field irradiation of the PALN or not |
4.复发和死亡原因分析:共有112例患者出现肿瘤复发和/或转移,其中盆腔复发41例,远处转移59例,盆腔复发合并远处转移的12例。53例盆腔复发病例包括盆腔淋巴结复发26例、宫颈复发17例、宫颈合并淋巴结复发2例、阴道复发8例。其中放疗后未达到CR的盆腔复发患者27例(占50.9%),盆腔中位复发时间7.7个月(95%CI:4.4~13.2个月)。肺转移20例,肝转移9例,骨转移6例,PALN转移26例,纵隔和/或锁骨上淋巴结转移15例,其中17例患者有多个部位转移。随访期间共85例死亡,其中不明原因或内科疾病死亡27例。
5.治疗不良反应:所有患者未发生治疗相关性死亡,放疗期间不良反应主要为消化道和血液学不良反应。3级及以上的急性骨髓抑制、放射性肠炎和放射性膀胱炎发生率分别为27.7%、17.3%和10.0%。同期放化疗和单纯放疗患者≥3级骨髓抑制分别为31.2%和10.1%,同期放化疗高于单纯放疗(χ2=12.722,P<0.05);其中,单药方案与两药方案≥3级骨髓抑制发生率差异无统计学意义(P>0.05)。单纯放疗、单药同期放化疗、两药同期放化疗≥3级放射性肠炎和膀胱炎发生率分别为13.0%、16.4%、19.6%和8.7%、9.4%、10.8%,差异均无统计学意义(P>0.05)。
讨论宫颈癌是我国妇女生殖系统最常见的恶性肿瘤,放射治疗在宫颈癌治疗中发挥重要作用。盆腔淋巴结转移是宫颈癌常见转移部位,ⅠB和Ⅱ期宫颈癌有1/4的患者有盆腔淋巴结转移[6]。因此,原发灶和盆腔淋巴结引流区是宫颈癌外照射常规靶区。随着病期增加,盆腔淋巴结转移发生率升高,PALN转移也明显增加,Ⅱ~Ⅲ期宫颈癌有16%~25%出现腹主动脉旁转移,且多数发生在左肾静脉以下[7-8]。本研究中盆腔淋巴结转移的患者24.3%伴有腹腔淋巴结转移。多项前瞻性研究发现PALN引流区预防性放疗可提高生存率和降低远处转移率[9-10]。而Oh等[11]研究发现腹主动脉旁淋巴引流区预防放疗无生存获益,增加了放射的不良反应。本研究中盆腔淋巴结阳性患者行PALN引流区预防性放疗后有6.1%出现腹腔淋巴结转移,未行预防性放疗腹腔淋巴结转移率为16.8%,差异虽无统计学意义,仍提示盆腔淋巴结阳性患者PALN引流区预防性放疗有降低风险的趋势,有待扩大样本进一步研究。本研究发现预防性PALN引流区放疗的OS高于未行预防性放疗患者。
本研究多因素分析显示,FIGO分期较早、鳞癌患者、无淋巴结转移状况、同期放化疗和近期疗效较好是影响患者预后较好的独立因素,与既往报道相似[10, 12-13]。含顺铂或卡铂的同期放化疗是局部晚期宫颈癌治疗的标准方案[13],奈达铂因较轻的不良反应也是常用的同期化疗方案[14]。本研究发现同期放化疗能延长患者的OS;亚组分析显示奈达铂、顺铂或卡铂的同期化疗患者OS相似,与报道相符[14]。单药铂类的化疗与两药联合化疗的近期疗效相似,而两药联合方案OS优于单药。本研究显示,FIGO ⅢB~ⅣA期或PALN阳性患者能从>2个周期的序贯化疗中获益。本研究中序贯化疗大都采用紫杉醇+奈达铂双药方案,其他方案例数较少,未进行不同方案之间的近期疗效和总生存时间的比较。本研究中年龄≥65岁老年患者约占1/4,经放疗±化疗后也取得较好的生存期,与既往报道[15-16]相符。
放疗期间的主要不良反应多表现骨髓抑制、腹泻等放射性肠炎症状和尿频尿急等放射性膀胱炎症状。同期化放疗患者放疗过程中≥3级血液系统不良反应比例高于单纯放疗,单药与两药联合相似,经相应治疗后都能较快恢复,且对随后的序贯化疗影响甚微,与既往文献报道相似[17]。同期放化疗未增加患者≥3级放射性直肠炎和放射性膀胱炎的发生率。
总之,宫颈癌患者采用调强放疗+后装治疗±化疗的治疗模式可取得良好的疗效和长期生存,且不良反应可耐受。盆腔淋巴结转移患者行预防性PALN引流区放疗的OS高于未行预防性放疗患者。FIGO ⅢB~ⅣA期或PALN阳性患者能从>2个周期的序贯化疗中获益。FIGO分期、病理类型、淋巴结转移状况、是否同期放化疗以及近期疗效是影响患者预后的独立因素。
志谢 本研究接受南京医科大学科技发展基金(2017NJMUZD039)资助利益冲突 本研究与其他机构无任何商业经济利益冲突
作者贡献声明 王坚负责数据的整理和分析、论文起草和最终版本修订;胡莉钧、于波、于静萍、王利利、倪新初、孟庆红、孙志强、汪建林提供病例和随访;聂斌提供研究思路和研究方案
| [1] |
Cohen PA, Jhingran A, Oaknin A, et al. Cervical cancer[J]. Lancet, 2019, 393(10167): 169-182. DOI:10.1016/S0140-6736(18)32470-X |
| [2] |
Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115-132. DOI:10.3322/caac.21338 |
| [3] |
Sagae S, Monk BJ, Pujade-Lauraine E, et al. Advances and concepts in cervical cancer trials:a road map for the future[J]. Int J Gynecol Cancer, 2016, 26(1): 199-207. DOI:10.1097/IGC.0000000000000587 |
| [4] |
Chargari C, Deutsch E, Blanchard P, et al. Brachytherapy:an overview for clinicians[J]. CA Cancer J Clin, 2019, 69(5): 386-401. DOI:10.3322/caac.21578 |
| [5] |
路顺, 范子煊, 孙畅, 等. IMRT同步剂量补偿高剂量率后装治疗大体积宫颈癌的疗效分析[J]. 中华放射肿瘤学杂志, 2019, 28(7): 522-526. Lu S, Fan ZX, Sun C, et al. Clinical efficacy of HDR brachytherapy with concomitant complementary IMRT boost for bulky uterine cervical cancer[J]. Chin J Radiat Oncol, 2019, 28(7): 522-526. DOI:10.3760/cma.j.issn.1004-4221.2019.07.010 |
| [6] |
Michel G, Morice P, Castaigne D, et al. Lymphatic spread in stage ⅠB and Ⅱ cervical carcinoma:anatomy and surgical implications[J]. Obstet Gynecol, 1998, 91(3): 360-363. DOI:10.1016/s0029-7844(97)00696-0 |
| [7] |
Hwang L, Bailey A, Lea J, et al. Para-aortic nodal metastases in cervical cancer:a blind spot in the International Federation of Gynecology and Obstetrics staging system:current diagnosis and management[J]. Future Oncol, 2015, 11(2): 309-322. DOI:10.2217/fon.14.200 |
| [8] |
Gouy S, Morice P, Narducci F, et al. Nodal-staging surgery for locally advanced cervical cancer in the era of PET[J]. Lancet Oncol, 2012, 13(5): e212-220. DOI:10.1016/S1470-2045(12)70011-6 |
| [9] |
Wang W, Liu X, Meng Q, et al. Prophylactic extended-field irradiation for patients with cervical cancer treated with concurrent chemoradiotherapy:a propensity-score matching analysis[J]. Int J Gynecol Cancer, 2018, 28(8): 1584-1591. DOI:10.1097/IGC.0000000000001344 |
| [10] |
Wakatsuki M, Kato S, Ohno T, et al. Multi-institutional observational study of prophylactic extended-field concurrent chemoradiation therapy using weekly cisplatin for patients with pelvic node-positive cervical cancer in east and southeast Asia[J]. Int J Radiat Oncol Biol Phys, 2019, 105(1): 183-189. DOI:10.1016/j.ijrobp.2019.04.039 |
| [11] |
Oh J, Seol KH, Lee HJ, et al. Prophylactic extended-field irradiation with concurrent chemotherapy for pelvic lymph node-positive cervical cancer[J]. Radiat Oncol J, 2017, 35(4): 349-358. DOI:10.3857/roj.2017.00367 |
| [12] |
Wang YM, Wang CJ, Fang FM, et al. Differences in the outcomes and complications between elderly and younger uterine cervical cancer patients treated by definitive radiotherapy-A propensity score-matched study[J]. Gynecol Oncol, 2017, 145(2): 277-283. DOI:10.1016/j.ygyno.2017.02.034 |
| [13] |
Gaffney DK, Erickson-Wittmann BA, Jhingran A, et al. ACR appropriateness criteria® on advanced cervical cancer expert panel on radiation oncology-gynecology[J]. Int J Radiat Oncol Biol Phys, 2011, 81(3): 609-614. DOI:10.1016/j.ijrobp.2010.11.005 |
| [14] |
Kagabu M, Shoji T, Murakami K, et al. Clinical efficacy of nedaplatin-based concurrent chemoradiotherapy for uterine cervical cancer:a Tohoku Gynecologic Cancer Unit study[J]. Int J Clin Oncol, 2016, 21(4): 735-740. DOI:10.1007/s10147-016-0946-4 |
| [15] |
Hata M, Koike I, Miyagi E, et al. Radiation therapy for very elderly patients aged 80 years and older with squamous cell carcinoma of the uterine cervix[J]. Am J Clin Oncol, 2017, 40(2): 178-182. DOI:10.1097/COC.0000000000000125 |
| [16] |
宋梅, 栾朝辉, 刘海霞, 等. 同步放化疗与单纯放疗治疗老年中晚期宫颈癌的疗效观察[J]. 中华老年医学杂志, 2016, 35(10): 1084-1086. Song M, Luan ZH, Liu HX, et al. The clinical effect of radiotherapy combined with chemotherapy versus radiotherapy alone in treatment of advanced cervical carcinoma in the elderly[J]. Chin J Geriatr, 2016, 35(10): 1084-1086. DOI:10.3760/cma.j.issn.0254-9026.2016.10.014 |
| [17] |
Wang W, Hou X, Yan J, et al. Outcome and toxicity of radical radiotherapy or concurrent Chemoradiotherapy for elderly cervical cancer women[J]. BMC Cancer, 2017, 17(1): 510. DOI:10.1186/s12885-017-3503-2 |
 2019, Vol. 39
2019, Vol. 39


