2. 美国哈佛大学医学院麻省总医院放疗系, 波士顿 02114;
3. 山东省肿瘤医院放疗科, 济南 250117
2. Department of Radiation Oncology, Massachusetts General Hospital, Harvard Medical School, Boston 02114, USA;
3. Department of Radiation, Shandong Cancer Hospital, Jinan 25011, China
质子放疗的优势源于其剂量深度分布的物理特性[1-2]。但已有研究表明能量为177 MeV的质子束,其射程[3]变化0.7 cm可导致远端剂量分布从90%跌落到10%[4]。因此,质子放疗中射程精度的研究极其重要。
质子束的射程由入射能量及其所经过的人体组织相对阻止本领(relative stopping power,RSP)决定。质子成像技术可直接获得人体组织的三维相对阻止本领,但该技术仍处于实验研究阶段[5-9]。因此,临床上只能借助CT图像,通过建立人体组织CT值(Hounsfield units,HU)与RSP的转换关系(HU-RSP),间接获得相对阻止本领值。目前世界各质子中心普遍使用一种化学计量校准方法来获得HU-RSP转换关系[10-12]。该转换关系是导致射程精度降低的最主要因素[13]。研究发现脂肪模体的HU值和临床患者的乳房、腹部等皮下脂肪HU值相差较大,差别甚至高达40 HU[14]。因此,HU-RSP转换关系在脂肪区间内误差可能会较大。因此,本研究旨在介绍CT模拟定位机HU-RSP转换关系的校准方法,并提高其在脂肪区间的精度。
材料与方法1.变量定义:CT的测量值HUM为通过扫描物质CT图像获得的CT值;CT的理论值HUC为基于物质的基本元素组成,借助参数化的化学计量公式,计算所得物质的CT值;相对阻止本领(RSP)的测量值RSPM为利用质子束流,测量所得的物质材料的相对阻止本领值;相对阻止本领(RSP)的理论值RSPC为基于物质的基本元素组成,借助Bethe-Bloch公式计算所得的物质的相对阻止本领值。
2.化学计量校准方法:Schneider等[10]对化学计量校准方法做了详细的阐述。该方法主要分4步:①借助CT模拟定位机,扫描组织替代物的CT图像,通过分析组织替代物的CT图像,获得相应的HUM。②计算组织替代物的HUC值,利用线性回归方法拟合多种组织替代物(HUC,HUM),获得CT的X光能量参数Kph,Kcoh,KKN。③基于人体组织的电子密度和元素组成,计算相应人体组织的CT值和相对阻止本领值HUC,RSPC。④拟合人体组织HUC,RSPC,获得CT模拟定位机HU-RSP校准曲线。
化学计量校准方法有两个关键点:一是利用组织替代物的HUC和HUM对CT模拟定位机校准。HUC定义为公式(1):
| $ H U _ { c } = ( \frac { \mu _ { m } } { \mu _ { m } } - 1 ) \times 1000 $ | (1) |
| $ {\mu _m} = \rho _e^{rel}({K^{ph}}{\tilde Z^{3.62}} + {K^{coh}}{\hat Z^{1.86}} + {K^{KN}}) $ | (2) |
式中,μm和μw分别为光子在物质和水中的衰减系数;ρerel为物质的相对电子密度;Kph、Kcoh和KKN分别为光电相互作用常数、相干散射常数和康普顿散射常数;
化学计量刻度方法的另一关键点是借助Bethe-Bloch[15]公式,按公式(3)计算人体组织的RSPC。
| $ RS{P_c} = \rho _e^{rel}\frac{{{\rm{ln}}(\frac{{2{m_e}{c^2}{\beta ^2}}}{{{I_m}}}) - {\rm{ln}}(1 - {\beta ^2}) - {\beta ^2}}}{{{\rm{ln}}(\frac{{2{m_e}{c^2}{\beta ^2}}}{{{I_w}}}) - {\rm{ln}}(1 - {\beta ^2}) - {\beta ^2}}} $ | (3) |
| $ \ln {\mathit{I}_\mathit{m}} = (\sum {\frac{{{\omega _i}{Z_i}}}{{{A_i}}}{\rm{In}}} {\mathit{I}_\mathit{i}}){(\sum {\frac{{{\omega _i}{Z_i}}}{{{A_i}}}} )^{ - 1}} $ | (4) |
式中,β为质子相对论速度,取决于质子的入射能量,本研究中质子的入射能量为219 MeV;me为电子静止质量0.511 MeV;Ⅰm和Ⅰw分别为物质和水的平均电离能。公式(4)为混合物平均电离能的计算公式,其中每个元素的电离能Ⅰi取Janni[16]和国际辐射单位与测量委员会(ICRU)37号报告[17]的平均值。
3.材料设备和实验方法(1)材料设备:选用13种组织替代物(GammexInc, Middleton, WI),其中肺组织(LN-300 Lung,LN-450 Lung)2种、脂肪(AP6)、乳腺(BR-12 Breast)、脑(BRN-SR2 Brain)、肝(LV1 Liver)脏各1种、水(Water Insert)、固体水1种(Solid Water)、骨组织(IB Inner Bone,B200 Bone Minera,CB2-30% CaCO3,CB2-50% CaCO3,SB3 Cortical Bone)5种等,其详细信息列于表 1。同时,本研究采用了68种人体组织,其中脂肪组织3种、骨组织12种、水1种、细胞核1种,腺体、器官及皮肤等共51种[18-20]。
|
|
表 1 Gammax 467模体中组织替代物的性质 Table 1 Tissue-surrogatesof Gammax 467 phantom and their physical density, electron density relative to water |
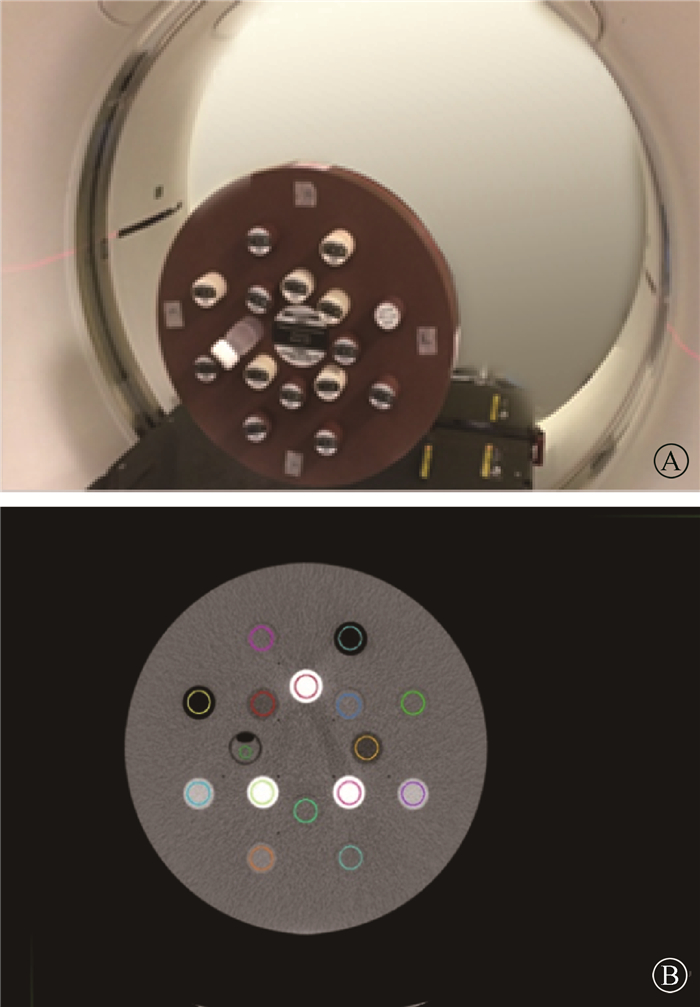
CT模拟定位机为美国通用电气公司生产的大孔径模拟定位机,型号是GE Discovery CT 590 RT。扫描参数与扫描患者CT图像时一致:模体直接摆放在扫描床上,扫描能量为140 kV,扫描电流为491 mA,曝光为32 mAs,螺旋扫描,扫描层厚为1.25 mm,像素大小为0.98 mm×0.98 mm×1.25 mm。所用Gammex 467模体和CT图像如图 1所示。选择组织替代物中间层面的CT图像,分别勾画13种组织替代物的结构,见图 1。利用MIM图像分析软件中的统计功能(statistical viewer),可直接获得每个组织替代物勾画区的HU平均值HUM。
|
图 1 Gammex 467模体及其CT扫描图像A. Gammex 467模体;B. CT扫描图像 Figure 1 Gammex 467 phantom and its CTscanningimage A.Gammax 467 phantom; B.CT scanning image |
(2) 实验方法:随机选择多例患者CT图像,通过高斯拟合脂肪组织、软组织、骨组织等主要人体组织的HUM分布,结合68种人体组织的HUC值,确定不同组织的HUM区间。
为提高HU-RSP转换关系在脂肪区间的精度,选用合适的动物组织模拟临床患者的皮下脂肪,并测量该动物组织的HUM和RSPM用于HU-RSP拟合。具体步骤如下:①选择8例临床患者,分析皮下脂肪区的HUM分布;选择新鲜动物脂肪组织,扫描CT图像,利用高斯拟合分别确定患者和动物脂肪组织的HUM平均值。②借助麻省总医院的IBA双散射质子治疗设备及自制体内射程测量系统[21],利用质子双散射系统剂量率的均方根(RMS)随水等效射程的单调变化特性即时间分辨方法,测量动物脂肪组织内水等射程值(water equivalent path length,WEPL)[3]。利用模体内射程测量系统测量动物脂肪组织模体的WEPL,并借助游标卡尺测量动物脂肪组织在束流方向的物理长度(L),根据公式[4]RSPM=WEPL/L,计算RSPM。双散射质子治疗设备的主要参数设置:射程为15 g/cm2,调制宽度为15 g/cm2,回旋加速器引出束流强度为69 nA,机架角为270°,喷嘴直径为25 cm。质子束引出能量为219 MeV。
4.电离能对转换曲线(HU-RSP)的影响:Janni[16]利用Bethe方程对不同物质的阻止本领实验数据进行最小二乘拟合,获得相应元素的平均电离能。Bethe拟合方程包括了壳层修正、密度效应修正,降低了低原子数元素的平均电离能误差。ICRU 37号报告[17]在获取混合物的平均电离能时考虑了其分子结合效应,对元素的平均电离能进行了调整。分析Janni[16]与ICRU 37号报告[17]中两者元素的平均电离能,其中氮元素的相对百分比最大,为19.3%,氢、氧、碳的平均电离能相对百分比分别为6.3%、9.2%、-8.9%。由于人体组织器官富含氢氧碳氮元素,所以选用元素不同的平均电离能会导致其平均电离能计算值的差异,影响其相对组织本领值,进而影响转换曲线。因此,本研究选择Janni[16]和ICRU 37号报告[17]中的平均电离能所获得的转换曲线与选择两者平均值时所获得转换曲线的相对百分比。
5.入射质子能量对转换曲线(HU-RSP)的影响:质子速度依赖其能量,由公式(3)可知物质的RSPC随入射质子能量缓慢变化。为了涵盖不同深度的肿瘤,临床质子能量范围一般为90~235 MeV,而精确选择质子能量会引起RSPC的误差,进而影响转换曲线。因此,本研究分析比较了选择最低和最高入射质子能量所获得的转换曲线与选择219 MeV时所获得转换曲线的相对百分比。
结果1.HU-RSP转换曲线
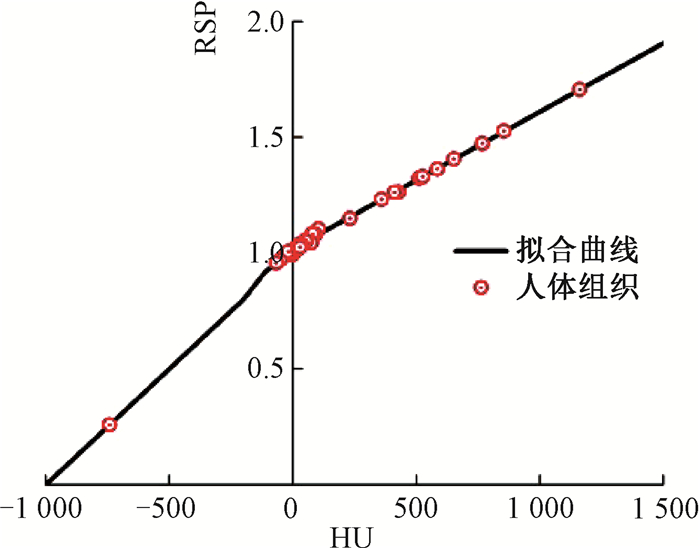
(1) 拟合68种人体组织所得HU-RSP转换曲线[该转换曲线以下简称(HU-RSP)H]:通过拟合表 1 Gammax 467模体中13种组织替代物的测量及计算的CT值(HUC,HUM),获得参数Kph=1.224 7×10-5,Kcoh=-0.000 735 38,KKN= 0.513 8。拟合的确定系数R-squared值为0.999。
人体皮下脂肪组织、软组织、骨组织在HU-RSP转换曲线拟合中的拟合区间,分别为-113~ -29,23~70,>135。其他HU区间用线段连接。分段拟合68种人体组织(HU,RSP)的结果见图 2。由图 2可知,所用人体组织脂肪HUC的最小值是-66,远大于临床患者皮下脂肪组织的HUM(分析8例患者皮下脂肪的HUM平均值为-103±4.2)。因此,(HU-RSP)H转换关系在脂肪区间可能存在较大误差。
|
图 2 (HU-RSP)H转换关系拟合曲线 Figure 2 The fitted curve of(HU-RSP)H |
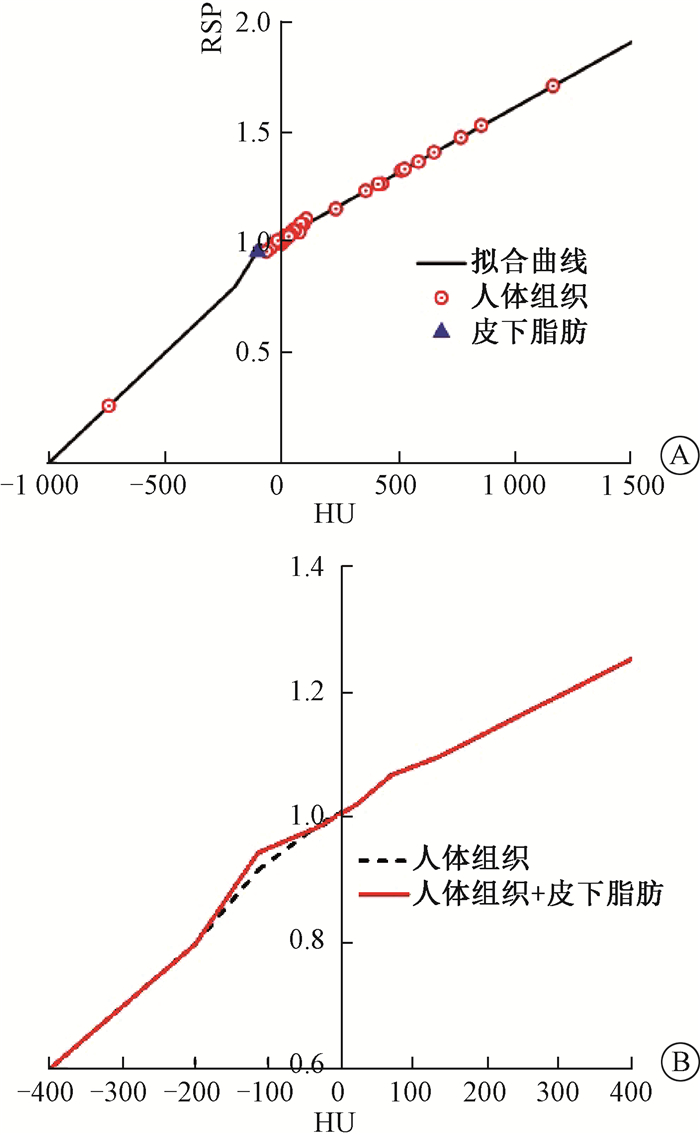
(2) 拟合(68种人体组织+皮下脂肪)的HU-RSP转换曲线(该转换曲线以下简称(HU-RSP)HA):8例患者皮下脂肪的HUM平均值为-103±4.2。动物皮下脂肪组织HUM平均值为-103±3.7,可较好地描述临床患者皮下脂肪HUM。
在(HU-RSP)H转换曲线中,动物皮下脂肪对应的相对阻止本领值为0.918。而利用质子束测量其相对阻止本领值为0.956,两者相对偏差为4.14%,高于临床治疗计划中为保证剂量覆盖而使用的质子射程余量3.5%。当质子束经过较厚皮下脂肪时,会导致远端肿瘤的照射剂量低于处方剂量,进而影响肿瘤的局部控制。因此,需要提高(HU-RSP)H转换曲线在脂肪区的精度。
在68种人体组织基础上加入测量的皮下脂肪数据点,其拟合结果如图 3所示。(HU-RSP)H与(HU-RSP)HA转换曲线的比较见图 3。由图 3B对比结果可知,加入皮下脂肪测量值,可显著提高HU-RSP转换曲线在脂肪区域转换的精度。
|
图 3 (HU-RSP)HA转换关系拟合曲线及其与(HU-RSP)H的比较A.(HU-RSP)HA转换关系拟合曲线;B.(HU-RSP)H与(HU-RSP)HA的比较 Figure 3 The conversion curves of(HU-RSP)HA and(HU-RSP)HA and their comparison A.The conversion curve of(HU-RSP)HA; B.The comparison between (HU-RSP)H and(HU-RSP)HA |
2.电离能Ⅰi对HU-RSP转换曲线的影响:本研究分析了Janni[16]和ICRU 37号报告[17]电离能对HU-RSP转换曲线的影响,结果见图 4。由结果可知,平均电离能对脂肪和高密度骨组织区影响较大,最大相对偏差<0.6%。

|
图 4 不同电离能对应的HU-RSP转换曲线及其比较A.不同电离能对应的HU-RSP转换曲线;B.不同电离能对应的HU-RSP转换曲线的比较 Figure 4 The conversion curves of HU-RSP with different ionization energy and their comparisons A. The conversioncurves of HU-RSP with different ionization energy; B.The comparisons for conversioncurves of HU- RSP with different ionization energy |
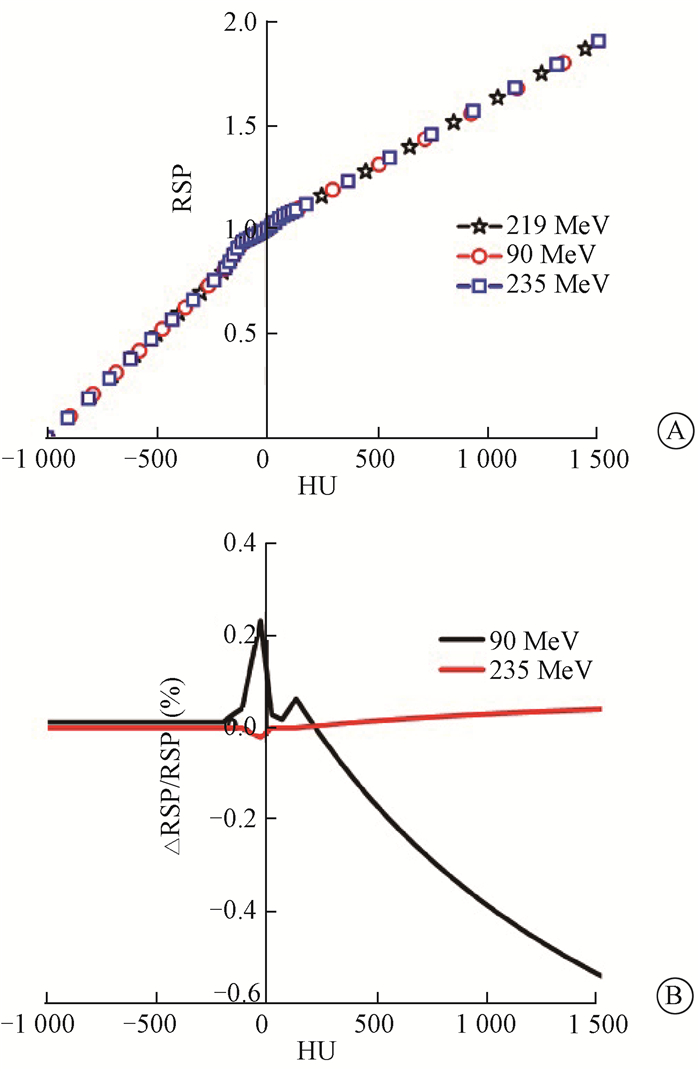
3.入射质子能量对HU-RSP转换曲线的影响:本研究分析了入射质子选用最小能量90 MeV和最大能量235 MeV对HU-RSP转换曲线的影响,结果如图 5所示。由结果可知,质子束入射能量采用90 MeV对脂肪和高密度物质区的HU-RSP转换曲线影响较大,在脂肪区的最大相对偏差<0.3%,在高密度物质区的最大偏差<0.8%。质子束入射能量采用235 MeⅤ对HU-RSP转换曲线的影响可忽略。
|
图 5 不同入射能量对应的HU-RSP转换曲线及其比较A.不同入射能量对应的HU-RSP转换曲线;B.不同入射能量所得HU-RSP转换曲线的比较 Figure 5 The conversion curves of HU-RSP with different energies and their comparisons A. The curves of HU-RSP with different energies; B.The comparison for curves of HU-RSP with different energies |
讨论
质子束在患者体内射程的精度与多种因素相关,其中CT图像的HU-RSP转换精度是影响质子束射程精度的主要因素。由于HU-RSP转换关系主要取决于CT扫描时的X射线能量,所以每一台CT模拟定位机的每一档能量都有相应的HU-RSP转换关系。本研究借助化学计量校准方法,通过拟合人体组织模体,获得了HU-RSP转换关系[10-12],即(HU-RSP)H转换曲线。临床患者皮下脂肪的HUM为-103,代入(HU-RSP)H转换曲线,其相对阻止本领值为0.918,与实际测量值的相对偏差为4.14%,高于目前使用的临床质子射程计算余量3.5%[13]。因此,对于质子要穿过较厚皮下脂肪才能到达的肿瘤,麻省总医院质子治疗中心的计划系统所用质子射程偏小,会造成远端肿瘤组织照射剂量不足,进而影响肿瘤的局部控制。在68种人体组织数据的基础上加入皮下脂肪的测量数据(HUM=-103, RSPM=0.956),获得新的(HU-RSP)HA转换曲线。皮下脂肪在(HU-RSP)HA转换曲线中的相对阻止本领值为0.943,与其测量值的相对偏差为1.36%。因此,皮下脂肪数据点的加入使得HU-RSP转换关系在皮下脂肪区间的相对偏差由4.14%提高到了1.36%。这显著提高了质子治疗计划在脂肪区间的计算精度。
此外,物质的RSPM依赖于元素的平均电离能Ⅰi。因此,Ⅰi的选取会影响HU-RSP转换关系。本文研究了Janni[16]和ICRU 37号报告[17]中的平均电离能对68种人体组织的相对阻止本领的影响,最大相对偏差为0.6%。同时,本研究还分析得到质子束入射能量采用不同数值对HU-RSP转换关系有一定影响。当入射质子束能量与实际采用的能量值相差较大时,在高密度物质区对HU-RSP转换关系产生的最大偏差<0.8%。因此,在刻度HU-RSP转换关系时,平均电离能和入射质子束能量应选用合适的参数值。
综上所述,在CT模拟定位机扫描电压为140 kV时,皮下脂肪数据点的加入显著提高了HU-RSP转换关系在脂肪区间的精度,降低了质子放疗在该区间的射程误差。平均电离能的差异对脂肪和高密度骨组织区的HU-RSP转换关系影响的最大相对偏差<0.6%。质子束入射能量应尽量选用临床使用频率较高的能量值。
利益冲突 作者与作者家属未因进行该研究而接受任何不正当的职务或财务利益,在此对研究的独立性和科学性予以保证作者贡献声明 崔相利负责进行数据的采集、整理、分析及论文的撰写;JEE Kyung wook和Lu Hsiao Ming指导研究设计;王宏志和胡漫负责论文修改
| [1] |
Bragg WH, KleemanR. On the ionization curves of radium[J]. Phil Mag, 1904, 8(48): 726-738. DOI:10.1080/14786440409463245 |
| [2] |
Wilson RR. Radiological use of fast protons[J]. Radiology, 1946, 47(5): 487-491. DOI:10.1148/47.5.487 |
| [3] |
Lu HM. A potential method for in vivo range verification in proton therapy treatment[J]. Phys Med Biol, 2008, 53(5): 1413-1424. DOI:10.1088/0031-9155/53/5/016 |
| [4] |
Schaffner B, Pedroni E. The precision of proton range calculations in proton radiotherapy treatment planning:experimental verification of the relation between CT-HU and proton stopping power[J]. Phys Med Biol, 1998, 43(6): 1579-1592. DOI:10.1088/0031-9155/43/6/016 |
| [5] |
Schneider U, Pedroni E. Proton radiography as a tool for quality control in proton therapy[J]. Med Phys, 1995, 22(4): 353-363. DOI:10.1118/1.597470 |
| [6] |
Reinhard S, VladimirB, Li T, et al. Conceptual design of a proton computed tomography system for applications in proton radiation therapy[J]. IEEE T Nucl Sci, 2004, 51(3): 866-872. DOI:10.1109/TNS.2004.829392 |
| [7] |
Schulte RW, Bashkirov V, Klock MC, et al. Density resolution of proton computed tomography[J]. Med Phys, 2005, 32(4): 1035-1046. DOI:10.1118/1.1884906 |
| [8] |
Talamonti C, Reggioli V, Bruzzi M, et al. Proton radiography for clinical applications[J]. NuclInstrum Methods A, 2010, 612(3): 571-575. DOI:10.1016/j.nima.2009.08.040 |
| [9] |
Testa M, Verburg JM, Rose M, et al. Proton radiography and proton computed tomography based on time-resolved dose measurements[J]. Phys Med Biol, 2013, 58(22): 8215-8233. DOI:10.1088/0031-9155/58/22/8215 |
| [10] |
Schneider U, Pedroni E, Lomax A. The calibration of CT Hounsfield units for radiotherapy treatment planning[J]. Phys Med Biol, 1996, 41(1): 111-124. DOI:10.1088/0031-9155/41/1/009 |
| [11] |
Yang M, Zhu XR, Park PC, et al. Comprehensive analysis of proton range uncertainties related to patient stopping-power-ratio estimation using the stoichiometric calibration[J]. Phys Med Biol, 2012, 57(13): 4095-4115. DOI:10.1088/0031-9155/57/13/4095 |
| [12] |
Ainsley CG, Yeager CM. Practical considerations in the calibration of CT scanners for proton therapy[J]. J Appl Clin Med Phys, 2014, 15(3): 4721. DOI:10.1120/jacmp.v15i3.4721 |
| [13] |
Paganetti H. Range uncertainties in proton therapy and the role of Monte Carlo simulations[J]. Phys Med Biol, 2012, 57(11): R99-117. DOI:10.1088/0031-9155/57/11/R99 |
| [14] |
Cui X, Bentefour E, Jee K, et al. Investigation of proton beam range uncertainty in breast treatment using real tissue samples[J]. Med Phys, 2017, 44(6): 2993. DOI:10.1002/mp.12304 |
| [15] |
Bethe H. Zur Theorie des Durchgangs schneller Korpuskularstrah len durch Materie[J]. Ann Phys, 1930, 397(3): 325-400. DOI:10.1002/andp.19303970303 |
| [16] |
Janni JF. Energy loss, range, path length, time-of-flight, straggling, multiple scattering, and nuclear interaction probability. Part Ⅱ. For elements 1 ≤ Z ≤ 92[J]. Atom Data Nucl Data Tables, 1982, 27(2-3): 212-245. DOI:10.1016/0092-640X(82)90004-3 |
| [17] |
International Commission on Radiation Units and Measurement. ICRU Reprot 37. Stopping powers for electrons and positrons[R]. Maryland: ICRU, 1984.
|
| [18] |
International Commission on Radiological Protection. ICRP report 23. Report of the Task Group on Reference Man[R]. Oxford: ICRP, 1975.
|
| [19] |
Woodard HQ, White DR. The composition of body tissues[J]. Br J Radiol, 1986, 59(708): 1209-1218. DOI:10.1259/0007-1285-59-708-1209 |
| [20] |
International Commission on Radiation Units and Measurement.ICRU report 44. Tissue substitutes in radiation dosimetry and measurements[R].Maryland: ICRU, 1989.
|
| [21] |
Gottschalk B, Tang S, Bentefour EH, et al. Water equivalent path length measurement in proton radiotherapy using time resolved diode dosimetry[J]. Med Phys, 2011, 38(4): 2282-2288. DOI:10.1118/1.3567498 |
 2019, Vol. 39
2019, Vol. 39


