瓦里安公司新推出的HalcyonTM加速器打破传统机头结构设计方式,去除x/y两个方向次级准直器,在x方向设置上下两层多叶光栅,仅配备6 MV去均整模式(FFF)光子线,减轻了机头重量。该机型机头和电子射野影像系统(EPID)封闭,采用磁悬浮线性驱动并配备全球统一基础数据,具有机架转速快、治疗效率高、装机时间短和机房屏蔽要求低等优势。封闭式的机头结构设计方式导致基于Matrixx/Dolphin等测量设备通过测量加速器机头射野剂量的Compass系统[1-3]和基于等中心处剂量测量的二维电离室矩阵和PTW OCTAVIUS 4D系统[4-5]等依赖于射野角度重建三维剂量的验证方式,不适用于HalcyonTM治疗计划的剂量验证工作。与传统TrueBeam或C3系列加速器治疗计划优化方式不同,HalcyonTM机架转速调制优于剂量率,因此,机架高速和变速旋转方式以及双层多叶光栅快速束流调制投递方式等因素,对验证设备的剂量和角度响应等性能带来了极大的挑战。本研究比较PTW OCTAVIUS 1500配合Octagonal模体[6-7](Oct1500)和基于EPID的Portal Dosimetry(PD)[8-10]两种方式在HalcyonTM高转速条件下治疗计划剂量验证结果,为新机器临床剂量验证手段的选择提供参考。
材料与方法1. HalcyonTM加速器和入组病例:HalcyonTM型号加速器简化了机头结构,采用上下两层多叶光栅交错设计结构,分别由29对和30对在等中心处投影宽度为1 cm的叶片组成,上下两层叶片交错排列后投影宽度为0.5 cm,最大射野可达到28 cm×28 cm;仅设置6 MV去均整模式,剂量率可以达到800 MU/min,机架转速最大为24°/s。
在HalcyonTM加速器上选取20例不同部位的入组患者,在Eclipse 15.1制定调强放射治疗(IMRT)和容积旋转调强放射治疗(VMAT)计划,共包含22个治疗计划和74个辐射野,分别采用Oct1500和PD两种方式进行剂量验证。本研究所需图像均由PTW Octagonal模体在放疗定位专用德国Siemens大孔径CT上扫描得到。
2.PTW 1500矩阵:德国PTW OCTAVIUS Detector 1500由1 405个空气电离室组成,几何尺寸为4.4 mm×4.4 mm×3 mm,其灵敏体积为0.058 cm3,有效测量范围为27 cm×27 cm,配套剂量测量软件为Verisoft 6.2。
Eclipse导出的冠状剂量平面设置为30 cm×30 cm,分辨率为512×512,像素大小为0.59 mm×0.59 mm。按照3 mm/3%的评估策略进行γ 2D评估时,以3 mm为半径的圆内有81个剂量点参与评估。
3. Portal Dosimetry(PD):PD利用医用直线加速器EPID采集到的图像信息,借助射野剂量图像预测算法(portal dose image prediction,PDIP)重建二维剂量,并与Eclipse剂量计算结果做对比,利用γ 2D评估IMRT/VMAT治疗计划单个射野的剂量传递精度;PD不用于患者实体剂量验证,验证过程中没有患者或者模体,仅用于剂量预测和评价。
HalcyonTM加速器采用非晶硅半导体图像探测器,有效探测范围43 cm×43 cm,折射到等中心的探测范围28 cm×28 cm,分辨率为1 280×1 280,像素大小0.218 mm×0.218 mm,点间距为0.336 mm,最大探测频率20帧/s。Eclipse计划系统计算出的预期剂量平面分辨率636×636,像素大小0.649 mm×0.649 mm。按照3 mm/3%的评估策略进行γ 2D评估时,以3 mm为半径的圆内大约67个剂量点,而对于PD剂量平面,则有595个点满足要求。
在IMRT/VMAT治疗计划排程时使用PD验证模式,即在Plan Scheduling中每个辐射野加入Integrated Image,并且默认EPID剂量测量位置为源皮距(SSD)=150 cm,在获取剂量图之后采用自动配准和γ 2D对比工具评估EPID测量和TPS计算得到的剂量图的通过率。
4.评价标准:对于IMRT/VMAT计划的验证,VeriSoft软件采用γ 2D分析方法评估计划的通过率。Low等[11]和Stock等[12]在剂量和位置误差(distance-to-agreement,DTA)评估策略的基础上,提出了γ 2D分析方法。按照临床应用的标准,以测量结果为参考,剂量误差设置为3%,距离误差标准为3 mm。假设γ≤1时,该计算点通过,γ>1时该点不通过。
PTW提供两种γ 2D分析方法,即局部剂量和最大剂量,最大剂量方法相对于局部剂量限制条件较为宽松,通过率相对较高,尤其是对于低剂量区。本研究采用最大剂量/局部剂量、3 mm/3%的评估策略,并且不考虑小于全局最大剂量5%的低剂量区;Portal Dosimetry分别采用Improved γ标准(相当于最大剂量方式),1 mm/1%、2 mm/2%、3 mm/3%的评估策略,不考虑小于全局最大剂量10%的低剂量区。
5.统计学处理:本研究采用SPSS 21.0软件对实验数据进行均值分析,对每组数据进行正态性检验(Kolmogorov-Smirnov检验),符合正态分布者,采用配对样本t检验,反之采用非参数检验。P < 0.05为差异有统计学意义。数据的图表统计分析则利用SigmaPlot 10.0软件完成。
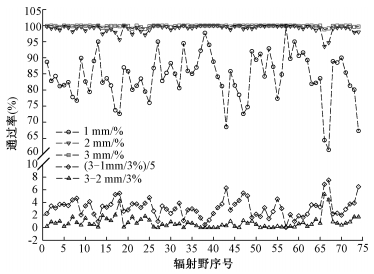
结果1.辐射野剂量验证:74个辐射野采用PD验证方式,3种γ 2D分析策略(1 mm/1%、2 mm/2%、3 mm/3%)及对应辐射野3 mm/3%与1 mm/1%、2 mm/2%评估结果的差值如图 1所示,其中3 mm/3%与1 mm/1%差值较大,图中乘以系数1/5之后如图 1下半部分所示。
|
图 1 PD方式不同评估策略下74个辐射野的通过率及其差值分布 Figure 1 Passing rates and deviation distributions of 74 Fields using different evaluation criteria for portal dosimetry method |
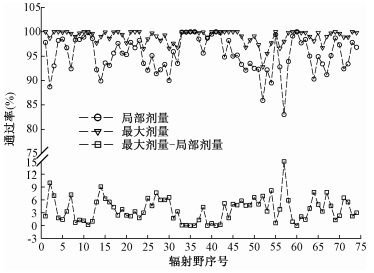
74个辐射野采用Oct1500验证方式两种γ评估策略(局部剂量/最大剂量)通过率及最大剂量与局部剂量差值分布如图 2所示。
|
图 2 Oct1500方式不同评估策略下74个辐射野通过率及其差值分布 Figure 2 Passing rates and deviation distributions of 74 Fields using different evaluation criteria for Oct1500 method |
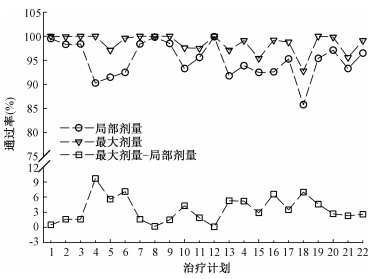
2.治疗计划剂量验证:22个治疗计划采用Oct1500验证方式,两种γ评估策略(局部/最大剂量)通过率及两者的差值分布如图 3所示。
|
图 3 Oct1500方式不同评估策略下22个治疗计划通过率及其差值分布 Figure 3 Passing rates and deviation distributions of 22 plans using different evaluation criteria for Oct1500 method |
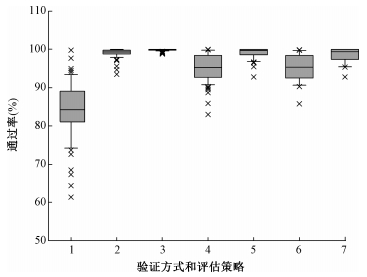
3.箱图分析:74个辐射野采用PD(1 mm/1%、2 mm/2%、3 mm/3%)和Oct1500(局部剂量/最大剂量)两种验证方式以及22个治疗计划Oct1500方式(局部/最大剂量)验证结果的框图分析如图 4所示。
|
图 4 不同验证方式和评估策略条件下通过率的框图分析 注:×.异常值;1~3.不同射野PD方式3种评估策略;4~5.不同射野Oct1500方式两种评价策略不同射野;6~7.不同治疗计划Oct1500方式两种评价策略 Figure 4 Boxplot analysis between different verification methods and evaluation criteria |
4.剂量验证分析比较:对所有数据做一致性相关系数分析[13],Kolmogorov-Smirnov正态性检验结果表明除了22个治疗计划局部剂量评估策略以外,其他样本不服从正态分布。对74个辐射野PD方式3种评估策略之间做相关样本非参数检验,差异均具有统计学意义(Z=-7.475,1 mm/1% vs. 2 mm/2%;Z=-7.475,1 mm/1% vs. 3 mm/3%;Z=-6.906,2 mm/2% vs. 3 mm/3%;P < 0.05),说明本实验设置的PD方式的3种评估策略之间差异性明显,1 mm/1%的评价策略最为严格。对Oct1500验证方式74个辐射野和22个治疗计划的两种评估策略(局部/最大剂量)通过率之间做相关样本非参数检验,差异具有统计学意义(Z=-7.220、-4.108,P < 0.05),说明局部剂量评估方式通过率小于最大剂量评估方式,这种结果是由γ 2D通过率计算公式决定的。对74个辐射野采用最大剂量、3 mm/3%的评估策略的两种验证方式之间的通过率数据做相关样本非参数检验,差异具有统计学意义(Z=-5.072,P < 0.05),表明相同评价策略条件下,γ 2D通过率和验证精度与探测器空间分辨率正相关,且差异具有统计学意义。
讨论放射治疗计划方案质量控制是验证计划系统计算精度和加速器剂量传递精度的关键,其中测量工具和评估策略的选择是质量控制工作的重中之重。Bruschi等[14]利用OCTAVIUS 4D旋转模体和PTW公司3种分辨率不同的矩阵(729/1500/SRS1000)重建三维剂量,对比测量设备分辨率在立体定向体部放疗(SBRT)病例中对剂量验证精度的影响,结果显示矩阵分辨率可显著影响SBRT治疗前剂量验证结果。Stelljes等[6]和Van Esch等[7]通过Verisoft软件提供的四步测量法获取更高分辨率的测量结果,从而满足剂量分布强度调制的尼奎斯特(Nyquist)理论,通过合并多个测量值以增加剂量分布与电离室敏感区域覆盖范围的方式可增加空间采样频率,从而提高剂量验证精度。同时也证明Oct1500矩阵剂量稳定性、线性和脉冲依赖性分别小于±0.2%、±0.58%、1%,在IMRT治疗计划验证中通过率均在90%以上(局部剂量、3 mm/3%),显示了较好的适用性。
目前,有关基于EPID射野剂量图像的PD技术做治疗计划质量控制与质量保证的研究较多,主要包括对患者每日质量控制自动化系统的敏感性研究[15-16]和基于PD技术进行载体剂量验证软件的测试评价[17-18]。Held等[19]讨论了基于EPID的载体剂量验证软件的测试和评价,局部剂量测量点的剂量对比偏差满足γ分析3 mm/5%或3%的评估标准,通过率可达到92%。
本研究对比Oct1500和PD两种方式和多种评估策略在HalcyonTM加速器剂量验证工作的验证结果。对于Oct1500验证方式,由于矩阵分辨率不高,本研究并未采用更严格的评估策略进行试验,仅采用临床常用3 mm/3%的评估策略,局部剂量评估策略较为严格,少量射野通过率较低,主要由于射野内高剂量区占比较小,是否与HalcyonTM机型的优化方式有关,还有待进一步研究论证。Oct1500方式采用3 mm/3%、最大剂量的评估策略基本可以满足临床需求。
PD方式属于治疗前的预验证,本研究仅研究二维单野的验证,并未利用PD提供的剂量叠加工具合并整个治疗计划的验证结果,不能反映整个治疗计划的剂量精度,与传统的验证方式并无太大差异,仅在空间分辨率和验证效率上优于Oct1500方式,高分辨率有利于提高验证精度,对于γ 2D评估方式通过率的提高有积极影响。对于PD方式的3种评估策略,在3 mm为半径的圆内分别有约66、264、595个点参与评估,因此考虑到PD方式的高分辨率,本研究推荐使用2 mm/2%的评估策略,更能体现PD方式的验证精度,也可以对HalcyonTM加速器治疗计划进行更为精确的评价。
本研究下一步的方向为基于PD方式的Adaptivo软件重建三维在体剂量在线验证其验证方式的精度和效率,并进一步区分IMRT和VMAT两种治疗技术在剂量优化方式和剂量传递精度方面的问题。
志谢 本项目还得到北京大学医学科技创新平台发展基金——青年培育基金资助项目(BMU2017PY028,BMU2017PY003)和北京市属医院科研培育项目(PX2019042)的支持利益冲突 所有研究者,未因进行该研究而接受任何不正当的职务或财务利益,在此对研究的独立性和科学性予以保证
作者贡献声明 胡俏俏负责设计研究方案,收集数据后统计并起草论文;蒋璠、王美娇负责文章校对;张艺宝、姚凯宁、弓健负责数据测量和整理;吴昊、岳海振指导、监督试验进行,修改论文
| [1] |
Nakaguchi Y, Oono T, Maruyama M, et al. Commissioning and validation of fluence-based 3D VMAT dose reconstruction system using new transmission detector[J]. Radiol Phys Technol, 2018, 11(2): 165-173. DOI:10.1007/s12194-018-0451-8 |
| [2] |
Vikraman S, Manigandan D, Karrthick KP, et al. Quantitative evaluation of 3D dosimetry for stereotactic volumetric-modulated arc delivery using COMPASS[J]. J Appl Clin Med Phys, 2014, 16(1): 5128. DOI:10.1120/jacmp.v16i1.5128 |
| [3] |
Boggula R, Lorenz F, Mueller L, et al. Experimental validation of a commercial 3D dose verification system for intensity-modulated arc therapies[J]. Phys Med Biol, 2010, 55(19): 5619-5633. DOI:10.1088/0031-9155/55/19/001 |
| [4] |
Jeevanandam P, Agnew CE, Irvine DM, et al. Improvement of off-axis SABR plan verification results by using adapted dose reconstruction algorithms for the Octavius 4D system[J]. Med Phys, 2018, 45(4): 1738-1747. DOI:10.1002/mp.12805 |
| [5] |
Rajasekaran D, Jeevanandam P, Sukumar P, et al. A study on correlation between 2D and 3D gamma evaluation metrics in patient-specific quality assurance for VMAT[J]. Med Dosim, 2014, 39(4): 300-308. DOI:10.1016/j.meddos.2014.05.002 |
| [6] |
Stelljes TS, Harmeyer A, Reuter J, et al. Dosimetric characteristics of the novel 2D ionization chamber array OCTAVIUS Detector 1500[J]. Med Phys, 2015, 42(4): 1528-1537. DOI:10.1118/1.4914151 |
| [7] |
Van Esch A, Basta K, Evrard M, et al. The Octavius15002D ion chamber array and its associated phantoms:dosimetric characterization of a new prototype[J]. Med Phys, 2014, 41(9): 091708. DOI:10.1118/1.4892178 |
| [8] |
Roxby KJ, Crosbie JC. Pre-treatment verification of intensity modulated radiation therapy plans using a commercial electronic portal dosimetry system[J]. Australas Phys Eng Sci Med, 2010, 33(1): 51-57. DOI:10.1007/s13246-010-0001-0 |
| [9] |
Fogliata A, Clivio A, Fenoglietto P, et al. Quality assurance of RapidArc in clinical practice using portal dosimetry[J]. Br J Radiol, 2011, 84(1002): 534-545. DOI:10.1259/bjr/72327299 |
| [10] |
Vinall AJ, Williams AJ, Currie VE, et al. Practical guidelines for routine intensity-modulated radiotherapy verification:pre-treatment verification with portal dosimetry and treatment verification with in vivo dosimetry[J]. Br J Radiol, 2010, 83(995): 949-957. DOI:10.1259/bjr/31573847 |
| [11] |
Low DA, Harms WB, Mutic S, et al. A technique for the quantitative evaluation of dose distributions[J]. Med Phys, 1998, 25(5): 656-661. DOI:10.1118/1.598248 |
| [12] |
Stock M, Kroupa B, Georg D. Interpretation and evaluation of the gamma index and the gamma index angle for the verification of IMRT hybrid plans[J]. Phys Med Biol, 2005, 50(3): 399-411. DOI:10.1088/0031-9155/50/3/001 |
| [13] |
Lin LI. A concordance correlation coefficient to evaluate reproducibility[J]. Biometrics, 1989, 45(1): 255-268. DOI:10.2307/2532051 |
| [14] |
Bruschi A, Esposito M, Pini S, et al. How the detector resolution affects the clinical significance of SBRT pre-treatment quality assurance results[J]. Phys Med, 2018, 49: 129-134. DOI:10.1016/j.ejmp.2017.11.012 |
| [15] |
Alharthi T, Pogson EM, Arumugam S, et al. Pre-treatment verification of lung SBRT VMAT plans with delivery errors:Toward a better understanding of the gamma index analysis[J]. Phys Med, 2018, 49: 119-128. DOI:10.1016/j.ejmp.2018.04.005 |
| [16] |
Zhuang AH, Olch AJ. Sensitivity study of an automated system for daily patient QA using EPID exit dose images[J]. J Appl Clin Med Phys, 2018, 19(3): 114-124. DOI:10.1002/acm2.12303 |
| [17] |
Stevens S, Dvorak P, Spevacek V, et al. An assessment of a 3D EPID-based dosimetry system using conventional two-and three-dimensional detectors for VMAT[J]. Phys Med, 2018, 45: 25-34. DOI:10.1016/j.ejmp.2017.11.014 |
| [18] |
Piermattei A, Greco F, Grusio M, et al. A validation study of a dedicated software for an automated in vivo dosimetry control in radiotherapy[J]. Med Biol Eng Comput, 2018, 56(10): 1939-1947. DOI:10.1007/s11517-018-1822-3 |
| [19] |
Held M, Cheung J, Perez AA, et al. Commissioning and evaluation of an electronic portal imaging device-based in-vivo dosimetry software[J]. Cureus, 2018, 10(2): e2139. DOI:10.7759/cureus.2139 |
 2019, Vol. 39
2019, Vol. 39


